2-甲基烯丙基氯水解动力学研究
陈志荣,王 斌,袁慎峰,尹 红
(浙江省化工高效制造技术重点实验室,浙江大学 化学工程与生物工程学院,浙江 杭州310027)
1 前 言
2-甲基烯丙基醇是一种重要的有机化工中间体,广泛用于农药、医药、香料、树脂和聚羧酸减水剂等有机合成领域[1]。2-甲基烯丙基醇含有羟基和不饱和双键两种官能团,可溶于水和有机溶剂,能发生自聚、共聚和酯化等多种反应[2],它和环氧乙烷反应生成 2-甲基烯丙基聚氧乙烯醚,可用于合成第四代聚羧酸基混凝土减水剂[3];它和有机酸酯化生成 2-甲基烯丙基酯,可用于表面活性剂、混凝土外加剂、聚醚大单体起始剂等领域[4]。
2-甲基烯丙基醇的合成方法主要有2-甲基烯丙基氯(methallyl chloride,简称MAC) 水解法[5]和2-甲基丙烯醛还原法[6]。水解法又分为一步水解法和酯化-水解两步法[7-8],其中一步水解法是工业生产中最为常用的方法[9],但该法会生成副产物二-(2-甲基烯丙基)-醚[10],影响反应选择性和收率。目前,国内外对2-甲基烯丙基醇合成的研究多见于专利文献报道[11-15],主要是改进生产工艺、优化操作条件以提高产物收率,未见相关反应动力学和反应机理研究的报道。为此,本文将对2-甲基烯丙基氯与碱作用水解反应动力学进行研究。
2 实验部分
2.1 实验原料
2-甲基烯丙基醇 (安耐吉化学,99%),2-甲基烯丙基氯(安耐吉化学,99%),氢氧化钠 (Aladdin公司,≥98%),异丁醇 (MACKLIN 公司,分析纯),去离子水 (杭州娃哈哈集团有限公司)。

图1 实验装置示意图Fig.1 Schematic diagram of the experimental apparatus
2.2 实验装置及方法
2-甲基烯丙基氯 (MAC) 与碱作用水解反应需要较高反应温度,由于反应温度高于 MAC的沸点,因此,反应在高压反应釜中进行。产物 2-甲基烯丙基醇不仅易溶于有机相,而且部分溶于水相,为了保证对各组分取样分析的准确性,本文采用间歇动力学实验方法。具体方法如下:在如图1所示的250 mL磁力耦合机械搅拌高压反应釜中,依次投入MAC、氢氧化钠、去离子水,密封后检查气密性,合格后开启加热和搅拌。以设定升温速率加热,当反应温度达到设定值并稳定后开始计时,达到设计的反应时间后停止加热和搅拌。将反应釜快速放入冰水浴中冷却至25℃左右,取出反应物,测量体积,并转移至分液漏斗中静置分层。分别称量油相和水相的质量与体积,并取样进行气相色谱分析,确定二相中各组分的含量。
2.3 分析方法
使用 GC-5190气相色谱仪进行定量分析,以异丁醇为内标。气相色谱分析条件如下:色谱柱为PEG20M强极性石英毛细管柱 (30m × 0.25mm × 0.25μm),氢火焰离子化检测器,柱温初始值为70 ℃,保持6 min,之后以10 ℃⋅min-1升温至120 ℃并保持3min,汽化温度为250 ℃,检测器温度为280 ℃。
3 实验结果与讨论
3.1 传质影响的排除
卤代烃水解反应是典型的液-液非均相反应,二相间的传质速率对宏观反应速率有显著影响。对于间歇搅拌釜式反应,搅拌速度增加,相界面积增加,二相间的传质速度加快,传质对反应的影响减小。图2是当反应温度为383.15K(实验的最高反应温度)、MAC和氢氧化钠的摩尔比为1.0、氢氧化钠水溶液质量分数ω=10%时,搅拌转速对MAC转化率的影响。由图2可见,当搅拌转速大于450 r⋅min-1时,MAC的转化率不再受搅拌转速的影响,因此,可以认为搅拌转速大于450 r⋅min-1时传质影响已排除。为确保排除传质的影响,本文动力学实验均在600 r⋅min-1条件下进行。
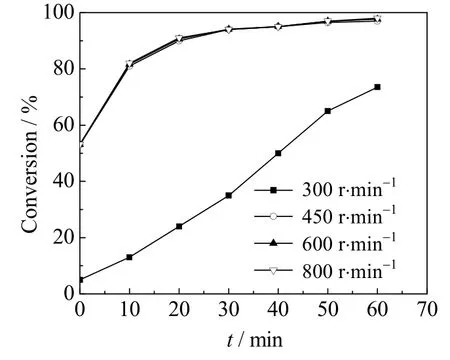
图2 搅拌转速对MAC转化率的影响Fig.2 Effects of stirring speed on MAC conversion
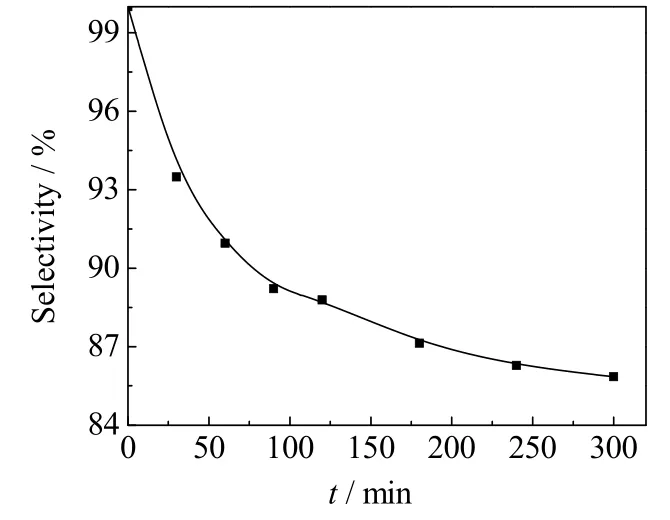
图3 反应时间对2-甲基烯丙基醇选择性的影响Fig.3 Effects of reaction time on the selectivity of methallyl alcohol
3.2 反应时间对选择性的影响
图3是反应温度为353.15K、MAC和氢氧化钠的摩尔比为1.0、氢氧化钠水溶液质量分数ω=10%时,2-甲基烯丙基醇的选择性随时间的变化。由图 3可见,2-甲基烯丙基醇的选择性随着反应的进行而逐渐降低,这是连串反应中间产物选择性的典型变化规律。
3.3 反应温度对选择性的影响
图4是MAC和氢氧化钠的摩尔比为1.0、氢氧化钠水溶液质量分数ω=10%时,2-甲基烯丙基醇的选择性随转化率的变化情况。由图4可见,2-甲基烯丙基醇的选择性随反应温度升高而升高,由此可以判断该体系主反应的活化能高于副反应,升高温度对反应有利。

图4 反应温度对2-甲基烯丙基醇选择性的影响Fig.4 Effects of reaction temperatures on the selectivity of methallyl alcohol

图5 原料配比对反应的影响Fig.5 Effects of molar ratios on the reaction
3.4 原料配比对反应的影响
图5是反应温度为353.15K、水用量为144g时,氢氧化钠和MAC摩尔比对反应选择性的影响。由图5可见,随着氢氧化钠和MAC摩尔比的增加,2-甲基烯丙基醇的选择性增加。其原因是 MAC的水解需要碱性环境,适当增加碱量有利于维持良好碱性环境,加快主反应速率,提高反应选择性。但是碱量增加对反应选择性提高幅度不大,摩尔比增加 0.1,选择性只增加1%左右,考虑到过量的碱会造成原料浪费,加快对设备的腐蚀,因此选择氢氧化钠和MAC摩尔比为1.0。

图6 氢氧化钠浓度对反应的影响Fig.6 Effects of sodium hydroxide concentration on the reaction selectivity
3.5 氢氧化钠浓度对反应的影响
图6是反应温度 353.15K、氢氧化钠与 MAC摩尔比为1.0时,氢氧化钠浓度对反应的影响。由图6可见,氢氧化钠质量分数增加,即水用量减少,2-甲基烯丙基醇的选择性有所下降,但幅度不大。其原因是水用量减少有利于氢氧化钠和2-甲基烯丙基醇正向反应,生成更多的2-甲基烯丙基醇钠,从而促进成醚副反应。但是降低氢氧化钠浓度会导致含盐废水量增加,增加后处理成本,因此,合适的氢氧化钠质量分数ω=10%左右。
3.6 2-甲基烯丙基氯水解反应动力学
3.6.1 反应机理及动力学模型
MAC水解反应是SN2取代反应,生成产物2-甲基烯丙基醇;同时,2-甲基烯丙基醇又和MAC反应生成副产物二-(2-甲基烯丙基)-醚。反应方程式如下:

为验证反应机理的可靠性,本文安排了以下二个实验:一是将MAC与2-甲基烯丙基醇及水一起加热到383.15K并保温1 h,反应产物中没有发现副产物二-(2-甲基烯丙基)-醚;二是将 2-甲基烯丙基醇与氢氧化钠水溶液一起加热到383.15 K并保温1 h,也未发现副产物二-(2-甲基烯丙基)-醚。由此可以确定二-(2-甲基烯丙基)-醚的生成途径为:2-甲基烯丙基醇先和氢氧化钠反应生成2-甲基烯丙基醇钠,再与MAC反应生成二-(2-甲基烯丙基)-醚。其中2-甲基烯丙基醇与氢氧化钠反应生成2-甲基烯丙基醇钠属于离子交换快反应,可以认为在任何时刻都达到平衡。
根据上述反应机理,并假设反应在水相中进行,反应速率方程可表示为:
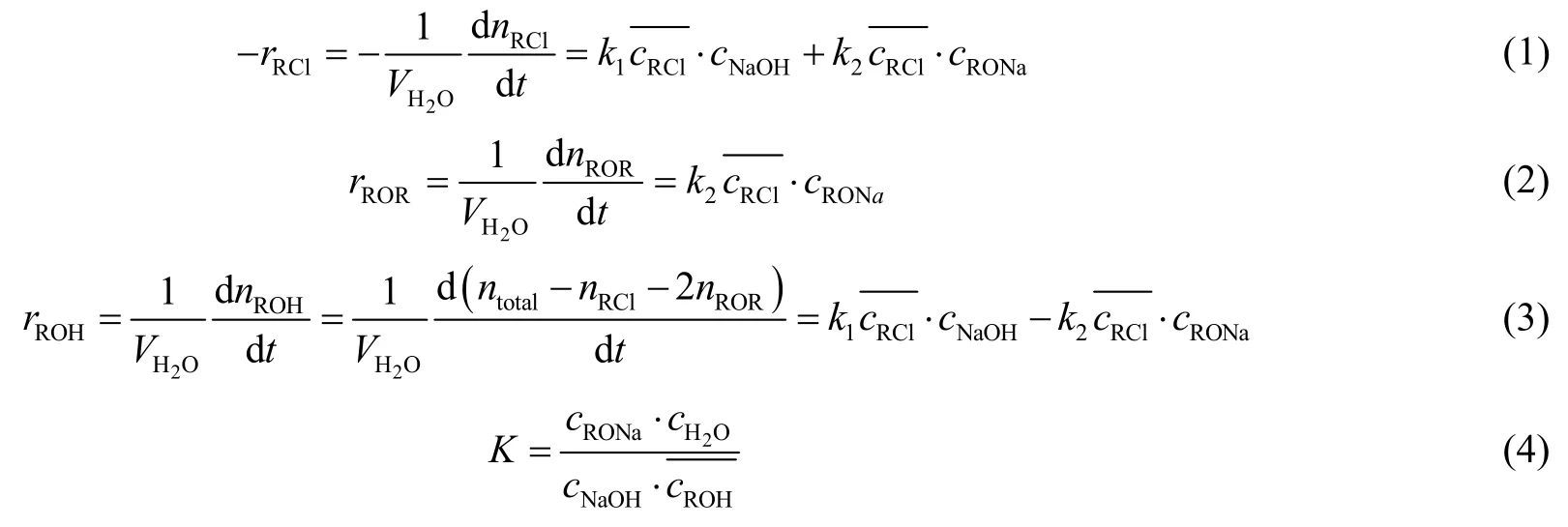
式中,下标RCl代表MAC,下标ROH代表2-甲基烯丙基醇,下标ROR代表二-(2-甲基烯丙基)-醚,下标RONa代表甲基烯丙基醇钠,上标 ̄代表该化合物在水相的浓度。
由式(4)可得甲基烯丙基醇钠浓度表达式为:

由式 (6) 和 (7)可得MAC的浓度表达式如下:

由于MAC在水中的溶解度很小,可认为KRCl>>1。同理可以得到2-甲基烯丙基醇的浓度表达式。

将式(1)和(2)相减,并将式(8)代入,可得:
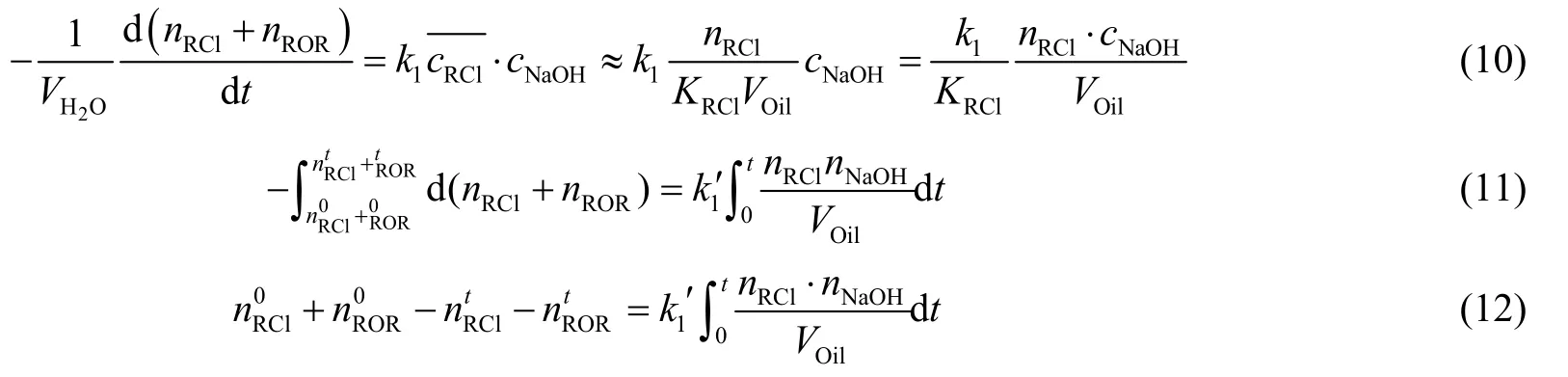
式(12)等号左边记作y1(n)、等号右边积分项记作x1(t),于是

由式(2)、式(5)、式(8)和式(9)可得:

式(15)等号左边记作y2(n)、等号右边积分项记作x2(t),于是

3.6.2 动力学参数的估算
对动力学方程通过积分法进行线性化处理,得到式 (12) 和式 (15) 。其中,实际反应温度下的油相和水相反应体积VOil和VH2O用常温下实际测得体积近似代替。KROH由实验测量得到,其方法是:取一定质量的2-甲基烯丙基醇,分别与质量分数ω=10%的氢氧化钠溶液、氢氧化钠和氯化钠混合溶液 (假设实际反应过程中50% 氢氧化钠转化成氯化钠)、氯化钠溶液 (假设氢氧化钠全部转化成氯化钠) 充分搅拌下混合,升温到所需温度后保持恒温,待混合充分后静置6 h以上,分别取样测出油相和水相中2-甲基烯丙基醇的浓度,计算对应转化率下的KROH。
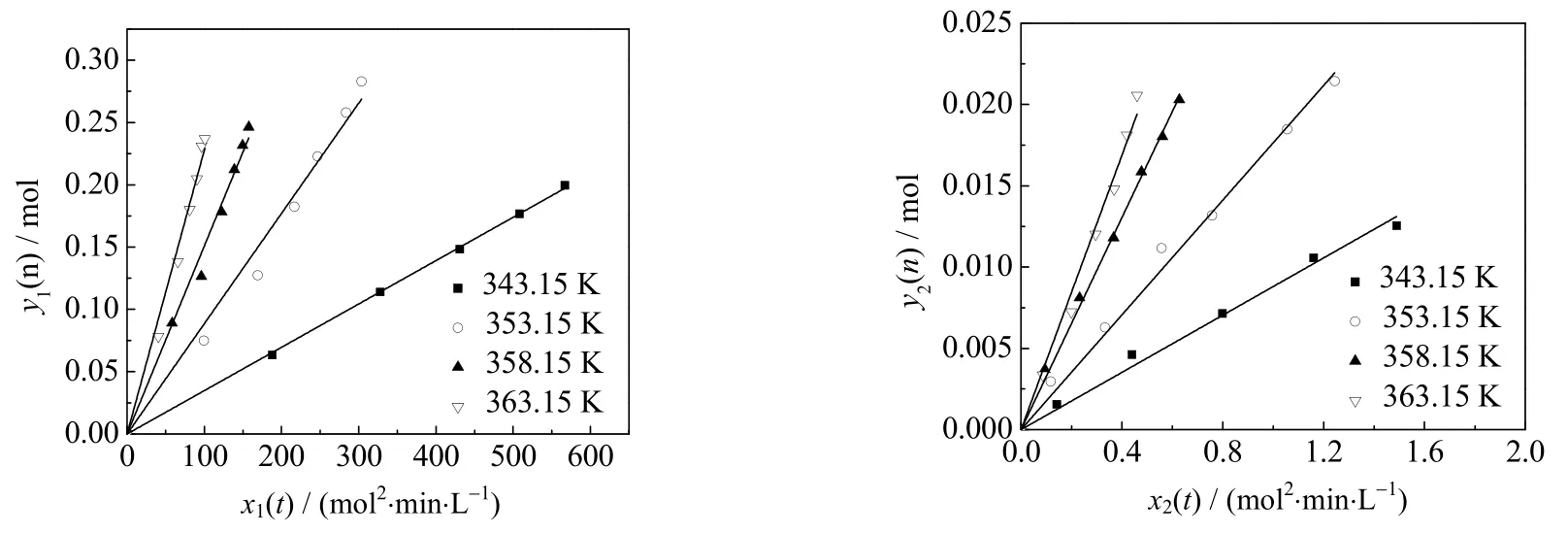
图7 不同温度下y(n)随x(t)的变化Fig.7 Profiles of x(t)~y(n) at different temperatures
由于温度过高时反应太快,并且2-甲基烯丙基醇会和水共沸,无法测得2-甲基烯丙基醇的分配系数,所以动力学实验时反应温度选择在 343.15~363.15K。将实验得到的反应物及产物的量代入式 (12) 和式(15) 进行拟合,求出x(t) 和y(n),结果见图7,由此得到不同温度下的反应速率常数(见表1)。结合Arrhenius方程以 -lnk′ 对1/T作图,结果如图8所示。由图8可求得MAC和氢氧化钠反应的活化能E为 98.25kJ⋅mol-1、指前因子k0为 3.101×1011L⋅mol-1⋅min-1,MAC和2-甲基烯丙基醇钠反应的活化能E为 83.89kJ⋅min-1、指前因子k0为 5.024×1010L⋅mol-1⋅min-1。

表1 不同反应温度下的反应速率常数Table 1 Reaction rate constants at different temperatures

图8 -lnki′与 T-1 关系Fig.8 Relationship between -lnki′ and T-1
3.6.3 动力学模型的验证
为了验证上述动力学模型的可靠性,本文在反应温度353.15和363.15K、氢氧化钠与MAC摩尔比变为 1.1,氢氧化钠水溶液质量分数仍为ω=10%条件下进行动力学实验,将实验数据代入式 (12) 和式(15),求出x(t)和y(n),绘制在图9上;而图中的直线则为相同温度下氢氧化钠与MAC摩尔比为1.0时的x(t) ~y(n) 拟合线。由图9可见,氢氧化钠与MAC摩尔配比改变前后,二者符合良好,也就是说,动力学模型依然适用。

图9 不同原料配比的实验值与拟合值对比Fig.9 Comparison of experimental and fitting data at different mole ratios
4 结 论
本文研究了2-甲基烯丙烯基氯的水解反应动力学,提出了反应机理和动力学模型,在排除传质影响条件下,反应温度为343.15~363.15 K、氢氧化钠和2-甲基烯丙基氯摩尔比为1.0~1.1、氢氧化钠水溶液质量分数为10%条件下,反应动力学方程可表述为:

符号说明:


