假基因DUXAP8在肝癌中的表达及其临床意义
王 纯, 叶明亮, 陈志航, 罗 杰, 洪莹晖, 赵 秋, 常 莹
1 武汉大学中南医院 消化内科, 武汉 430071; 2 广西医科大学第一附属医院 结直肠肛门外科, 南宁 530021
肝细胞癌是全球第六大常见的实体癌和第二大致死性恶性肿瘤[1]。根据2014年世界卫生组织发布的世界癌症报告[2],中国肝癌新发病例占全球新发病例的一半,死亡总数占全球一半以上。目前治疗肝癌的方法以手术治疗为主和(或)结合介入治疗、局部治疗以及放化疗为辅的多学科治疗,但由于肝癌患者被诊断时往往已是肝癌晚期,肿瘤解剖位置不佳、肿瘤过大、原发肿瘤数量多和肝外转移使其错过了最佳治疗的时机,预后往往很差。因此,探索肝癌发生机制及新的治疗策略极为重要。
假基因是基因家族在进化过程中形成的无功能的残留物[3],但近年来研究发现,其广泛参与了细胞的生物学过程。部分假基因可以转录非编码RNA,这些长度超过200 nt的非编码RNA为长链非编码RNA(long noncoding RNAs,lncRNA)的一类。近年来许多研究[4-6]表明,lncRNA可以作为细胞核和细胞质中的基因表达调节剂,主要在表观遗传学调控、转录调控及转录后调控3个层面调控基因表达。这些特征使得lncRNA作为原癌基因或抑癌基因的角色参与了肿瘤的发生发展,其在肿瘤细胞中的异常表达与肿瘤的发生发展、肿瘤细胞的耐药性、肿瘤的诊断和预后等也有着密切的联系[7-9]。尽管现在已经对大量的lncRNA进行了测序和注释,但其中只有一小部分lncRNA的功能得到了阐述,它们大多数发挥作用的潜在分子机制仍待确认。
DUXAP8(double homeobox A pseudogene 8)为假基因来源的lncRNA,已有研究表明DUXAP8在膀胱癌[10]、非小细胞肺癌[11]、胰腺癌[12]和肾癌[13]等癌症中高表达,沉默DUXAP8后,肿瘤细胞的增殖、侵袭能力受到抑制,同时也诱导了肿瘤细胞发生凋亡,提示DUXAP8可能参与了这些肿瘤的发生发展过程。但是关于DUXAP8在肝癌中的研究尚无报道,因此探究DUXAP8参与肝癌发生发展的作用机制具有重要意义。
1 材料与方法
1.1 数据资料收集 从TCGA数据库(https://portal.gdc.cancer.gov/)中下载截至2019年6月的肝癌组织和癌旁组织RNA-seq数据以及肝癌患者临床数据。
1.2 数据分析
1.2.1 DUXAP8表达谱数据分析 非配对样品(375个肝癌组织、50个癌旁组织)和50对配对样品分别进行了Wilcoxon秩和检验和Wilcoxon符号秩和检验。
1.2.2 DUXAP8与临床病理参数的相关性研究 表达谱数据和临床数据配对后,对患者年龄、性别、病理分期、临床分期、T分期与DUXAP8表达量之间的关系进行Wilcoxon秩和检验,以评估临床病理特征与DUXAP8表达之间的关系。
1.2.3 DUXAP8或Hub基因与预后的相关性研究 临床数据(n=377)删除1例无随访时间数据,删除5例生存但随访时间为0的数据,得到371例生存数据。表达谱数据(n=374)剔除重复项目3项后为371例。由于某些样本未测表达量,有些患者生存数据删失,最终匹配的数据为365例。根据表达谱数据,对365例样本的DUXAP8或Hub基因的表达进行由高到低的排序,前50%的样本作为高表达组,后50%的样本作为低表达组样本;根据指定基因的表达水平分成高表达组和低表达组,利用Kaplan-Meier方法分析两组患者10年生存率的差异,组间比较采用log-rank检验。
1.2.4 总体生存率的单变量和多变量分析 对365例数据使用Cox回归分析患者的总体生存率和临床病理特征之间的相关性以及变量选择后的多变量生存模型。
1.2.5 DUXAP8相关基因及其功能分析 利用表达谱数据筛选DUXAP8的相关基因[Pearson相关法: 相关系数(r)≥0.3且P<0.05]。利用基因本体论(Gene Ontology,GO)、京都基因百科全书和基因组(Kyoto Encyclopedia of Genes, and Genomes,KEGG)对相关基因分别进行功能和通路分析。
1.2.6 DUXAP8相关靶基因的Hub基因的筛选 取DUXAP8相关靶基因r>0.4的基因,利用在线数据库STRING(https://string-db.org/)做蛋白质相互作用分析,然后将蛋白质相互作用网络数据导入Cytoscape(https://cytoscape.org/),根据degree算法计算排名前十的关键基因即Hub基因。
1.2.7 数据分析 使用R语言(v.3.5.1)分析和处理数据并生成统计分析表格和图片。以P<0.05 为差异有统计学意义。
2 结果
2.1 TCGA下载的患者临床特征 从TCGA下载的376例肝癌患者的临床特征见表1。
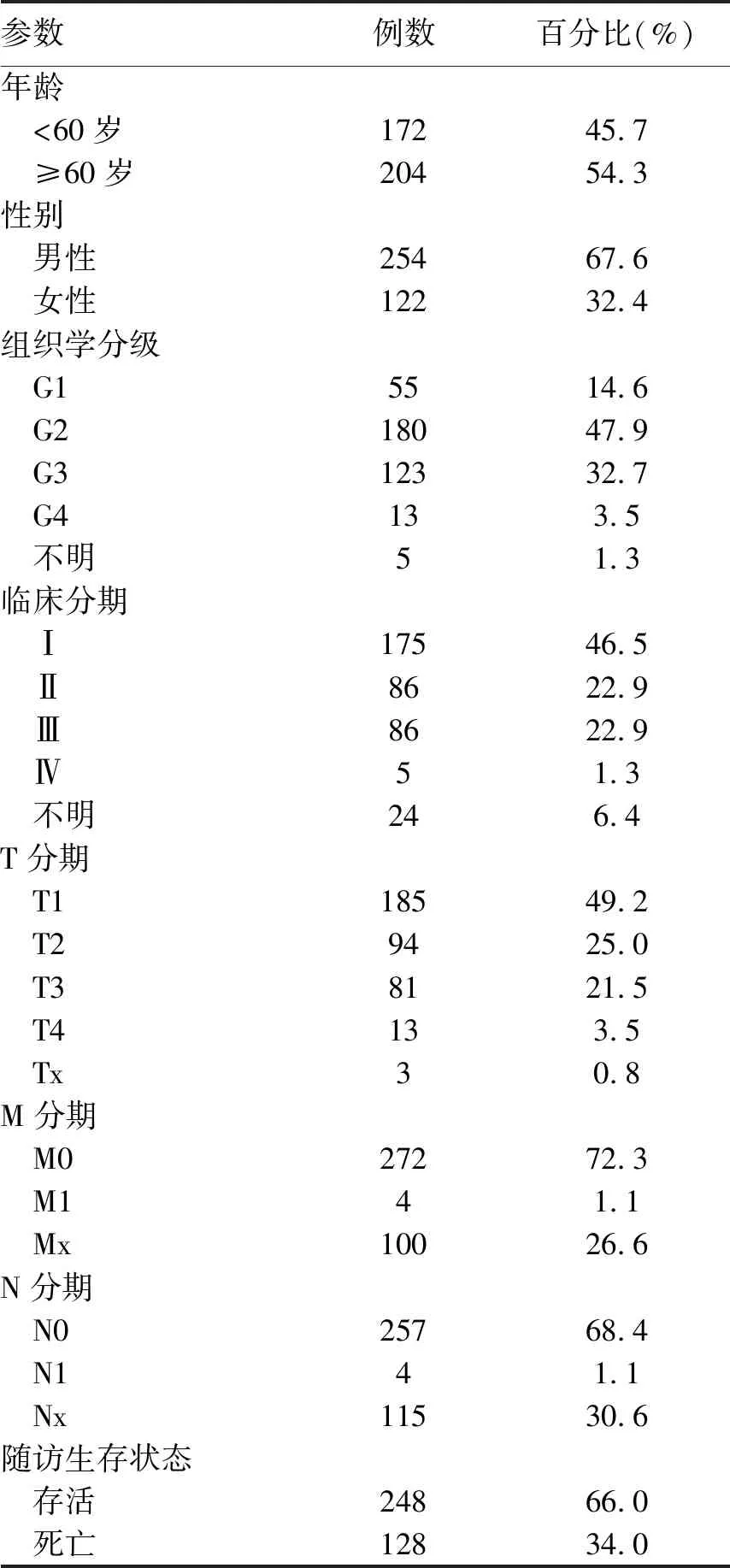
表1 TCGA数据库中肝癌患者的临床特征(n=376)
2.2 TCGA下载的RNA-seq数据筛选lncRNA 在TCGA下载的RNA-seq数据中,从531个差异表达的lncRNA中按照癌与癌旁差异表达符合logFc>2,P<0.01且同时满足风险比(HR)>1,P<0.01的条件,筛选出了38个符合该条件的lncRNA(图1)。在排名前三的lncRNA(DDX11-AS1、MAFG-DT、DUXAP8)中,已有文献报道DDX11-AS1通过与EZH2和DNMT1相互作用在肝癌中表观遗传抑制LATS2,从而促进肝癌细胞的增殖、周期、迁移和侵袭等生物学表型[14];DDX11-AS1的表达水平也与肝癌患者的预后相关[15]。TCGA数据分析以及肝癌细胞定量检测表明MAFG-DT在肝癌组织和肝癌细胞中均中高表达,并且通过靶向抑制miR-6852促进肝癌细胞侵袭表型[16]。而目前在肝癌中关于DUXAP8的研究甚少,故选择DUXAP8进行进一步的分析。
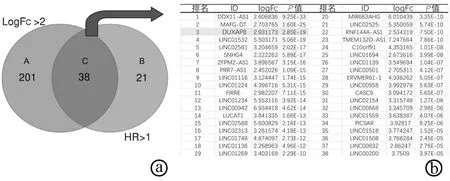
注:a,筛选lncRNA,A为差异表达符合logFc>2,P<0.01的lncRNA,B为符合HR>1,P<0.01的lncRNA,C为同时符合以上两种条件的lncRNA;b,符合条件的lncRNA。
图1肝癌组织中差异表达的lncRNA
2.3 DUXAP8与临床病理参数的关系 分析非配对样品(图2a)及配对样品(图2b)中DUXAP8的表达水平,癌旁组织和肝癌组织之间存在显著差异(P值均<0.001),肝癌组织中DUXAP8表达明显升高。将表达谱数据与临床数据配对后分析各临床病理学变量与DUXAP8表达量之间的关系,发现DUXAP8表达水平在不同性别、病理分期、临床分期的患者间无明显差异(P值均>0.05),但不同年龄、T分期的患者DUXAP8表达差异显著(P值均<0.05),年龄超过60岁或T分期等级为T3或T4,DUXAP8表达量较高(图3a~e)。
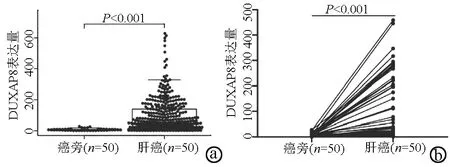
注:a,非配对样品;b,配对样品。
2.4 DUXAP8表达与预后分析 Kaplan-Meier生存曲线显示,DUXAP8高表达组患者的总体生存率低于低表达组患者(P<0.001)(图3f)。这提示DUXAP8是肝癌患者预后不良的相关因素。
2.5 单因素和多因素回归分析预后影响因素 单因素分析显示,临床分期、T分期、DUXAP8表达量与患者总生存期有关(P值均<0.001)。多因素Cox回归分析结果显示,临床分期晚[HR=1.648,95%可信区间(95%CI):1.330~2.709,P<0.001]、高DUXAP8表达(HR=1.849,95%CI:1.262~2.713,P<0.01)仍是预后差的独立危险因素(表2)。
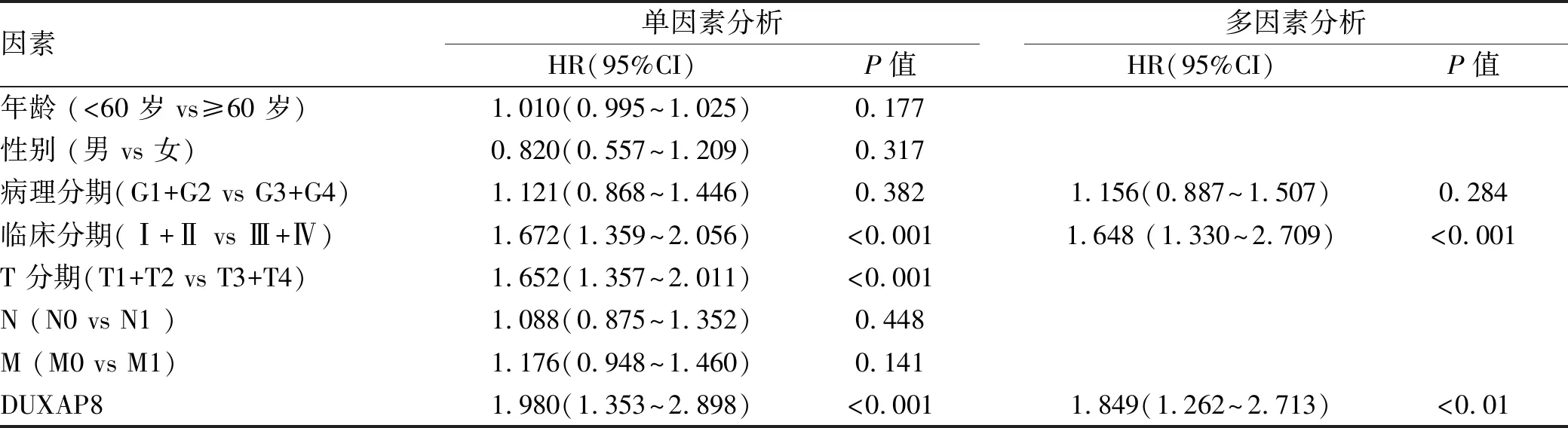
表2 肝癌患者预后单因素与多因素回归分析
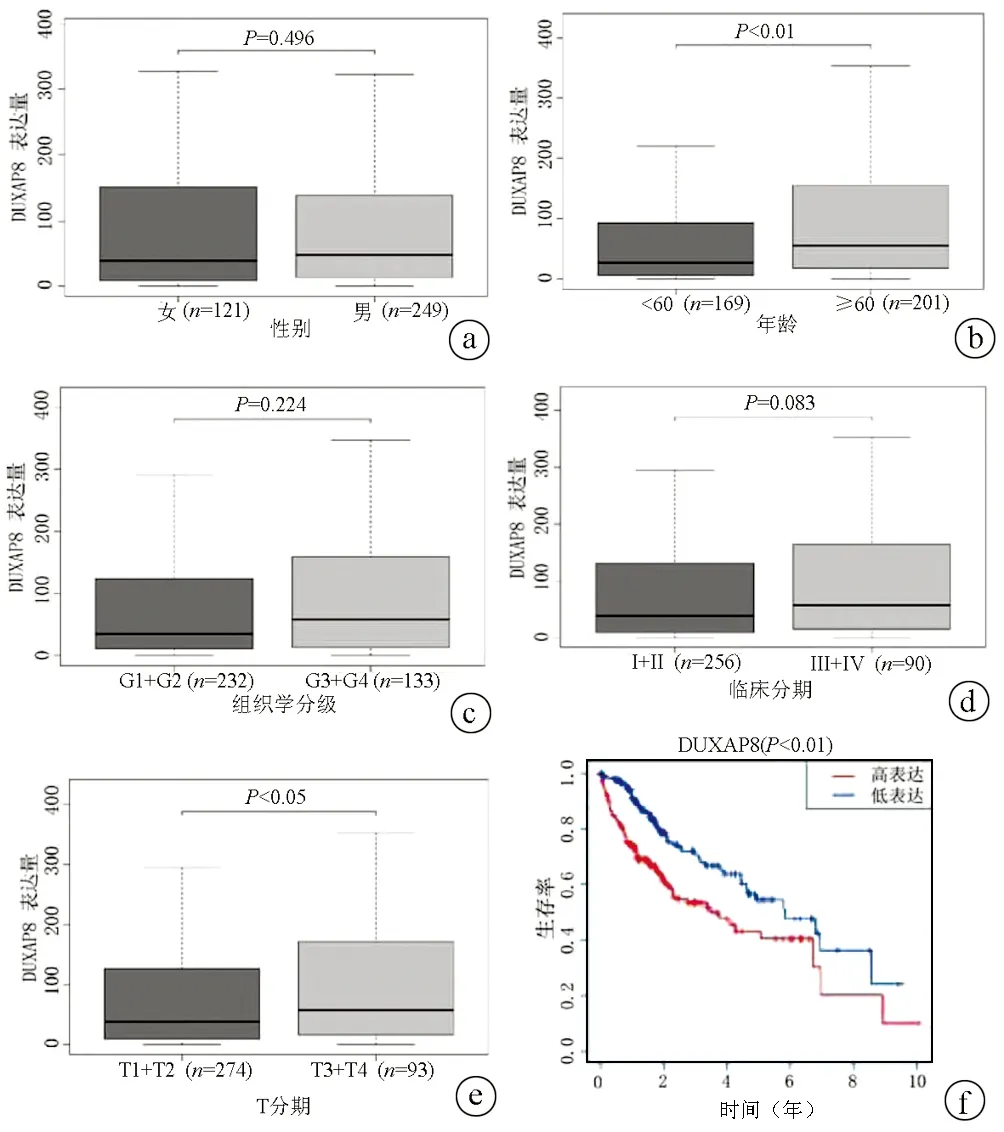
注:a~e,性别、年龄、组织学分级、临床分期和T分期与DUXAP8表达量的关系;f,不同DUXAP8表达水平的肝癌患者生存曲线。
图3DUXAP8与临床病理指标及预后的关系
2.6 DUXAP8的相关基因及其功能分析 DUXAP8高表达样品中,FAM133A、COX7B2、MKRN3、MAGEA1、CARD18和DCAF4L2等(仅显示前6位)多个肿瘤相关基因高表达,而CYB5D2、KBTBD11、IGF2、HEBP1、TTC19和ACADS等(仅显示前6位)低表达(图4)。与DUXAP8相关基因最富集的GO项目是“微管蛋白结合”(GO:0015631;本体论:分子功能; Bonferroni校正P<0.001)和“作用于DNA的催化活性”(GO:0140097;本体论:分子功能; Bonferroni 校正P<0.001)。KEGG通路分析显示341个重叠基因之间有149个基因有显著的富集通路,其中最富集的是“细胞周期”(Bonferroni 校正P<0.001)相关通路(表3)。这些分子功能和生物通路都提示DUXAP8可能与维持肿瘤细胞的增殖和细胞周期等相关。
2.7 DUXAP8相关靶基因的Hub基因及其临床预后分析
通过对DUXAP8相关靶基因进行筛选,发现TOP2A、KIF2C、TTK、PLK1、CDCA8、CDC20、NCAPG、BUB1B、BUB1和CCNA2为DUXAP8相关靶基因的Hub基因(图5a)。
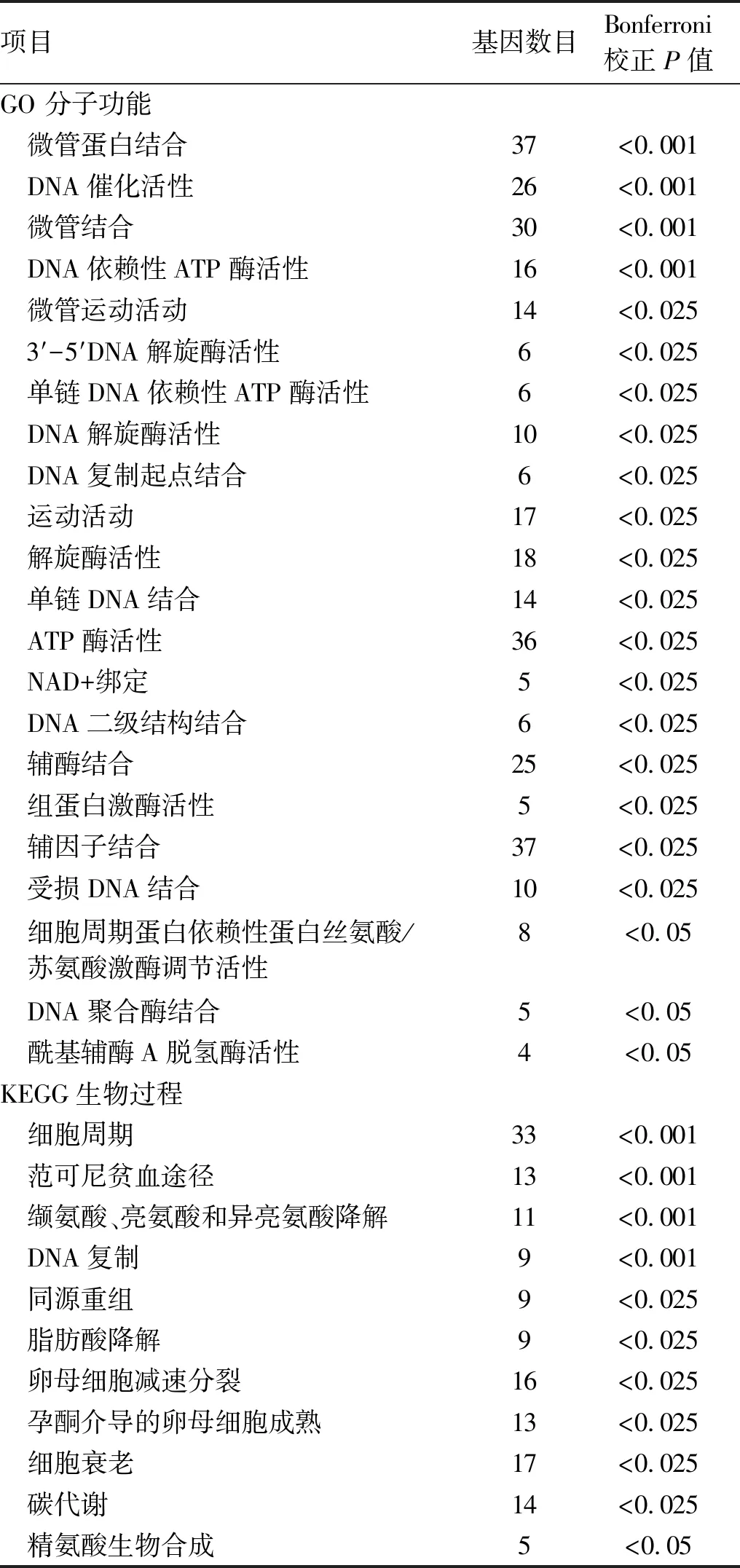
表3 肝癌中DUXAP8相关基因的GO和KEGG通路富集分析
Kaplan-Meier法发现,TOP2A(P<0.01)、KIF2C(P<0.01)、TTK(P<0.01)、PLK1(P<0.01)、CDCA8(P<0.01)、CDC20(P<0.01)、NCAPG(P<0.05)、BUB1B(P<0.01)、BUB1(P<0.01)或CCNA2(P<0.01)高表达组患者的预后均明显差于低表达组患者(图5b~k)。这一结果提示这些Hub基因均是肝癌患者预后不良的相关因素,其高表达与患者生存期缩短显著相关,DUXAP8可能通过影响这些Hub基因参与肝癌的发生发展,影响患者的预后。
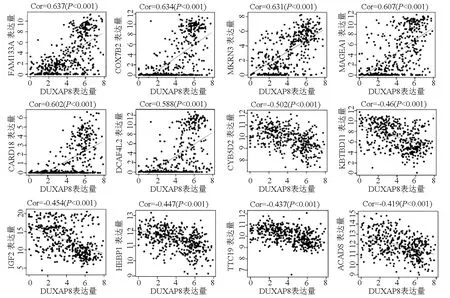
图4 DUXAP8相关基因
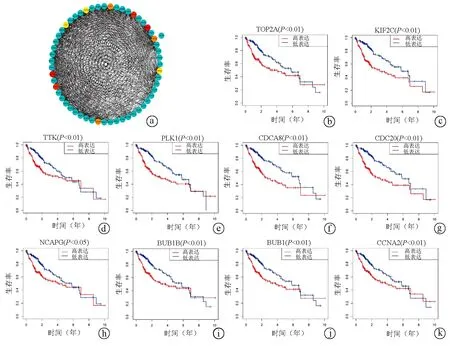
注:a,Hub基因的蛋白互作网络图,红色、橙色和黄色圆内的基因均为Hub基因,蓝色为与Hub基因有联系的其他基因;
3 讨论
长期以来,假基因被认为是废物基因组的非功能性遗物。而近十年来,有不少研究证实了假基因在肿瘤生物学功能方面扮演了重要的角色。假基因作为促癌基因或抑癌基因参与了肿瘤的发生发展,如OCT4-pg4作为OCT4的假基因,可作为天然海绵作用保护OCT4转录物免受miR-145的抑制,还可以促进肝癌细胞的生长和成瘤性,在肝癌中发挥致癌作用[17];PTENpg1as是肿瘤抑制基因PTEN的假基因,PTENpg1asRNAα定位于PTEN的启动子并通过募集DNMT3A和EZH2调节PTEN转录,而PTENpg1asRNAβ可作为miRNA海绵影响PTEN的转录后调节,PTENpg1as从而通过以上两种途径抑制肿瘤的发生[18]。本实验所涉及的假基因来源的DUXAP8定位于22q11.1,长2107 bp,是DUXA同源异型盒基因家族的成员。因为DUXAP8、DUXAP9和DUXAP10这三个基因座具有99%的核苷酸同一性,故DUXAP8可能是通过整合后复制或来自DUXAP9或DUXAP10的转录本逆转录而产生的[19]。在非小细胞肺癌中,DUXAP8通过与组蛋白去甲基化酶LSD1和组蛋白甲基转移酶EZH2结合抑制肿瘤抑制因子EGR1和RHOB转录,从而促进细胞的增殖、迁移和侵袭[11]。DUXAP8在膀胱癌中高表达,沉默DUXAP8后膀胱癌细胞系(UMUC3和SW780)的细胞增殖、单克隆形成、侵袭能力受到抑制,并且诱导细胞发生凋亡[10]。在胰腺癌组织和胰腺癌细胞系(AsPC-1、BxPC-3和PANC-1)中DUXAP8表达明显增加,DUXAP8通过将EZH2和LSD1募集至CDKN1A和KLF2启动子区域来抑制CDKN1A和KLF2表达,抑制了细胞增殖和侵袭能力,并诱导细胞发生凋亡;在裸鼠模型中,沉默DUXAP8可抑制肿瘤的生长[12]。
本研究通过大数据发现DUXAP8在癌旁组织和肝癌组织中表达具有显著差异,且在肝癌组织中表达明显增加,高DUXAP8表达与患者预后差相关,提示DUXAP8可能作为促癌基因参与了肝癌发生。患者年龄越大或T分期等级越高DUXAP8表达量越高,提示了患者的年龄和肿瘤的原发病灶与DUXAP8有关。通过GO和KEGG通路富集分析,发现DUXAP8的相关基因主要参与细胞周期,范可尼贫血途径,缬氨酸、亮氨酸和异亮氨酸降解,DNA复制以及同源重组等生物过程,提示DUXAP8可能通过影响细胞增殖和细胞周期等生物过程参与了肝癌的发生发展。通过Kaplan-Meier分析发现,高表达的Hub基因与患者生存期缩短显著相关。美国国家生物技术信息中心(https://www.ncbi.nlm.nih.gov/gene/)对DUXAP8相关基因的Hub基因注释显示,这些基因主要与细胞有丝分裂及细胞周期等生物学过程相关。如DNA拓扑异构酶IIA(DNA topoisomerase II alpha ,TOP2A)是细胞内重要的核酶,在细胞DNA复制、转录和有丝分裂等生物过程中发挥重要作用,编码这种酶的基因是几种抗癌药物的靶标[20-21]。有研究[22-23]表明在肝癌组织中TOP2A表达明显高于癌旁组织,这一结果与大样本数据库的结果一致,且TOP2A的高表达与微血管侵犯、高的组织学分级、肝癌发生时的年龄以及生存期缩短密切相关。这些结果提示了DUXAP8可能通过Hub基因影响细胞的增殖、周期以及耐药性等过程,从而参与肝癌的发生发展,影响患者预后。由于以上数据都是基于TCGA数据库中的信息,未来尚需要进一步的实验来验证这些结果。
综上所述,高表达DUXAP8可能通过影响细胞增殖、周期等过程促进肝癌的发生发展,并对肝癌患者预后产生不利影响,故有望成为肝癌患者的诊断、预后评价及基因治疗的新指标。

