接种根瘤菌后3个紫花苜蓿品种耐盐性综合评价1)
张慧敏 高永 程波 樊璐 通旭芳 万芳 刘雅婧
(内蒙古农业大学,呼和浩特,010020) (水利部牧区水利科学研究所) (内蒙古农业大学)
全球至少有20%甚至有人估计50%的水浇地受盐碱影响[1]。随着中国农业产业结构的调整,牧草作物在畜牧业发展及生态环境治理方面发挥着非常重要的作用[2]。紫花苜蓿(MedicagosativaL.)属豆科多年生草本植物,是世界上种植最为广泛的牧草之一,具有产量高、适应性强、营养丰富、草质优良、易于家畜消化等特点,其营养价值居牧草之首,有“牧草之王”的美誉[3]。
土壤盐害已成为影响植物种子萌发、作物生长和产量的主要非生物胁迫因素[4]。盐害可导致植物体内超氧阴离子、过氧化氢和羟基自由基积累,大量积累的活性氧引起蛋白质和核酸氧化进而造成细胞损伤[5]。植物则通过提高抗氧化系统酶活性减轻盐胁迫的伤害[6]。内蒙古地区的半干旱、干旱地区无节制的灌溉,导致土壤的次生盐渍化问题不断加重,极大影响牧草的正常生长。
根瘤菌(Rhizobium)是化能异养微生物,是一类在土壤中有广泛分布的可与豆科植物共生固氮的革兰氏阴性细菌[7]。紫花苜蓿与根瘤菌的共生固氮提高苜蓿产量,改善品质[8]。根瘤菌与豆科植物的有效共生受到共生体双方本质及环境的影响和控制[9]。国内外在耐盐性苜蓿的选育方面已有了较深入的研究,刘春华等通过苗期盆栽胁迫试验,研究了69个苜蓿品种的耐盐性。用0.3%和0.4%的盐处理,存活率分为三级,即21个耐盐品种,40个中等耐盐品种和8个敏感品种[9]。关于根瘤菌提高紫花苜蓿耐盐性的研究已有报道[10-13]。但关于苜蓿中华根瘤菌(RM)能否提高干旱半干旱地区紫花苜蓿品种耐盐性却鲜有报道。本试验从生长和生理方面研究3个紫花苜蓿品种接种RM是否具有抵御盐害的作用,对其进行耐盐性综合评价,以期为干旱、半干旱地区盐碱土种植的紫花苜蓿增产提供科学依据。
1 材料与方法
1.1 试验材料与栽培环境
供试种子:供试3个紫花苜蓿(Medicagosativa)品种种子,包括中苜1号、阿尔冈金、金皇后,均来自于内蒙古农业大学沙漠治理学院。所用菌株为耐盐快生型苜蓿中华根瘤菌,编号为ACCC17537,由中国农业科学院中国农业微生物菌种保藏中心提供。菌株的菌落形态特征、生理生化反应及抗逆性见周冀琼的研究[12]。
供试土壤:供试土壤取土地位于内蒙古包头市达茂旗水利部牧区水利研究所,试验地气候类型以温带半干旱大陆性季风气候为主,土壤类型以栗钙土、棕钙土为主,呈地带性分布。当地土壤养分差,磷与氮含量低。试验土壤理化性质为pH值7.8,有机质73.75 g/kg,碱解氮16.20 mg/kg,有效磷7.99 mg/kg,有效钾338.71 mg/kg。
改良YMA液体培养基:甘露醇10 g、酵母0.5 g、K2HPO40.5 g、MgSO4·7H2O 0.2 g、NaCl 0.1 g、刚果红2.5 mL、蒸馏水1 000 mL。
试验温室:本试验于2017年8—10月在内蒙古农业大学的温室中进行,温室全天平均温度为28 ℃,并每天在中午11:30—14:30进行通风降温处理。
试验花盆:采用盆栽试验的圆柱型无孔花盆规格为直径16 cm,高35 cm。每个花盆装土8 kg。
1.2 试验方法
试验采用随机区组设计,如表1所示,每6个花盆分为一个区组,共分为9个区组。并设置2个大重复,共108个花盆。
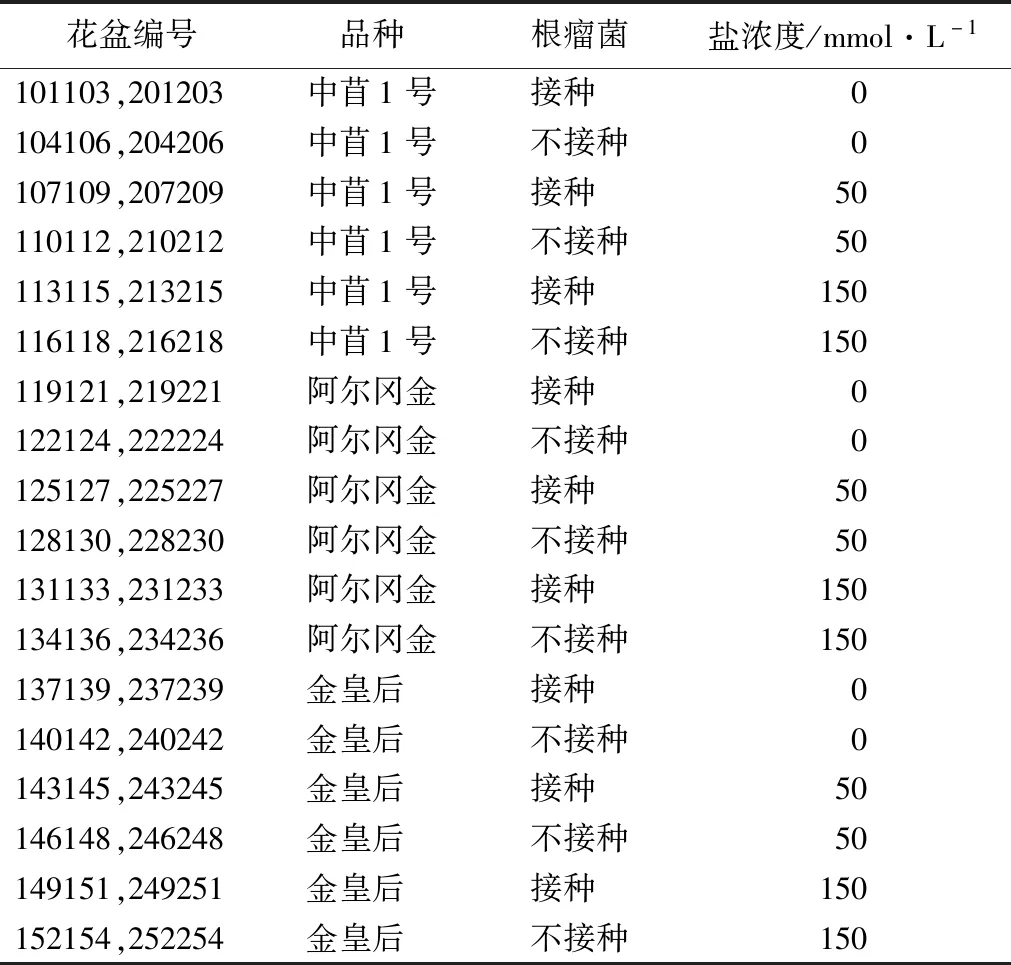
表1 试验处理
种子处理:选择成熟、饱满且大小适中、均匀一致、无病虫害健康的3个紫花苜蓿品种的种子为试验材料。先用0.1% K2MnO4表面消毒3 min,再用蒸馏水反复冲洗6次,用滤纸吸干后,每个花盆均匀播种10粒种子,第1次浇灌时注入淡水量为最大持水量(环刀法)[14],浇完水后进行称质量。每隔2 d补水(补到最大持水量时花盆的质量)[15]。第8 d间苗,挑选长势较好的5株继续培养,拔除剩余幼苗。
根瘤菌接种:在活化并且复壮后的苜蓿中华根瘤菌(RM)中,挑起单菌落,接种在装有YMA液体培养基的三角瓶中,恒温震荡,28 ℃,150 r/min,连续培养,每隔2 h取1次样,24 h连续取样,每次取样均测定OD600nm值[16-17],绘制生长曲线[13]。然后将菌液稀释成不同浓度后接种于平板上,置于28 ℃的暗室培养箱培养3 d,随后计数,确定RM的数量。
将单菌落接种在装有YMA液体培养基的三角瓶中,恒温震荡,28 ℃,150 r/min,培养20 h,用混匀仪混匀菌体,测定OD600nm值[16-17],对比生长曲线,保证接种时液体中的含菌量大约为每毫升108个细胞。用注射器在每株紫花苜蓿幼苗根部土壤周围注射1 mL菌液。
试验设3个盐浓度处理:0(清水),50 mmol/L NaCl,150 mmol/L NaCl。紫花苜蓿幼苗长出第3片叶时,对其盐胁迫处理,为使其逐步适应盐胁迫环境,每次增加50 mmol/L,分3 d提高至150 mmol/L[18]。
地上鲜质量:盐胁迫60 d后,将收获的新鲜植株在靠近茎基部剪去根系,称量植物地上部分鲜质量。
地下鲜质量:盐胁迫60 d后,将收获的新鲜植株在靠近茎基部剪下根系,洗净并用吸水纸吸干植物地下部分,称质量。
根瘤数:盐胁迫60 d后,每个处理随机选取3株植物,用水仔细冲洗后计算单株总根瘤数和有效根瘤数。
叶片丙二醛(MDA)质量摩尔浓度:盐胁迫60 d后,将收获的新鲜植株在靠近茎基部剪去根系,采用硫代巴比妥酸反应法测定[19]。
叶片可溶性糖(SS)质量分数:盐胁迫60 d后,将收获的新鲜植株在靠近茎基部剪去根系,采用蒽酮法测定[13]。
1.3 数据分析
用Sigmaplot13.0作图,用SPSS23.0统计软件进行数据统计分析。运用Oneway ANOVA进行单因素方差分析,并用Duncan’s检验法进行多重比较。利用模糊数学中的隶属函数法对接种和未接种3个紫花苜蓿品种耐盐性进行综合评价[20]。
隶属函数分析方法:
(1)
(2)
式中:Yij为i品种的j指标的隶属函数值;Xij为i品种的j指标均值;Xjmax为各品种j指标均值的最大值;Xjmin为各品种j指标均值的最小值。若j指标与耐盐性呈正相关,用公式(1);若j指标与耐盐性呈负相关,用公式(2)[20]。
2 结果与分析
2.1 不同程度盐胁迫下接种RM对紫花苜蓿地上鲜质量的影响
由表2可知,当没有盐害发生时,金皇后的地上部分鲜质量高于其他2个品种,但差异不显著。当接种RM后,3个紫花苜蓿品种的地上部分鲜质量均增加,且地上部分增产效果显著。其中,接种RM后金皇后地上部分鲜质量显著高于阿尔冈金和中苜1号,说明RM对金皇后地上部分增长效果显著。不同程度盐害对3个紫花苜蓿品种的地上鲜质量均有抑制作用,且抑制程度随着盐浓度的增加而增加。盐浓度由0到150 mmol/L过程中,与各自对照相比,3个紫花苜蓿品种的地上鲜质量分别下降了16.58 g(中苜1号)、22.56 g(金皇后)、19.74 g(阿尔冈金),而且在盐浓度达到150 mmol/L时,3个紫花苜蓿品种地上鲜质量均下降4 g以下,说明盐害对紫花苜蓿地上鲜质量有极大的影响。但接种RM可有效减小轻度盐害对3个品种的减产作用,盐浓度为50 mmol/L时,接种RM 3个紫花苜蓿品种的地上鲜质量相比于各自不接种的地上鲜质量,均有显著性提高。盐浓度150 mmol/L时,虽然3个紫花苜蓿品种接种RM后地上鲜质量依然高于不接种,但不再是显著性提高,说明在3个紫花苜蓿品种遭遇低盐害时,接种RM可有效缓解盐害对于植物地上部分鲜质量的影响,随着盐害程度加强,这种缓解盐害的作用也在逐渐减弱。

表2 NaCl胁迫下RM对紫花苜蓿地上部分鲜质量的影响
注:表中数据为平均值±标准差;同列不同字母表示处理间差异显著(p<0.05)。
2.2 不同程度盐胁迫下接种RM对3个紫花苜蓿品种根鲜质量的影响
由表3可知,当不发生盐害时,未接种RM的金皇后根鲜质量高于阿尔冈金和中苜1号,但差异不显著。而接种RM后3个品种根鲜质量均显著高于未接种,且金皇后根鲜质量显著高于阿尔冈金和中苜1号。不同程度盐害对3个品种的紫花苜蓿根鲜质量均有抑制作用,且随盐浓度升高明显增加,盐浓度由0至150 mmol/L,3个品种分别减少3.31 g(中苜1号)、3.62 g(金皇后)和3.33 g(阿尔冈金),说明盐害对紫花苜蓿根鲜质量产生不利影响。当盐浓度为50 mmol/L时,3个品种的紫花苜蓿接种RM后根鲜质量仍分别显著高于未接种1.03 g(中苜1号)、1.51 g(金皇后)和2.14 g(阿尔冈金)。但当盐浓度为150 mmol/L时,是否接种RM对3个品种的紫花苜蓿根鲜质量没有影响,说明随盐浓度的升高,RM对3个紫花苜蓿品种根鲜质量的作用逐渐减弱。
2.3 不同程度盐胁迫下接种RM对3个紫花苜蓿品种根瘤数的影响
由表4可知,土壤中不含RM且不接种RM的紫花苜蓿不产生根瘤。当不发生盐害时,金皇后产生的根瘤数最多,且金皇后和中苜1号产生的根瘤数显著高于阿尔冈金。随盐浓度升高,接种RM后的3个品种的紫花苜蓿根瘤数明显减少。随着盐浓度由0 mmol/L增加至150 mmol/L,中苜1号、金皇后和阿尔冈金根瘤数分别减少12.33个、17个和7.34个,说明盐害对接种RM的紫花苜蓿根瘤的形成产生很大的抑制作用。当盐浓度为50 mmol/L时,中苜1号和金皇后产生的根瘤数仍显著高于阿尔冈金。当盐害水平增加至150 mmol/L时,中苜1号和阿尔冈金的根瘤数却显著高于金皇后,说明随着盐害水平的升高,对RM作用于3个紫花苜蓿品种的效果均有减弱,其中,RM作用对于金皇后的抑制效果最为明显。
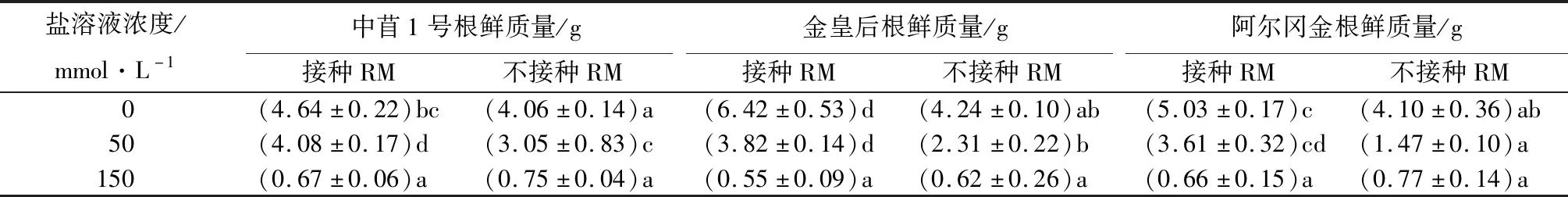
表3 NaCl胁迫下RM对紫花苜蓿根鲜质量的影响
注:表中数据为平均值±标准差;同列不同字母表示处理间差异显著(p<0.05)。

表4 NaCl胁迫下RM对紫花苜蓿根瘤数的影响
注:表中数据为平均值±标准差;同列不同字母表示处理间差异显著(p<0.05)。
2.4 不同程度盐胁迫下接种RM对3个紫花苜蓿品种有效根瘤数的影响
由表5可知,土壤中不含RM且不接种RM的紫花苜蓿有效根瘤数为0。在盐害不发生时,金皇后(16个)和中苜1号的有效根瘤数显著高于阿尔冈金。当盐害达到50 mmol/L时,金皇后的有效根瘤数显著高于中苜1号和阿尔冈金,说明RM对金皇后这一紫花苜蓿品种产生有效根瘤数的作用效果最好。不同程度盐胁迫对紫花苜蓿有效根瘤数产生抑制作用。随着盐浓度上升,3个品种紫花苜蓿的有效根瘤数均有下降,尤其是在150 mmol/L盐浓度时,有效根瘤数都下降至0,说明盐害程度越高,RM对紫花苜蓿浸染所产生的有效根瘤数越少,盐害对RM的作用效果产生极大抑制。

表5 NaCl胁迫下RM对紫花苜蓿有效根瘤数的影响
注:表中数据为平均值±标准差;同列不同字母表示处理间差异显著(p<0.05)。
2.5 不同程度盐胁迫下接种RM对3个紫花苜蓿品种丙二醛(MDA)质量摩尔浓度的影响
由表6可知,在盐害不发生时,接种RM后中苜一号和阿尔冈金MDA质量摩尔浓度分别显著减少0.17和0.28 mmol/g,金皇后MDA质量摩尔浓度减少0.11 mmol/g,说明在非盐胁迫下,接种RM对3个紫花苜蓿品种的膜脂过氧化程度产生抑制。在盐浓度为50 mmol/L时,接种RM的金皇后MDA质量摩尔浓度显著减少0.57 mmol/g,中苜1号和阿尔冈金MDA质量摩尔浓度分别减少0.15和0.21 mmol/g,说明在轻度盐害时,接种RM缓解紫花苜蓿的膜脂过氧化程度。当盐浓度升高至150 mmol/L时,接种RM对3个紫花苜蓿品种的MDA质量摩尔浓度影响不大,RM对紫花苜蓿的作用极小。随着盐浓度升高,紫花苜蓿MDA质量摩尔浓度明显增加,中苜一号、金皇后和阿尔冈金的MDA质量摩尔浓度分别增加了1.68、2.03和1.04m mmol/g,说明随着盐害程度加重,RM对3个品种的紫花苜蓿膜脂过氧化程度的缓解作用逐渐减弱。
2.6 不同程度盐胁迫下接种RM对3个紫花苜蓿品种叶片可溶性糖质量分数的影响
由表7可知,无论盐害是否发生,接种RM总体上对3个紫花苜蓿品种叶片可溶性糖质量分数稍有提升,但差异不显著,说明接种是否RM对紫花苜蓿叶片可溶性糖的产生影响不显著。当盐害未发生时,接种RM紫花苜蓿叶片可溶性糖质量分数分别为8.97 mg/g(中苜一号)、12.17 mg/g(金皇后)和7.41 mg/g(阿尔冈金)。但当盐浓度上升至50 mmol/L时,3个紫花苜蓿品种叶片可溶性糖质量分数分别为14.62 mg/g(中苜一号)、21.65 mg/g(金皇后)和15.58 mg/g(阿尔冈金),明显增加了5.65、16.16和8.17 mg/g,说明轻度盐胁迫促进紫花苜蓿叶片可溶性糖的产生。而当盐害程度由50 mmol/L上升到150 mmol/L时,3个紫花苜蓿品种叶片可溶性糖质量分数分别下降至12.21 mg/g(中苜一号)、16.36 mg/g(金皇后)和11.76 mg/g(阿尔冈金),说明当重度盐害发生时,紫花苜蓿叶片可溶性糖质量分数开始下降,随着盐害程度的增加逐渐抑制可溶性糖的产生。

表6 NaCl胁迫下RM对紫花苜蓿MDA质量摩尔浓度的影响
注:表中数据为平均值±标准差;同列不同字母表示处理间差异显著(p<0.05)。

表7 NaCl胁迫下RM对紫花苜蓿可溶性糖质量分数的影响
注:表中数据为平均值±标准差;同列不同字母表示处理间差异显著(p<0.05)。
2.7 3个紫花苜蓿品种耐盐性综合评价
由表8可知,因为当盐浓度为150 mmol/L时,对3个紫花苜蓿品种重度胁迫,是否接种RM对其耐盐性影响不明显,只计算盐浓度为50 mmol/L时紫花苜蓿隶属函数值(表8)。计算紫花苜蓿地上部分鲜质量、根鲜质量、根瘤数、有效根瘤数、丙二醛质量摩尔浓度和可溶性糖质量分数6个指标相对值的耐盐隶属函数值,进行耐盐性综合评价。通过隶属函数法分别计算3个紫花苜蓿品种未接种和接种RM的隶属度平均值分别为0.3,0.29,0,0.64,0.98,0.5,排序耐盐性强弱依次为金皇后(接种RM)、中苜1号(接种RM)、阿尔冈金(接种RM)、中苜1号(未接种RM)、金皇后(未接种RM)、阿尔冈金(未接种RM)。
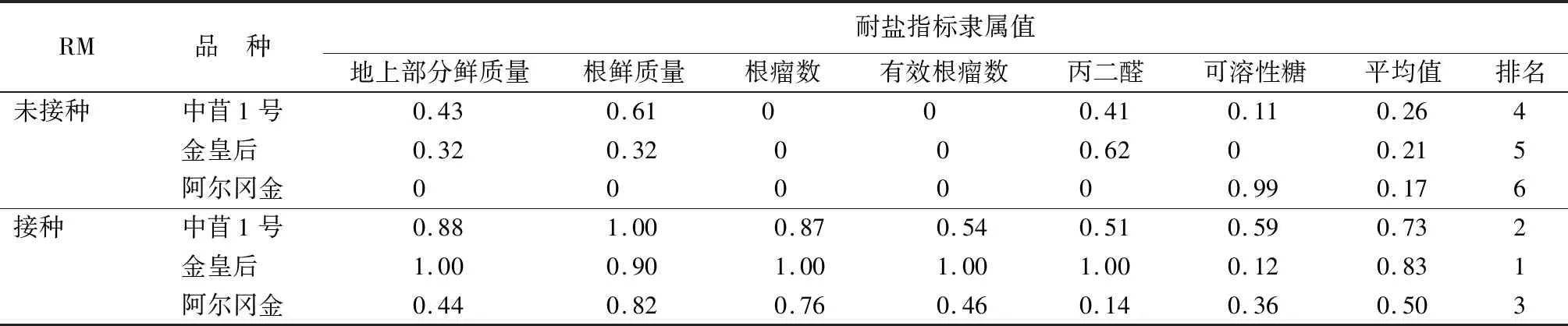
表8 3个紫花苜蓿品种接种和未接种耐盐指标隶属函数值及耐盐性综合评价
3 讨论
3.1 接种根瘤菌对地上部分鲜质量与根鲜质量的影响
在已知牧草耐盐性评价中,紫花苜蓿属于中等水平[21]。盐胁迫对植物生长的影响与盐分浓度和植物本身的耐盐程度有关[22]。植物在盐胁迫下,最先受到胁迫伤害的是根系,继而再发生一系列的生理生化反应,影响地上部分的生长发育,其中相对生长量是植物对盐胁迫的综合表现[23]。根的生长状况是衡量盐害对植物生长影响的重要指标。王建科研究表明,不同盐分对幼根的生长都有抑制作用[22]。牛远研究结果表明,大豆鲜生物量、根鲜质量在遭受盐害时变化显著[24]。谢委对紫花苜蓿的研究表明,NaCl处理浓度越高,其根长和苗长越受抑制[25]。本研究中,不同盐害程度对3个紫花苜蓿品种的生长均有抑制作用。随着NaCl浓度的提高,3个紫花苜蓿品种地上部分和根鲜质量明显减少。在轻度盐胁迫下,金皇后地上部分和根鲜质量明显优于中苜一号和阿尔冈金,说明金皇后自身耐盐性优于其他2个紫花苜蓿品种。而重度盐害环境下3个紫花苜蓿品种的地上鲜质量和根鲜质量微小且彼此间差异不明显,说明重度盐害时,3个紫花苜蓿品种自身调节作用不足以调节外部的恶劣环境。
3.2 接种根瘤菌对根瘤数与有效根瘤数的影响
前人研究表明,接种丛枝菌根真菌(AM)、苜蓿中华根瘤菌(RM)等可以提高盐害环境下的紫花苜蓿产量[26-30]。根瘤菌生活在植物组织内部,通过长期的自然选择与宿主植物共生,在抵御外界环境胁迫方面比其他根际微生物具有更强的生存优势[31]。张攀等发现根瘤菌侵染过程能促使植物产生应激防御,并形成免疫机制,以提升紫花苜蓿在遭受盐胁迫时的耐受能力,从而提高其耐盐性[32]。Ensiye Ashrafi等发现无论是否在盐害环境中,混合接种AM和RM均能通过提高定植、结瘤数和养分吸收来提高紫花苜蓿产量[33]。宋婷婷对根瘤菌共生紫花苜蓿研究表明,接种根瘤菌可减缓盐胁迫对作物根的伤害[34]。石茂玲对紫花苜蓿接种根瘤菌的研究表明,与根瘤菌共生可大幅提高紫花苜蓿单株总根瘤数和单株有效根瘤数[35]。根瘤是在植物根系上生长的特殊的瘤,因寄生组织中建成共生的固氮细菌而形成,合成自身的含氮化合物。根瘤包括有效根瘤和无效根瘤,而其中真正发挥作用的是有效根瘤。本试验中,土壤不存在RM且不进行人工接种RM的情况下,紫花苜蓿不产生根瘤。3个紫花苜蓿品种在接种RM后产生根瘤,且随着盐害程度的提升,根瘤和有效根瘤的产生受到抑制。
3.3 接种根瘤菌对丙二醛含量与可溶性糖质量分数的影响
植物通过生理代谢增强对盐胁迫的适应能力,即合成渗透调节物质,通过生物膜保护系统清除活性氧,盐分区隔化[36]。本试验选用两个典型逆境生理指标反映3个紫花苜蓿品种受到盐胁迫时的响应。MDA作为脂质过氧化作用的产物,其含量的高低可以代表膜损伤程度的大小[37]。而可溶性糖能够维持细胞膜结构的完整性,在植物生命周期中起关键作用[38]。植物在遭遇盐害时,就会积累大量的渗透保护剂,例如可溶性糖[39]。李莎莎对其他非生物胁迫影响根瘤菌共生紫花苜蓿的研究表明,低温胁迫下,接种RM后MDA质量摩尔浓度低于不接种的紫花苜蓿,且叶片可溶性糖质量分数高于不接种的紫花苜蓿[40]。张攀对干旱胁迫影响根瘤菌共生紫花苜蓿研究表明,接种RM的紫花苜蓿叶片可溶性糖质量分数明显高于不接种[41]。本试验中,3个紫花苜蓿品种叶片MDA质量摩尔浓度随盐浓度升高而增加,说明膜脂过氧化程度加剧。在轻微盐胁迫下接种RM,MDA质量摩尔浓度相对于未接种下降,但在重度盐害条件下,接种RM对MDA质量摩尔浓度变化影响微弱,说明轻微盐胁迫下接种RM提高紫花苜蓿对活性氧的防御能力,但重度盐胁迫对RM的作用产生很大抑制。在本试验中随盐胁迫加重,可溶性糖质量分数先升高后降低,说明渗透调节系统功能性先增强后减弱。在相同盐害水平下,接种RM对紫花苜蓿叶片可溶性糖质量分数稍有提升,说明轻度盐胁迫下,接种RM可提高紫花苜蓿的渗透调节能力,但重度盐害会抑制RM的作用。
3.4 3个紫花苜蓿品种接种或未接种RM耐盐性综合评价
紫花苜蓿耐盐性表现是一个复杂的过程,其耐盐能力强弱是多种代谢的综合体现[42]。用单项指标对材料间耐盐性评价尚有局限,因此采用综合评价法[43]。植物耐盐性评价包括直接测定和间接测定。直接测定包括植株生物量、生长速率等,间接测定包括水分吸收、MDA质量摩尔浓度和抗氧化物质等[44]。熊雪等用NaCl模拟盐胁迫,采用隶属函数法对生长速率、地上生物量、地下生物量、丙二醛含量等指标相对值对不同紫花苜蓿品种进行耐盐性综合评价[20]。李源等用MDA质量摩尔浓度、可溶性糖质量分数和细胞质膜透性等指标对18个紫花苜蓿品种进行耐盐评价[43]。本研究利用模糊数学中的隶属函数法,选择地上部分鲜质量、根鲜质量、根瘤数、有效根瘤数、MDA质量摩尔浓度与可溶性糖质量分数这6个指标的相对值对3个紫花苜蓿品种接种或未接种RM进行耐盐性综合评价,得到耐盐性强弱依次为金皇后(接种RM)、中苜1号(接种RM)、阿尔冈金(接种RM)、中苜1号(未接种RM)、金皇后(未接种RM)、阿尔冈金(未接种RM)。总体来看,在盐害环境下,接种RM最宜种植紫花苜蓿品种为金皇后,其次为中苜一号。本研究为今后内蒙古盐渍土地区选育紫花苜蓿品种提供参考。
4 结论
紫花苜蓿产量随盐害程度的升高而降低,当轻度盐害发生时,接种苜蓿中华根瘤菌可提高紫花苜蓿的耐盐性。当重度盐害发生时,接种苜蓿中华根瘤菌对紫花苜蓿的耐盐性几乎无影响。当未发生盐害或轻度盐害发生时,金皇后品种耐盐性最强,当重度盐害发生时,3个紫花苜蓿品种耐盐性均弱。

