先天性腹膜后囊性神经母细胞瘤一例
刘俊娇 张津浦 高文慧 白玥 迟迪 钱忞
【摘要】神经母细胞瘤是常见的小儿颅外实质性恶性肿瘤,但腹膜后囊性的神经母细胞瘤罕见。该文报道1例腹膜后囊性神经母细胞瘤患儿,其为男性,于40+5周时出现胎心率下降、产程未发动而通过剖宫产术娩出。产前5 d患儿母亲于孕检时发现胎儿存在腹腔囊肿,患儿出生后行荧光原位杂交技术基因扩增检测示N-myc基因扩增。生后第2日患儿即在全身麻醉下接受肿物切除术,经病理检查确诊为腹膜后囊性神经母细胞瘤,术后常规予抗感染及对症、支持等治疗,患儿恢复良好,出院后末次随访暂未见肿瘤复发或转移。N-myc基因扩增与预后不良相关,故对于N-myc基因扩增的神經母细胞瘤患儿宜尽早实施手术治疗以提高其生存率。
【关键词】腹膜后囊性神经母细胞瘤;先天性心脏病;腹裂;先天性巨结肠; N-myc基因
【Abstract】Neuroblastoma is the most common extracranial solid tumor in children, whereas the retroperitoneal cystic neuroblastoma is rarely encountered. In this article, one child of retroperitoneal cystic neuroblastoma was reported. The male infant presented with a decline in the fetal heart rate at a gestational age of 40+5 weeks. He was delivered by cesarean section due to no signs of imminent delivery. At 5 d before delivery, abdominal cysts were found in the fetus during pregnancy examination. Fluorescence in situ hybridization (FISH) was applied to neuroblastoma for detection of N-myc oncogene amplification after birth. At 2 d after birth, the infant underwent tumor resection under general anesthesia. He was diagnosed with retroperitoneal cystic neuroblastoma by pathological examination. Anti-infection, symptomatic and supportive therapies were delivered after surgery. The child was properly recovered and discharged. No tumor recurrence or metastasis was noted during the final follow-up. The amplification of N-myc was significantly correlated with poor clinical prognosis. For children with retroperitoneal cystic neuroblastoma with N-myc amplification, surgical treatment should be performed as early as possible to enhance the survival rate.
【Key words】Retroperitoneal cystic neuroblastoma;Congenital heart disease;Gastroschisis; Congenital megacolon;N-myc
神经母细胞瘤是常见的小儿颅外实质性恶性肿瘤,其发病率仅次于白血病和脑恶性肿瘤,但腹膜后囊性神经母细胞瘤较少见[1]。该病多在幼儿期被发现,可通过病理检查及骨髓涂片活组织检查(活检)确诊。该文报道1例在胎儿期发现腹腔囊肿并于出生后接受手术切除行病理检查确诊为神经母细胞瘤的患儿。
病例资料
一、主诉及体格检查
患儿男,于40+5周时出现胎心率下降、产程未发动,其母亲于2019年9月10日在我院产科接受急诊剖宫产术将其娩出,出生时体质量3300 g。
产前5 d患儿母亲于孕检时发现胎儿存在腹腔囊肿,故患儿出生后即被转至新生儿科作进一步检查和治疗。患儿母亲既往身体健康,本次孕检除发现胎儿腹腔囊肿外无其他异常。否认相关疾病家族史。患儿体格检查:生命体征、胸、肺、腹及神经肌肉等均无异常。
二、实验室及辅助检查
血常规:血红蛋白150.0 g/L,红细胞4.01 ×1012/L,白细胞17.9×109/L,血小板196.0×109/L。甲状腺功能:FT3 4.3 pmol/L,FT4 15.1 pmol/L,高灵敏TSH 10.0 mIU/L。神经元特异性烯醇化酶(NSE)15.2 ng/ml,铁蛋白367.4 ng/ml。尿香草扁桃酸(VMA) < 2.0 mg/24 h。腹腔彩色多普勒超声检查(彩超):肝肾间隙探及一无回声光团,壁较薄,透声差,充满密集回声,大小约5.0 cm×3.4 cm×4.0 cm,边界尚清,形态尚规则,内有多发大小不等分隔,彩色多普勒血流显像(CDFI):未见明显血流信号。右肾略受压,与后腹膜关系密切。诊断提示:腹腔囊性肿物,首先考虑腹膜后来源。肾脏MRI平扫+弥散成像:右后腹肝脏后方、肾脏前方可见囊状长T1、长T2信号,其内可见分隔影,大小约40 mm×42 mm×44 mm。右侧肾脏呈受压改变;左肾大小、形态、信号未见明显异常。诊断提示:右侧腹膜后异常信号,不排除肾上腺囊性占位性病变。
三、治疗及随访
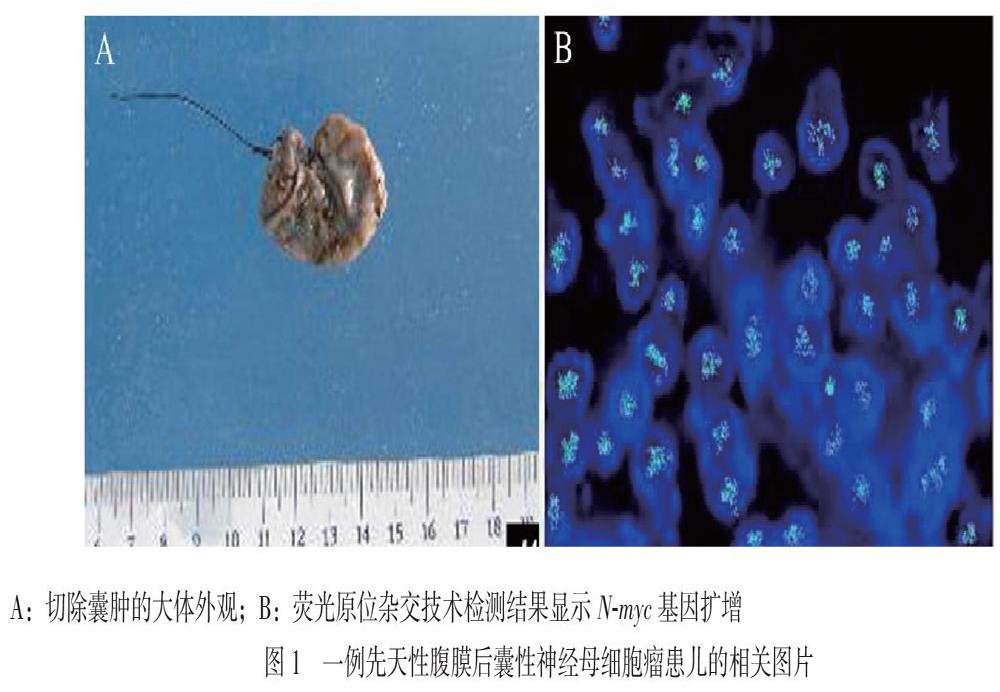
患儿于2019年9月11日在全身麻醉下接受肿物切除术。术中见腹膜后有一大小约5.0 cm×4.0 cm×3.0 cm的类圆形肿物(图1A),呈囊性,切除囊肿后行病理检查,结果显示:腹膜后病变呈囊肿性改变,囊壁内可见神经母细胞瘤成分,囊内有出血,有少量肿瘤细胞,囊壁外可见肾上腺皮质,病变符合先天性囊肿性神经母细胞瘤表现,肿瘤为低分化亚型,有丝分裂核碎裂指数(MKI)为低级别,囊壁外未见肿瘤浸润。荧光原位杂交技术基因扩增检测示N-myc基因扩增(图1B)。术后常规予抗感染及对症、支持等治疗,患儿恢复良好,于术后15 d出院。随访至2019年12月1日暂未见肿瘤复发或转移。
讨论
神经母细胞瘤属于交感神经系统肿瘤,其病因为在胚胎早期,原始神经嵴产生交感神经元细胞,后者移行至其他部位而形成神经母细胞和肾上腺髓质的嗜铬母细胞,从而形成正常组织或肿瘤。只要具有交感神经元细胞的部位均有可能产生神经母细胞瘤,如颅内、颈后侧部、眼眶,但大多发生在肾上腺,先天性神经母细胞瘤少见,发生在腹膜后更为罕见。另外,神经母细胞瘤很少出现囊性变,因为其通常含有固体成分,故腹膜后的囊性神经母细胞瘤极为罕见[1]。
神经母细胞瘤的临床表现有熊猫眼、霍纳综合征、腹部肿块、肝肿大、皮下结节等,本例患儿即表现为腹腔囊肿。神经母细胞瘤与先天性心脏病的临床表现是否有相关性尚不清楚,Testori等[2]在基因水平上发现两者的神经嵴细胞起源存在共同遗传基础。Rosa等[3]报道1例神经母细胞瘤患者,他们怀疑在播散性的恶性肿瘤如转移性神经母细胞瘤中出现的凝血缺陷可能与腹裂的病因有关,因为该缺陷可能是在怀孕3 ~ 4周时受形成的血栓形成影响所致,但他们尚无法确定2个事件是否有同时发生的可能性,仍需行大样本量的研究证实。在生物学方面,本例患者NSE和VMA均无明显升高。神经母细胞瘤患者大多出现NSE升高,这对于诊断此病有一定的价值,有研究者分析了50例成人神经母细胞瘤中的NSE,结果提示NSE水平可作为监测肿瘤的治疗效果和复发的指标[4]。但本例患儿NSE正常,结合文献提示仅靠NSE诊断神经母细胞瘤存在一定的阴性可能,这是否与患者年龄有关尚未明确。检测神经母细胞瘤患者体内的儿茶酚胺有一定的指导意义,但不必在囊性神经母细胞瘤患者中检测儿茶酚胺水平,因为囊性神经母细胞瘤缺乏固体成分,故较少出现血清和尿中儿茶酚胺水平升高,这与本例的检测结果一致[1]。另外,新的遗传学研究显示PHOX2B基因多态性在先天性巨结肠和神经母细胞瘤中具有较强的生物学适用性,是与神经发育障碍相关疾病的治疗靶点[5]。超声检查有助于诊断先天性神经母细胞瘤,MRI有助于确定肿块来源于腹膜后,两者结合可更有效诊断先天性腹膜后神经母细胞瘤[6]。
神經母细胞瘤是异质性非常强的肿瘤,大部分发病隐匿,诊断时已发生全身转移并迅速进展而致命,但临床上亦存在无干预肿瘤可自然消退的现象。该病的预后主要与年龄、肿瘤分期、病理类型有关,囊性神经母细胞瘤的远期预后尚可,因为其属于罕见的变异型,通常发生于较小年龄的患者,且很少发生转移[1]。N-myc基因扩增和肿瘤的分化差、快速进展、预后不佳密切相关,是预测肿瘤进展的强有力的生物学指标[7]。对于N-myc阴性的神经母细胞瘤患儿,其有可能自然消退,但必须密切随访观察,必要时及早予综合干预,包括行手术及化学治疗[8]。本例患儿N-myc基因扩增,立即予以手术切除肿瘤是非常正确的,这对于预防严重的后遗症非常有利。一项大型研究显示,胎儿生长异常和先天性畸形可能与神经母细胞瘤的风险增加有关,另外补充叶酸和母乳喂养在预防神经母细胞瘤方面具有潜在的重要性,这需要作进一步研究以确定其作用[9]。
本例较罕见,其腹腔囊肿在胎儿期即被发现,位于腹膜后,出生后立即予以手术切除,通过病理检查明确神经母细胞瘤的诊断,其NSE及VMA均为阴性,但荧光原位杂交技术检测示N-myc基因扩增,提示预后不佳,故立即予以手术切除肿瘤。术后继续密切随访患儿,以便在出现肿瘤复发或转移时能尽早予以干预。
参 考 文 献
[1] Kasaee A, Rafizadeh SM, Ghadimi H, Shahraki K, Asadi Amoli F, Jamshidian-Tehrani M. A rare case of congenital orbital cystic neuroblastoma in an infant. Ocul Oncol Patho, 2019, 5(3):167-170.
[2] Testori A, Lasorsa VA, Cimmino F, Cantalupo S, Cardinale A, Avitabile M, Limongelli G, Russo MG, Diskin S, Maris J, Devoto M, Keavney B, Cordell HJ, Iolascon A, Capasso M. Exploring shared susceptibility between two neural crest cells originating conditions: neuroblastoma and congenital heart disease. Genes (Basel),2019,10(9). pii: E663.
[3] Rosa RF, Michelon L, Masiero ?, Faria AE, De Souza VF, Dietrich C, Targa LV, Provenzi VO, Pires SR, Zen PR. Gastro-schisis in a fetus with a congenital neuroblastoma: Association or coincidence? Birth Defects Res A Clin Mol Teratol,2016,106(3):208-212.
[4] 郑磊,孙晓非,甄子俊,夏奕,凌家瑜,罗文标,林慧.神经母细胞瘤患者血清神经元特异性烯醇化酶水平变化的临床意义——附50例报告.新医学,2008,39(10):644-646.
[5] Zhao J, Zhu Y, Xie X, Yao Y, Zhang J, Zhang R, Huang L, Cheng J, Xia H, He J, Zhang Y. Pleiotropic effect of common PHOX2B variants in Hirschsprung disease and neuroblastoma. Aging (Albany NY),2019,11(4):1252-1261.
[6] Snyder E, Jelin AC, Huisman TAGM, Hooper JE, Tekes A. Fatal congenital retroperitoneal neuroblastoma diagnosed by fetal magnetic resonanceImaging. J Comput Assist Tomogr,2017,41(4):651-652.
[7] Brodeur GM, Seeger RC, Schwab M, Varmus HE, Bishop JM. Amplification of N-myc in untreated human neuroblastomas corr-elates with advanced diseasestage. Science,1984,224(4653):1121-1124.
[8] Darouich S, Boujelbène N,Kitova T,Jabnoun S. Congenital neuroblastoma: report of an autopsy case. J Anat Soc India,2015,64(2):174-177.
[9] Rios P, Bailey HD, Orsi L, Lacour B, Valteau-Couanet D, Levy D, Corradini N, Leverger G, Defachelles AS, Gambart M, Sirvent N, Thebaud E, Ducassou S, Clavel J. Risk of neuroblastoma, birth-related characteristics, congenital malf-ormations and perinatalexposures: a pooled analysis of the ESCALE and ESTELLE French studies (SFCE). Int J Cancer,2016,139(9):1936-1948.
(收稿日期:2019-12-02)
(本文編辑:洪悦民)

