牛粪中溶解性有机质对周丛生物吸附Cu(Ⅱ)特性的影响
孙晨敏,邵继海,匡晓琳
(湖南农业大学资源环境学院,长沙 410128)
畜禽养殖的饲料中普遍含有重金属添加剂,其中Cu是最主要的重金属添加剂之一[1]。而畜禽饲料中Cu的利用率较低,绝大部分会随畜禽粪便外排,有文献表明养殖废水中Cu(Ⅱ)含量可以达到9.81 mg·L-1,远超过《污水综合排放标准》(GB 8978—1996)中重金属Cu(Ⅱ)的最高允许排放浓度(<2.0 mg·L-1)[2-3]。为了解决这一问题,研究人员已经开发了许多处理技术,例如吸附、化学氧化、离子交换、沉淀和膜分离[4-5],其中吸附法(物理吸附、化学吸附和生物吸附)具有高效[6]、可循环利用[7]、环保等特点,由于大多数吸附剂的制备较为昂贵,只能在规模化污水处理上略见成效。而生物吸附法因具有吸附剂来源广泛、成本低廉、吸附范围广等优势而在重金属类污水处理中广泛使用[8-9]。
周丛生物是淹没于水体固体基质表面的各种微生物及其与周边的非生物物质交织在一起的集合体[10-11],周丛生物的多物种群落特征使其对重金属的耐受性高于单一物种,如藻类[12-13]或细菌[14]。据Bradac等[15]和Yang等[16]的研究结果显示,周丛生物能有效吸附去除多种重金属离子,如Cu、Cd、Pb、Mn等。Yang等[17]研究发现周丛生物对农业固废渗滤液中Cu(Ⅱ)的去除具有高效性和可持续性。周丛生物吸附重金属通常会受pH、胞外聚合物(Extracellular polymeric substances,EPS)中活性基团等的影响[18]。周丛生物产生的胞外聚合物富集羟基、羧基、酰胺基等,还含有一些非碳水化合物成分,如磷酸盐和硫酸盐,这些化学基团可以通过离子交换或络合的方式与重金属离子结合,从而将液体介质中的重金属离子去除[19-21]。
养殖废水中含有的大量溶解性有机质(Dissolved organic matter,DOM)[22],主 要 来源于 畜禽粪 便[23]。DOM主要成分包括碳水化合物、蛋白质、氨基酸、脂类、酚类、醇类、有机酸和固醇类,其中含有大量的氨基、羰基、羟基等基团[24],这些基团同样具有与水体重金属离子结合的特性[25]。据此可以推测用周丛生物吸附法去除畜禽养殖废水中重金属离子时,其去除效率必然会受到畜禽养殖废水中DOM的影响。然而到目前为止,这一科学问题却尚未见相关文献报道。为了阐明牛粪中DOM对周丛生物吸附Cu(Ⅱ)的特性的影响,本文对此进行了研究,并结合解吸特性和红外基团分析结果,分析了DOM影响周丛生物吸附Cu(Ⅱ)特性的机理。
1 材料与方法
1.1 周丛生物的采集与处理
吸附试验所用周丛生物采集于湖南农业大学第八教学楼的人工池塘底部鹅卵石表面。每次所用周丛生物均经过抽滤以去除表面水分,再进行称量计算。
1.2 DOM的制备
牛粪来自湖南省畜牧兽医研究所内奶牛养殖中心。将牛粪风干后过2 mm的尼龙筛,按照干物质和超纯水1∶20(W/V)的比例在25 ℃条件下,200 r·min-1振荡24 h。12 000×g离心20 min,取上清液用0.45 μm的滤膜进行过滤,黑暗4℃保存。因牛粪来源DOM成分较复杂,故以总有机碳(Total organic carbon,TOC)浓度作为DOM的定量指标,测得牛粪来源DOM母液的TOC浓度为2 372.25 mg·L-1。
1.3 吸附试验
1.3.1 不同DOM添加量对周丛生物吸附Cu(Ⅱ)的影响
本研究所有试验的Cu(Ⅱ)溶液均使用Cu(NO3)2·3H2O配制。取适量的周丛生物进行抽滤,抽滤至不再滴水,用电子天平称取0.3 g周丛生物分装至塑料小瓶中,吸附体系的体积为30 mL,Cu(Ⅱ)初始浓度为5 mg·L-1,牛粪DOM的添加量分别为:0%、5%、10%、20%、30%(V/V)。吸附体系每个浓度设置3个平行样。将塑料小瓶放入摇床振荡吸附,温度设置25℃,转速200 r·min-1。待吸附达到平衡后,取8 mL溶液至离心管,于 10 000 r·min-1,离心 10 min。离心后取上清液1 mL至另一离心管并定容至5 mL,摇匀后用原子吸收分光光度仪测定其中Cu(Ⅱ)浓度,根据上清液中残留的Cu(Ⅱ)量计算周丛生物吸附Cu(Ⅱ)的量。
1.3.2 吸附动力学试验
设置两组吸附试验,其中一组为添加牛粪DOM的试验组,另一组为不添加DOM的对照组。根据对养殖废水TOC的测定结果,牛粪DOM的添加量设置为5%(相当于TOC终浓度118 mg·L-1),该浓度接近奶牛养殖废水中TOC含量。吸附条件与1.3.1相同。整个吸附体系采样时间为第 5、10、20、30、60、120、180、240、300、360 min。取样后,样品的离心、Cu(Ⅱ)测定和吸附量的计算均与1.3.1相同。
为了探究吸附动力学,用准一级动力学和准二级动力学(公式1、公式2)对数据进行拟合。

1.3.3 等温吸附试验
在DOM添加量为5%,保持周丛生物量、温度、振荡频率和时间等不变的条件下,研究不同Cu(Ⅱ)起始浓度对周丛生物吸附Cu(Ⅱ)的吸附容量的影响。Cu(Ⅱ)的初始浓度为5、10、20、40、80、160、200 mg·L-1。吸附条件、取样后样品的处理、上清液中Cu(Ⅱ)含量测定和吸附容量的计算均与1.3.1相同。
为了研究周丛生物以及周丛生物+DOM对Cu(Ⅱ)的等温吸附特性,使用Langmuir和Freundlich模型(公式3、公式4)对其进行拟合分析。

式中:qe为到达平衡时重金属的吸附容量,ce为重金属的平衡浓度,qm为最大吸附容量,b为吸附平衡常数;KF为吸附参数,n为吸附强度。
1.3.4 不同pH下DOM对周丛生物吸附Cu(Ⅱ)的影响
吸附体系中Cu(Ⅱ)浓度为5 mg·L-1,DOM添加量为 5%。使用 0.01 mol·L-1HNO3和 0.01 mol·L-1NaOH调节试验组和对照组的pH至4、5、6、7、8。吸附温度、振荡频率和吸附时间及取样后样品的处理与上述1.3.1相同,计算不同pH条件下周丛生物对Cu(Ⅱ)的吸附量。
1.4 解吸附试验
试验组和对照组均在Cu(Ⅱ)浓度为5 mg·L-1、DOM添加量为5%的条件下进行吸附试验,达到吸附平衡后按上述方法取样和离心,取一部分上清液进行浓度测定,剩余部分离心后去掉上清液,保留底物用超纯水冲洗掉残留液体,分别加入超纯水、2 mol·L-1NH4NO3、0.1 mol·L-1EDTA-2Na作解吸试剂,解吸两次后,用原子吸收光度计测定解吸液中Cu(Ⅱ)浓度。
1.5 样品消解
将1.3.1和1.4试验后的周丛生物从体系中取出,放入50 mL消解管中,加入10 mL HNO3,盖上漏斗静置过夜,未做吸附试验的周丛生物也同时进行消解。周丛生物中总Cu(Ⅱ)采用天津莱玻特瑞公司XJS36-42W型管式消解炉消解,升温程序:70℃保持30 min,90℃保持30 min,120℃保持120 min,140℃保持60 min,之后120℃赶酸120 min。消解结束后将样品定容至25 mL,并过滤至塑料小白瓶中保存,用原子吸收光度计测定Cu(Ⅱ)浓度。
1.6 傅里叶红外光谱分析
将周丛生物、周丛生物+DOM以及DOM的样品冷冻干燥,分别与干燥的光谱纯级别的溴化钾混合在玛瑙研钵中研磨,然后压片,再放入红外光谱仪(Perkin Elmer Spectrum 65)中,于波长范围4000~400 cm-1扫描得到红外光谱图,分辨率为4 cm-1。
1.7 高通量测序
按照DNA提取试剂盒(天根)相关步骤提取周丛生物总DNA,使用16SrDNA通用引物515F(GTGCCAGCMGCCGCGG)和 907R(CCGTCAATTCMTTTRAGTTT)扩增16SrRNA基因的V4~V5区(515~907)。PCR反应混合物(20μL体积)包含4μL 5倍FastPfu反应缓冲液、2μL dNTP混合物(2.5 mmol·L-1)、0.4μL每种引物(5μmol·L-1)、0.4μL FastPfu DNA聚合酶、10 ng模板DNA和ddH2O补足体积。
PCR热循环方案设置为:在95℃预变性5 min,然后进入25个循环扩增阶段,每个循环包括变性95 ℃ 30 s,退火 54 ℃ 30 s,延伸 72 ℃ 30 s,最后于72℃保温5 min。PCR扩增在ABIGeneAmp PCR System 9700(Applied Biosystems,CA,USA)上进行。使用2%(m/V)的琼脂糖凝胶对PCR产物进行电泳检测,并使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)进一步纯化。使用QuantiFluor™-ST(Promega,USA)对纯化的扩增子进行定量,并根据标准协议在上海美吉生物医药科技有限公司的Illumina MiSeq平台上进行高通量测序。
1.8 数据统计分析
试验数据用SPSS 13.1进行统计分析,多重比较采用单因素方差分析(One-way ANOVA,LSD),处理组和对照组的两两比较采用独立样本T检验,单因素方差分析和T检验中P值小于0.05均被认为具有显著差异。
2 结果与分析
2.1 不同DOM添加量对周丛生物吸附Cu(Ⅱ)的影响
如图1所示,随着DOM添加量的增高,周丛生物对Cu(Ⅱ)的吸附容量不断降低,当DOM添加量为5%时,周丛生物对Cu(Ⅱ)的吸附容量比对照组减少了29.51%,而当DOM添加量为10%、20%、30%时,周丛生物的吸附容量分别减少了63.54%、74.65%、80.21%。说明DOM对周丛生物吸附Cu(Ⅱ)有抑制作用,且随着DOM添加量的增高,抑制作用增强。
2.2 DOM对吸附动力学的影响

图1 不同DOM添加量对周丛生物吸附Cu(Ⅱ)的影响Figure 1 Effects of different DOM addition levels on the adsorption of Cu(Ⅱ)by periphyton
如图2所示,对照组和试验组的周丛生物吸附Cu(Ⅱ)在120 min之内基本可以达到平衡。用准一级动力学和准二级动力学模型进行拟合后的参数见表1,周丛生物和加入DOM的周丛生物的准一级动力学相关性系数R2分别为0.889、0.869。而准二级动力学模型拟合后,周丛生物和加入DOM的周丛生物的R2分别为0.958、0.927。根据相关性来判断,两组吸附试验结果都更符合二级动力学模型。周丛生物的理论最大吸附容量为0.417 mg·g-1,加入DOM的周丛生物理论最大吸附容量为0.229 mg·g-1,与实际结果相符。
2.3 不同Cu(Ⅱ)起始浓度条件下DOM对周丛生物吸附Cu(Ⅱ)的影响与等温吸附特性
图3为周丛生物在DOM添加量为5%的条件下和未加DOM的条件下对不同起始浓度的Cu(Ⅱ)吸附效果的拟合模型。由图可见,周丛生物与加入DOM后的周丛生物吸附能力随着Cu(Ⅱ)初始浓度的增大而增大,而且整体上加入DOM的周丛生物的吸附容量远小于纯周丛生物的吸附容量。表2为等温吸附拟合后所得出的相关参数。用Langmuir模型和Freundlich模型拟合纯周丛生物对Cu(Ⅱ)的吸附数据显示,拟合相关性均较高,相关性系数R2分别为0.997和0.989。对于加入DOM的周丛生物对Cu(Ⅱ)的吸附,Freundlich模型拟合相关性系数为0.883,Langmuir模型拟合的相关性系数为0.953。纯周丛生物的最大吸附容量为21.270 mg·g-1,加入DOM的周丛生物的最大吸附容量为7.594 mg·g-1。

图2 周丛生物对Cu(Ⅱ)的吸附动力学曲线Figure 2 Adsorption kinetics of Cu(Ⅱ)by periphyton

表1 周丛生物吸附Cu(Ⅱ)的准一级和准二级动力学模型拟合参数Table 1 Parametersof adsorption kinetics of Cu(Ⅱ)by periphyton(with or without DOM addition)fitted by Pseudo-First-order and Pseudo-Second-order models
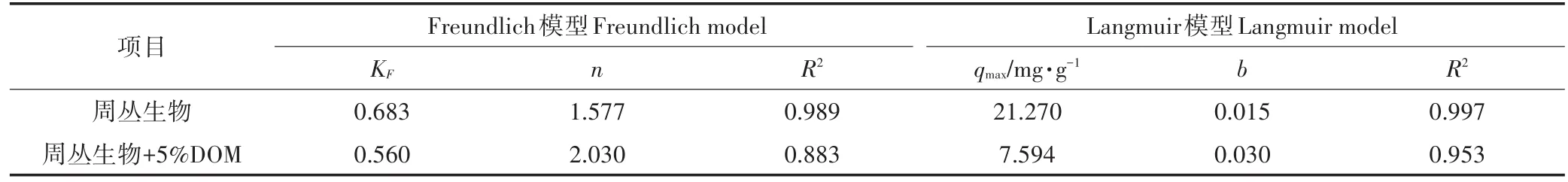
表2 周丛生物吸附Cu(Ⅱ)的Freundlich和Langmuir模型拟合参数Table 2 Adsorption isothermal parameters of Cu(Ⅱ)by periphyton fitted by Freundlich and Langmuir models
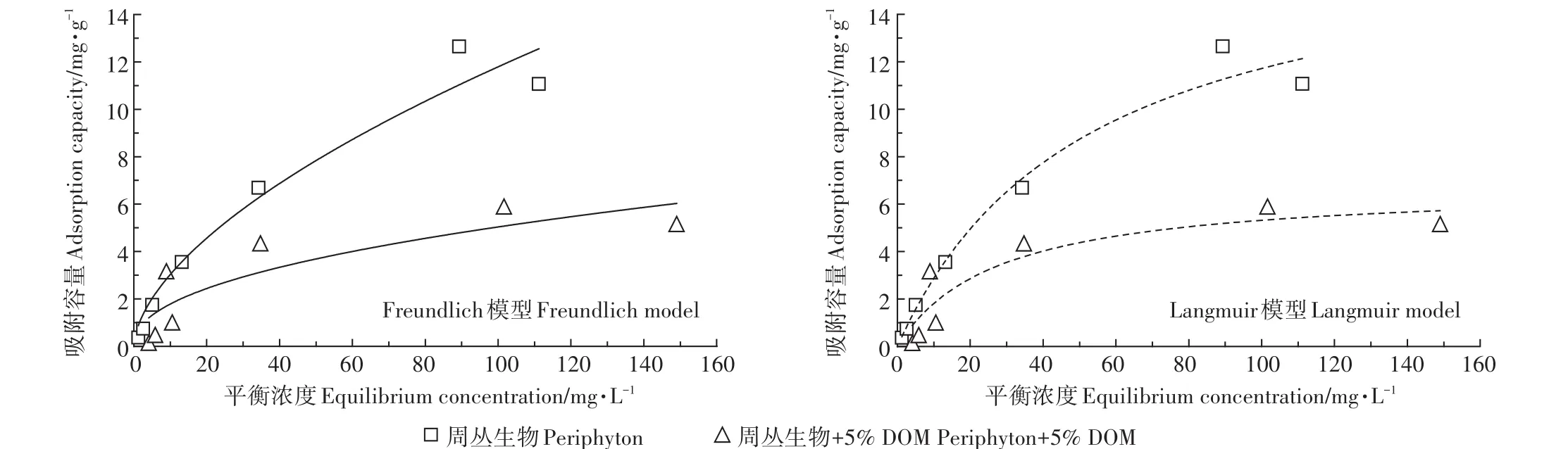
图3 Freundlich和Langmuir模型拟合周丛生物对Cu(Ⅱ)的等温吸附Figure 3 Adsorption isotherms of Cu(Ⅱ)by periphyton fitted by Freundlich model and Langmuir model
2.4 不同pH对吸附特性的影响
由图4可以看出,pH对纯周丛生物吸附Cu(Ⅱ)的影响较为明显,当pH增大,酸性减弱时,纯周丛生物的吸附容量逐渐增加。在pH从4升至8的过程中,纯周丛生物吸附效果的变化十分明显,吸附容量增加至2.04倍。而随着pH的增大,加入DOM的周丛生物对Cu(Ⅱ)的吸附容量几乎没有变化。
2.5 解吸特性
以H2O、NH4NO3、EDTA-2Na三种解吸剂对周丛生物吸附的Cu(Ⅱ)进行解吸。没有添加DOM的纯周丛生物中被H2O、NH4NO3、EDTA-2Na解吸的Cu(Ⅱ)分别为总吸附量的6.05%、53.58%、58.11%(图5)。加入DOM的周丛生物用EDTA-2Na作解吸剂的结果为56.36%,与纯周丛生物的结果相差不大,而用H2O和NH4NO3解吸的解吸率分别为12.60%和33.72%。

图4 不同pH对周丛生物吸附Cu(Ⅱ)特性的影响Figure 4 Effects of pH on the adsorption of Cu(Ⅱ)by periphyton
2.6 物料平衡
吸附前的周丛生物的消解测定结果显示其中几乎不含Cu(Ⅱ),所以表3和表4中仅显示吸附和解吸后溶液与吸附后周丛生物中的Cu(Ⅱ)的含量。试验体系中Cu(Ⅱ)的添加量为0.15 mg,由表3、表4可以看出,周丛生物吸附的Cu(Ⅱ)与上清液中残留的Cu(Ⅱ)含量之和可以达到物料平衡。
2.7 傅里叶红外光谱表征
周丛生物、周丛生物+DOM以及DOM的傅里叶红外光谱图如图6所示,周丛生物在872、1040、1382、1421 cm-1和3430 cm-1处有吸收峰,分别是不饱和烯烃、磷酸化合物以及羧酸根-COO-和-OH;DOM主要在1070、1382、1640 cm-1和3430 cm-1处有吸收峰,分别为磷酸化合物、羧酸根阴离子-COO-、酰胺基团和-OH;周丛生物加入DOM后各个吸收峰无偏移,仅吸收强度有小幅变化,872、1040 cm-1和 1421 cm-1处对应不饱和烯烃、磷酸化合物以及羧酸根-COO-的吸收峰小幅增强。

图5 不同解吸剂对周丛生物和周丛生物+DOM解吸Cu(Ⅱ)的解吸率Figure5 Thedesorption ratesof Cu(Ⅱ)fromperiphyton or periphyton+DOMby different desorption agents
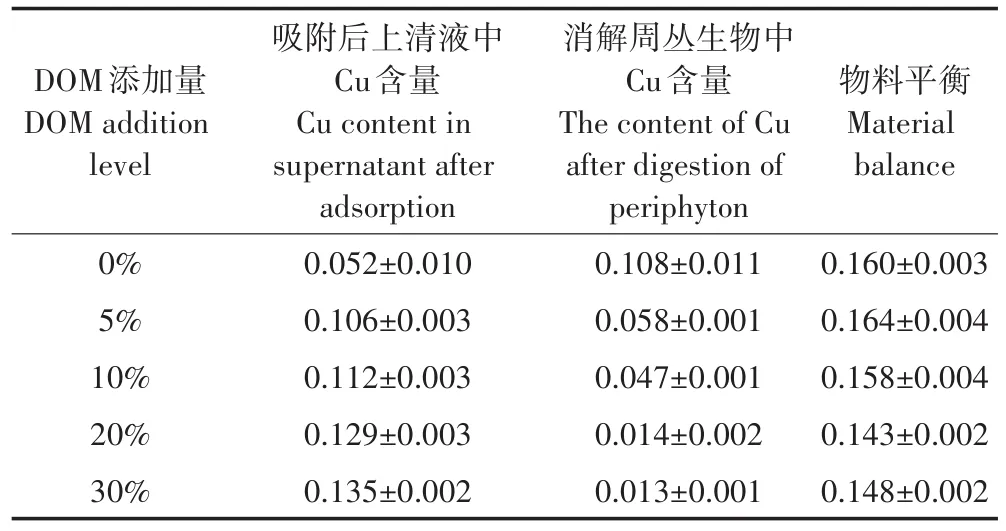
表3 不同DOM添加量试验中吸附前后的物料平衡(mg)Table 3 Material balance before and after adsorption with different DOM addition levels(mg)
2.8 周丛生物物种多样性分析

图6 周丛生物、周丛生物+DOM及DOM的傅里叶红外光谱图Figure 6 Fourier infrared spectra of periphyton,periphyton+DOM,and DOM
周丛生物中原核生物在门和属水平上的相对丰度如图7所示,在门分类水平上,按照占比从多到少依次为:蓝藻门(Cyanobacteria)占55.74%、变形菌门(Proteobacteria)占28.39%、浮霉菌门(Planctomycetes)占6.20%、酸杆菌门(Acidobacteria)占2.80%、拟杆菌门(Bacteroidetes)占2.02%、绿弯菌门(Chloroflexi)占1.20%和未分类菌群(Others)占1.56%。由图可以看出主要优势菌群为蓝藻门(Cyanobacteria)。在属分类水平上蓝藻门中一个未鉴定的蓝藻属(unclassi-fied_c_Cyanobacteria)占30.53%,是其中的优势菌群。

表4 解吸附试验中解吸前后的物料平衡(mg)Table 4 Material balance before and after desorption in desorption experiment(mg)
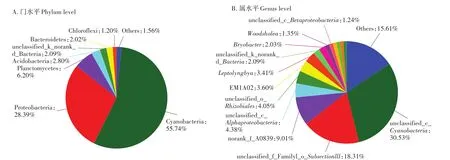
图7 周丛生物样品中原核微生物的物种组成和相对丰度Figure 7 Prokaryotic species diversity of periphyton sample
3 讨论
周丛生物对重金属离子有较强的吸附去除能力,Liu等[26]的研究显示,周丛生物对Cu(Ⅱ)的吸附去除效率为63%~73%。本研究的结果也表明,纯周丛生物对Cu(Ⅱ)的吸附去除效率为58%~73%,与其研究的吸附效果相差不大,同时其研究中周丛生物大多为丝状藻类和蓝藻。本研究高通量测序结果显示,周丛生物主要优势藻种为蓝藻,而蓝藻在生长过程中会分泌大量胞外聚合物[27],这些胞外聚合物也富含大量的羧基、氨基、羟基及磷酸基团等阴离子基团[28],周丛生物的红外基团分析的结果也与此吻合。本吸附试验研究结果表明,牛粪来源的DOM可以抑制周丛生物对Cu(Ⅱ)的吸附,且随着DOM添加量的增高抑制效果也增加。红外基团分析结果显示,牛粪来源的DOM主要含有羧基、酰胺基团、羟基等阴离子基团。羧基、羟基、羰基和氨基等活性基团能够与Cu(Ⅱ)形成二元配合物[29],从而影响Cu(Ⅱ)在水中的迁移。有研究表明,DOM只与Cu(Ⅱ)形成二元配合物,不会继续和藻类表面形成三元络合物[30]。据此推测,牛粪来源的DOM会和周丛生物竞争吸附Cu(Ⅱ),从而导致DOM抑制周丛生物对Cu(Ⅱ)的吸附。
Langmuir吸附模型多适用于单层吸附,Freundlich吸附模型多适用于多层吸附[31]。本研究等温吸附拟合结果显示,纯周丛生物对Cu(Ⅱ)的吸附用Langmuir模型和Freundlich模型拟合的相关系数都较高,而加入DOM后,Langmuir模型拟合的相关性系数要高于Freundlich模型,说明吸附体系加入DOM后降低了周丛生物吸附Cu(Ⅱ)的异质性。
解吸剂H2O、NH4NO3、EDTA-2Na能分别解吸吸附剂通过物理吸附、离子交换和离子络合作用吸附的金属离子[32-33]。本研究的解吸结果显示纯周丛生物对Cu(Ⅱ)的吸附方式主要是离子交换,加入DOM后的周丛生物对Cu(Ⅱ)的吸附主要是离子交换和表面络合。
吸附剂通过离子交换的方式吸附金属离子的能力受吸附体系pH的影响较大。当吸附体系pH较低时,细胞壁上的活性基团和水化氢离子(H3O+)紧紧结合在一起,从而限制金属离子的接近,影响吸附效果[34]。而在一定的pH值范围内,当pH逐渐升高时,更多的反应基团会带负电,可以吸附更多带正电的金属离子。本研究的解吸试验结果显示,添加DOM后,周丛生物通过离子交换吸附的方式吸附的Cu(Ⅱ)大幅降低,这也许是添加DOM后周丛生物对Cu(Ⅱ)的吸附受pH值影响较小的原因。
4 结论
(1)牛粪DOM含有大量的羟基、羧基、磷酸基团,对周丛生物吸附Cu(Ⅱ)有竞争抑制效应,且随着DOM添加量的增高抑制效果增加,当DOM添加量为30%时,周丛生物的吸附容量减少了80.21%。
(2)纯周丛生物对Cu(Ⅱ)吸附主要通过离子交换和络合吸附的方式进行,而加入DOM后离子交换吸附比率降低,表面络合吸附比率增加了18.11%。

