典型黑土环境下的高、低镉积累白菜品种筛选及耐性比较
陈 辰,朱园辰,喇乐鹏,张思佳,丁工尧,闫 雷
(东北农业大学资源与环境学院,哈尔滨 150030)
近年来,由于设施农业的不合理开展以及工业化程度的逐步加深[1],致使农业土壤镉(Cd)污染问题日趋严重,许多农用地无法安全利用[2]。据全国土壤污染调查公报显示[3],我国土壤中Cd的点位超标率为7.0%,农田Cd污染面积高达2×104hm2,已被确定为全国土壤污染首要污染物,而国务院颁布《土壤污染防治行动计划》中要求:到2020年,我国污染地块安全利用率需达到90%以上,因此Cd污染区农用土壤的安全利用已迫在眉睫[4]。Cd在农业环境中具有极高的生物累积性、毒性、环境移动性及持久性。因而极易危害土壤-植物系统,继而威胁食品安全及人类健康。据不完全统计,我国每年生产的Cd含量超标的农产品达“1.46×106t,且呈逐年增长趋势[5]。
有研究表明,因地制宜地开展农作物高、低积累品种筛选可使轻度Cd污染农用地得到安全有效的利用,如污灌区小麦品种筛选[6]及高Cd积累水稻品种筛选[7]等,现均已证实其应用可行性。高、低积累作物品种的筛选工作我国早有开展[8],受试品种应具备优秀环境适应能力和稳定传代的积累特征[9]。叶菜类蔬菜种类多样,品种丰富,在我国广泛栽培。目前已知不同种类、不同品种叶菜类蔬菜对重金属胁迫存在明显不同的抗性和积累,如大白菜[10]、青菜[11]和菠菜[12]等蔬菜对重金属的吸收与积累存在物种、品种和同一作物不同器官间的显著差异,而普遍的叶菜类蔬菜特别是白菜(Brassica pekinensis L.)品种更易吸收Cd并受其影响[12]。因此,Cd耐受力强,明确积累能力的白菜品种更应适宜在轻度污染的中国北方推广。然而,黑土中较高的有机质和pH虽然能够限制Cd在环境中的迁移能力,但局域性积累却已然威胁到了食品安全[13]。由于黑土的这一特点,Cd在其中的威胁性常受忽视,目前尚缺乏针对北方典型黑土Cd污染环境中高、低Cd积累叶菜类蔬菜的研究。故本研究通过盆栽试验模拟典型黑土区温室栽培条件,针对20种东北地区主栽白菜品种的Cd耐受力及积累特征进行筛选。以期为轻度Cd污染农用地的安全利用及黑土资源保护提供数据支撑。
1 材料与方法
1.1 试验材料
供试土壤类型系典型黑土,于2018年5月取自东北农业大学向阳实验基地试验温室区(44°04'N,125°42'E)0~20 cm耕层,过2 mm筛除去砾石等杂质,装袋、烘干、杀菌备用。同时取少量土壤用于土壤常规分析[14]及Cd含量测定[15],其土壤理化性质见表1。
1.2 试验设计
本试验于2018年5—8月在东北农业大学向阳实验基地温室区10号大棚内进行。为保证各处理间养分含量相同且满足植物生长需要,预先向供试土壤施入尿素、磷酸氢钙和氯化钾作为底肥(N:100 mg·kg-1、P:120 mg·kg-1、K:350 mg·kg-1),使各处理养分水平一致。供试土壤装于聚乙烯塑料盆(20 cm×15 cm×5 cm),每盆装土1.5 kg。共设7组Cd处理:0、0.05、0.1、0.15、0.3、0.6、1.2 mg·kg-1,向土壤中喷施外源Cd溶液(CdCl2·2.5H2O),待其风干后摊开混匀以加速其均质化进程,均质期40 d,期满后播种。供试品种信息见表2。
将供试白菜种子用10%H2O2消毒15 min,后用去离子水冲净,挑选籽粒饱满的种子播种,每盆播种20粒,待植株长至3片真叶时,间苗至每盆6株,期间将土壤含水量保持在田间持水量的65%~70%,及时去除虫害、杂草(整个栽培过程仿照当地习惯栽培模式进行)。每品种、每处理均重复3次,种植30 d后取每品种、每处理长势一致的3株用于Cd剂量-效应分析,40 d后收获余下植株进行Cd积累量及氧化损伤等指标测定,收获时先用自来水将完整的白菜植株冲洗干净,再用EDTA-2Na浸泡植株根系30 min,以去除根系表面有效态Cd,并经去离子水冲洗后用吸水纸擦干,将白菜分为根和可食用部分(叶)分置于-80°C冰箱保存。
1.3 指标测定
收获的白菜样品清理完毕后直接称质量,生物量以鲜质量计。土壤样品处置及Cd含量测定参照《土壤质量铅、镉的测定石墨炉原子吸收分光光度法》(GB/T 17141—1997)[15],植物根际土壤样品以抖落法收集500 g,四分法缩分至100 g风干,过2 mm筛除去砾石等杂质,研磨使其全部通过0.15 mm筛备用,其中5 g用于水分含量f的测定,另取待测土样0.2 g采用湿式消解法处理,利用石墨炉原子吸收分光光度计(Persee General,TAS-GF 990 super,中国)测定 Cd 含量WCd,其中 f及 WCd按下式计算:

表1 供试土壤理化性质Table 1 Physical and chemical properties of the tested soil

表2 供试白菜编号、品种及原产地Table 2 The code,cultivar and origin of the tested cabbages

式中:f为土壤水分含量,%;W1为烘干前土壤质量,g;W2为烘干后土壤质量,g;WCd为土壤Cd含量,mg·kg-1;c为试液吸光度减去空白试验的吸光度,然后在校准曲线上查得Cd的含量,μg·L-1;V为试液定容体积,mL;m为称取试样质量,g。
植物样品Cd含量测定参照《食品安全国家标准食品中镉的测定》(GB 5009.15—2014)[16],植物各部分样品称质量后冷冻研磨,取0.50 g经湿式消解法处理,消解完成用1%HNO3定容至25 mL容量瓶中并做试剂空白,试液经12 000 r·min-1离心10 min后取20 μL上清液于石墨炉原子吸收分光光度计进行测定,同时以国家标准物质(GSB 04-1721—2004 188038-4,GBW 08502)进行分析质量控制,所有植物样品Cd回收率均大于95%。按下列公式计算白菜可食用部分(叶)及根中Cd含量W、植株相对生物量RFBs、可食用部分(叶)富集系数BCFs、迁移系数TFs及全株净化率ERs:
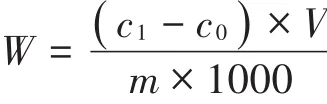
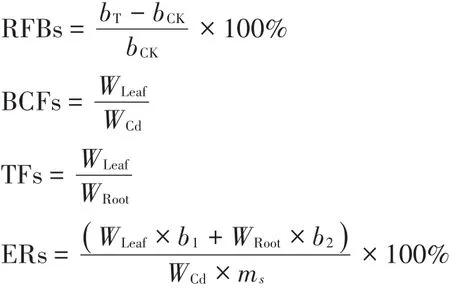
式中:W为植物样品Cd含量,mg·kg-1;c1为试样消化液Cd含量,ng·mL-1;c0为空白液 Cd含量,ng·mL-1;V为消化液定容总体积,mL;m为称取试样质量,g;bT为处理组生物量,g;bCK为对照组生物量,g;WLeaf为可食用部分 Cd 含量,mg·kg-1;WRoot为根部 Cd含量,mg·kg-1;b1为可食用部分鲜质量,g;b2为根部鲜质量,g;ms为根际土壤总质量,g。
白菜叶中的氧化损伤通过单位叶片鲜质量的过氧化氢(H2O2)、超氧阴离子(O-2)、丙二醛(MDA)、游离脯氨酸(FPRO)含量来评估,均需取0.5 g新鲜、清洁的叶片样品,在冷冻条件下制备成匀浆待测。过氧化氢含量测定采用硫酸钛-可见分光光度法[17],超氧阴离子含量测定采用盐酸羟胺-可见分光光度法[18],丙二醛含量测定采用硫代巴比妥酸(TBA)-可见分光光度法[19],游离脯氨酸含量测定采用酸性茚三酮-可见分光光度法[20]。
1.4 数据处理及分析
1.4.1 白菜品种Cd剂量效应分析
有研究表明[21],逻辑斯蒂分布模型(Log-logistic distribution)可较好地拟合重金属对植物的剂量-效应关系,由此推知诸如植物的半数有效量(ED50)等剂量参数,且适用于单一物种的生物敏感性分布(Species sensitivity distributions,SSD),故本研究采用其对不同品种白菜镉胁迫剂量-效应曲线进行拟合,并对拟合结果进行外推,以评估供试白菜品种的Cd耐受力。Log-logistic模型如下:

式中:y为各Cd处理水平白菜相对生物量,%;a、k为拟合参数;x为各个Cd处理的浓度值,mg·kg-1;xc为EC50的自然对数值。
1.4.2 数据处理
采用Excel 2016进行数据处理,Origin 2018软件进行绘图,应用SPSS23.0统计分析软件对数据进行单因素方差分析(One-way ANOVA)和P<0.05水平下的LSD检验、Tamhane检验。
2 结果与讨论
2.1 不同品种白菜Cd胁迫剂量-效应
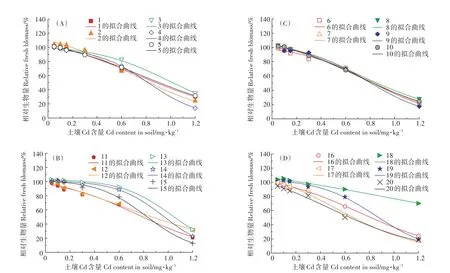
图1 不同品种白菜Cd胁迫-剂量效应曲线Figure 1 Dose-effect curves of different cabbage cultivars under Cd stress
不同品种会因Cd剂量不同而产生生物效应上的差异。就白菜而言最直观的剂量-效应便是生物量的变化。如图1,低Cd浓度下(0.05 mg·kg-1),除品种4、6、11、12、16、17、20外的13种白菜生长均表现出一定毒性刺激(Hormesis)效应,较对照生物量增幅0.57%~4.51%,这与Sidhu等[22]研究中发现低浓度Cd促使臭荠(Coronopus didymus L.)生物量增加的情况相似,这或许是植物在低Cd胁迫时的一种保护性“稀释”机制;而随浓度上升,各品种相对生物量均开始降低,此时Cd的毒性抑制对白菜生长产生影响;而土壤Cd浓度达到最大(1.2 mg·kg-1)时,Cd生物量抑制作用最明显。通过剂量效应曲线,可求算出供试白菜Cd的EC50及其95%置信区间,如表3。Cd胁迫下20种白菜EC50的变化范围为 0.469~1.204 mg·kg-1,且 r2最低为0.983,优于Wang等[23]以印度芥菜亚细胞积累表征的研究结果。其中品种18(JF)EC50值最高,为1.204 mg·kg-1;品种20(QT)EC50值最低,为 0.469 mg·kg-1,二者相差2.57倍。
由于盆栽试验环境较为恒定,可排除多数干扰因素,如pH、盐效应等的干扰,因此可通过Log-logistic模型拟合白菜品种生物量,衡量不同品种Cd耐受能力[24]。基于不同品种白菜生物量进行拟合的半数抑制浓度结果可知,黑土栽培过程中供试白菜Cd耐受能力 由 高到 低 依 次 为:JF、BCCRQJ、XF、HX65、XFQB、DHF65、586LSKF2、JYKC、SK、JYKC4、ZB61、FGKC、DN909、CRDW3、JQFSS、JBC、GLDB、DC18J、FGC80F1、QT,品种Cd耐性差异明显,将半数抑制浓度进行对数变换后,继续采用Log-logistic模型对其进行物种敏感性分析(SSD),分布曲线如图2,基于半数抑制浓度的拟合结果较好,r2=0.982 1,大部分品种的实际值大于或接近预测值,但耐性最佳品种JF和最差品种QT有较高预测值,这同Ding等[25]在白菜-土壤系统上建立SSD以评价土壤Cd阈值的结果类似,或许说明其可能在其他环境下具备较高耐Cd潜力。

表3 白菜Cd半抑制毒性阈值浓度(EC50,mg·kg-1)及其95%置信区间Table 3 Toxicity thresholdsof Cd to cabbage cultivars(EC50,mg·kg-1)and their 95%confidence intervals
2.2 不同白菜品种的Cd积累特征分析
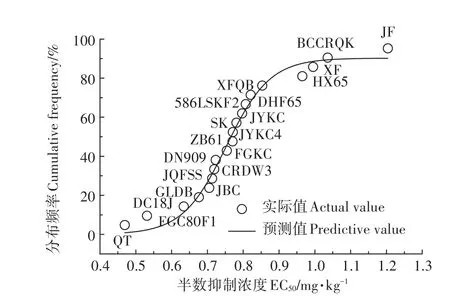
图2 不同白菜品种基于半数抑制浓度的物种敏感性分布曲线Figure 2 Cumulative frequencies of species sensitivity distributions(SSD)of thedifferent cabbagecultivarsbased on EC50
土壤中Cd污染程度不同会造成白菜的积累差异,而白菜可食部分(叶)中的Cd积累是评定其食用安全性的重要参数[10]。不同程度Cd污染土壤中供试品种叶积累量分布如图3,对于同一程度Cd污染,20种白菜品种叶中Cd积累量符合正态分布,品种间差异明显,按Cd积累量离散程度由小到大分别为0.1、0.05、0.15、0.3、0.6、1.2 mg·kg-1,其中 Cd投加浓度为0.6 mg·kg-1和1.2 mg·kg-1的土壤中有过半数的供试品种超过或接近《食品安全国家标准食品中污染物限量》(GB 2762—2017)中叶菜类农产品Cd检出限0.2 mg·kg-1[26],而其他投加浓度下叶Cd积累量较小,难以作为特征积累品种的筛选依据,且0.6 mg·kg-1和1.2 mg·kg-1的土壤Cd添加浓度为《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中[27]推荐农用地土壤Cd污染风险筛选值(0.6 mg·kg-1,pH>7.5)的1倍和2倍,可供指导实际筛选工作。因此,为准确切合东北典型黑土耕作环境,筛选出安全可靠的白菜品种,本试验确定以土壤Cd投加浓度0.6 mg·kg-1和1.2 mg·kg-1作为筛选浓度,测定供试品种各部位Cd积累量,以鉴定高、低Cd积累白菜品种。
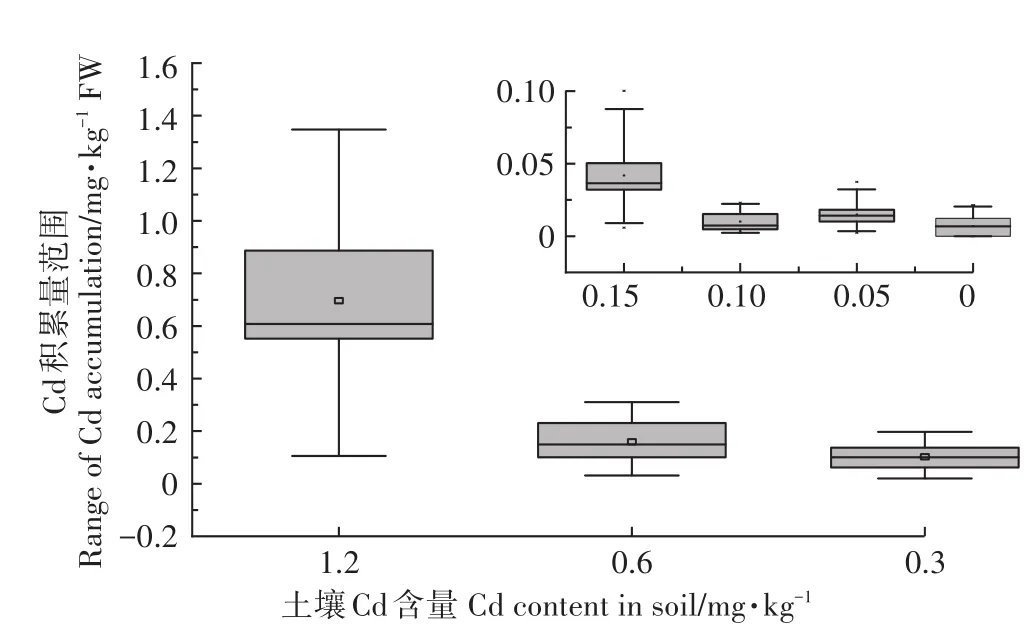
图3 不同程度Cd污染土壤中白菜品种的积累量范围Figure 3 Accumlation range of cabbage cultivars in soil of different Cd level
白菜品种间各部位Cd积累能力也存在差异,而不同部位Cd积累量差异决定了品种独特的积累特征和植物-土壤效应[28],供试白菜各部分Cd积累量如图4,当土壤外源Cd含量为1.2 mg·kg-1时(图4A),叶Cd积累最高品种为DHF65(品种15),积累量达1.348 mg·kg-1FW;最低为JF(品种18),积累量仅0.106 mg·kg-1FW,也是试验中唯一一种在1.2 mg·kg-1筛选浓度下Cd积累量低于0.2 mg·kg-1FW国家食品安全标准限值的供试品种。根Cd积累最高品种为BCCRQJ(品种13),积累量达3.128 mg·kg-1FW;最低品种为JF(品种18),积累量为0.614 mg·kg-1FW。大部分叶菜类蔬菜叶Cd积累均保持较高水平,这与张泽锦等[29]的研究相似。而当土壤外源Cd含量为0.6 mg·kg-1时(图4B),叶Cd积累从高到低依次为品种1、5、15、7、3、10、2、9、14、6、4、13、12、8、19、16、17、20、11、18,其中30%超出了国家食品安全标准限值。根Cd积累由高到低依次为品种10、5、1、15、7、9、13、8、3、2、14、20、19、6、4、12、18、16、11、17。由于筛选浓度已经接近或降至品种的耐受浓度,同高浓度组相比,一些品种(如FGC80F1)的Cd积累量有了较大变化,相关研究认为[30]这是由于植物根系在Cd积累中起着主控作用。
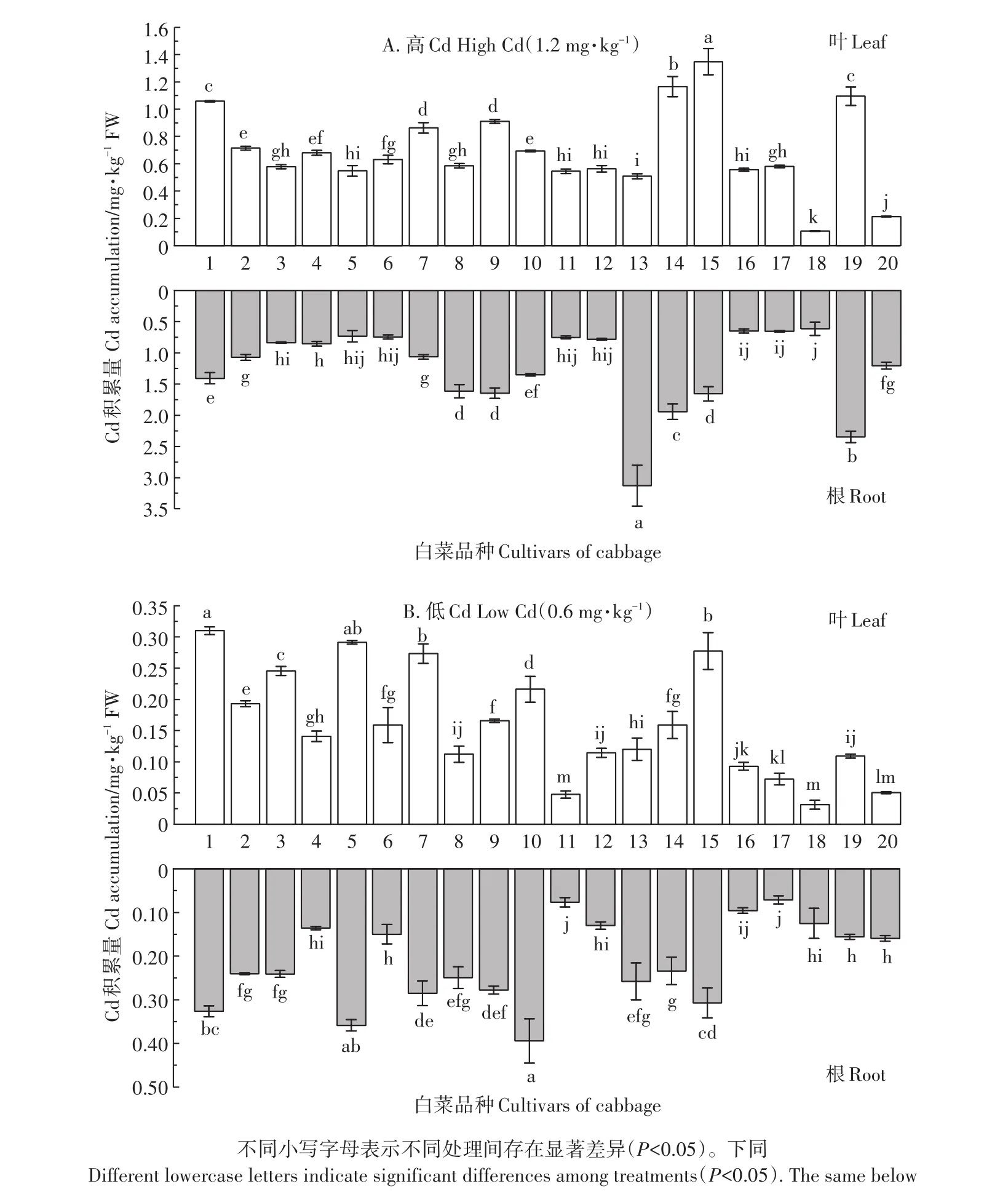
图4 供试白菜品种不同部位Cd积累量Figure 4 Cd accumulation in different parts of tested cabbage cultivars
植物Cd积累特征可通过富集系数(BCFs)、迁移系数(TFs)来描述,而根际土壤Cd含量和植物净化率可反映植物-土壤体系中的相互作用,有助于选取适当植物控制土壤污染[31]。供试品种根际土壤Cd含量、富集系数、迁移系数、净化率如表4,1.2 mg·kg-1筛选浓度下,品种间根际土壤Cd含量差异明显(P<0.05),CRDW3(品种1)具有最强的叶Cd富集能力,是最弱品种QT(品种20)的10.8倍,FGC80F1(品种17)根叶间Cd迁移最强,为最弱品种JF(品种18)和QT(品种20)的5.0倍,BCCRQJ(品种13)单株净化能力最佳,是最低品种XFQB(品种19)的11.7倍;0.6 mg·kg-1筛选浓度下的品种间根际土壤Cd含量差异也十分明显(P<0.05),但品种积累特征并不同于高浓度(1.2 mg·kg-1),BCCRQJ(品种13)叶Cd富集能力最高,是最低品种JF(品种18)的5.7倍,JYKC(品种6)根叶间Cd迁移能力最高,为最低品种JF(品种18)的4.2倍,BCCRQJ(品种13)在0.6 mg·kg-1筛选浓度下也具有最高Cd净化率,为14.28%,最低的QT(品种20)与之相差5.6倍。相关研究认为[32]低积累植物可食用部分迁移系数和富集系数应小于1,且系数越小越说明污染物难向可食用部分积累,而高积累植物迁移系数和富集系数则越大越好,也有学者[33]发现青葙(Celosia argentea Linn.)等Cd超积累植物叶积累能力高于根系。不仅如此高积累植物更看重对污染物的净化率,净化率越高,单株净化能力越强,吴志超[34]也据此完成对高、低Cd积累油菜的筛选。
2.3 高、低Cd积累品种的浓度积累效应
可投入实际生产的高、低Cd积累品种需具备耐受力强,积累特征稳定且显著的特点,而其积累量也与生物量存在联系[35]。由于95%的供试品种在1.2 mg·kg-1筛选下生长不良,仅JF在此浓度下有较高生物量,结合各品种半数抑制浓度(表3),BCCRQJ(品种13)Cd耐受力仅次于JF,且净化率最高,仅根部积累量就达3.128 mg·kg-1FW,可作为高Cd积累品种适用于≤0.6 mg·kg-1Cd污染地区,而JF(品种18)叶Cd积累量低,Cd富集、迁移因子均小于1,0.6 mg·kg-1筛选条件下JF叶仅含Cd 0.031 mg·kg-1FW,可保证食用安全,可作为低Cd积累品种应用于≤0.6 mg·kg-1Cd污染地区。对比二者随土壤外源Cd含量变化的积累能力发现(表5),两品种叶、根的Cd积累量均显著增高(P<0.05),其中BCCRQJ(品种13)叶、根积累量在1.2 mg·kg-1下最高,分别为JF的4.8倍和5.1倍。而对比二者净化率可发现(表5),土壤外源Cd浓度增加会降低两品种净化效率,但即使在高浓度下(1.2 mg·kg-1),BCCRQJ净化率也高于唐皓等[7]研究中高Cd积累品种的净化率。低浓度下(0.15 mg·kg-1)BCCRQJ净化率有所升高,这可能是由于低浓度Cd刺激了BCCRQJ的吸收与体内输送[36]。不过,虽然BCCRQJ有较高单株净化率,但积累量较低,远不及龙葵[37]等超积累植物的净化能力。
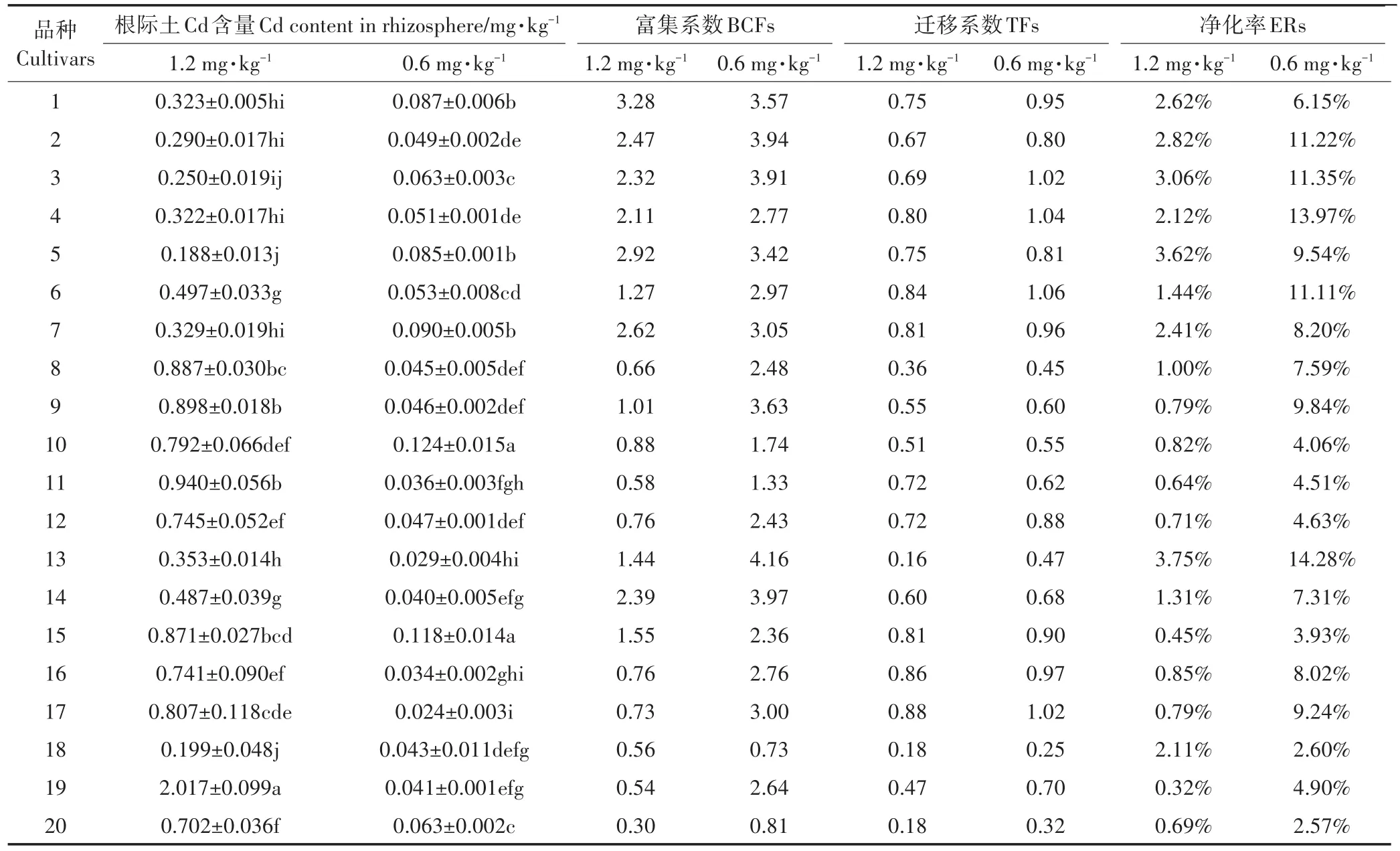
表4 供试白菜品种根际土Cd含量、富集系数、迁移系数及净化率Table 4 Cd content in rhizosphere,bioconcentration factors(BCFs),translocation factors(TFs),and extraction rates(ERs)of tested cabbage cultivars
2.4 Cd胁迫下两种白菜的氧化损伤
Cd胁迫会导致白菜积累过氧化氢、超氧阴离子等活性氧(ROS),造成氧化损伤产生大量丙二醛和游离脯氨酸[35],且氧化损伤的程度受Cd浓度影响[38]。Cd诱导不同品种白菜产生的氧化应激反应与基因型有关,不同外源Cd浓度下,两白菜品种叶中的过氧化氢、超氧阴离子、丙二醛及游离脯氨酸含量如图5所示。
正常植物体内过氧化氢(H2O2)、超氧阴离子(O-2)等活性氧的产生和清除维持着动态平衡,Cd胁迫会打破该平衡,致使其瞬时积累继而氧化损伤细胞膜结构,其含量是表征植物氧化损伤程度的重要指标,如图5A、图5B。外源Cd含量与两种白菜叶中H2O2含量及O-2含量均呈显著正相关(P<0.05),但BCCRQJ中H2O2增长率高于JF,而O-2增长率则低于JF:当土壤中Cd浓度达到1.2 mg·kg-1时,BCCRQJ的H2O2含量较对照(0 mg·kg-1)增长了94.2%,而JF增长了38.7%;BCCRQJ的O-2含量较对照增长了200.2%,而JF增长了217.8%。当植物遭受Cd胁迫,O-2的动态平衡会率先被打破,大量O-2的积累会加速细胞衰亡,而H2O2作为植物自身O-2清除反应的中间体,也会大量积累[39]。当低浓度Cd(0.15 mg·kg-1)胁迫JF时,其H2O2含量有所降低,这可能是由于JF自身抗氧化能力提高所致,这同Singh等[40]对于Cd胁迫番茄幼苗的研究结果类似。
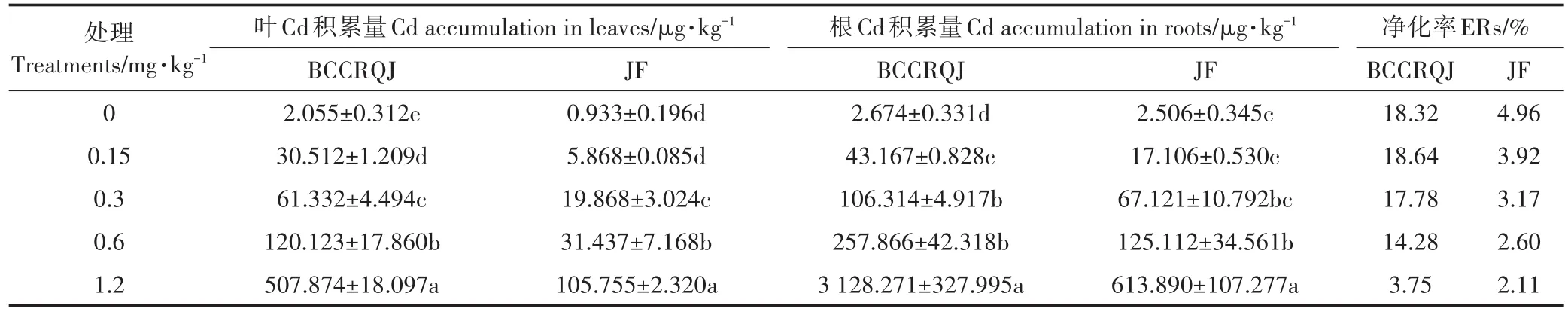
表5 不同浓度外源Cd胁迫下两种白菜的Cd积累Table 5 Accumulation of two cabbage cultivars under different exogenous Cd concentrations
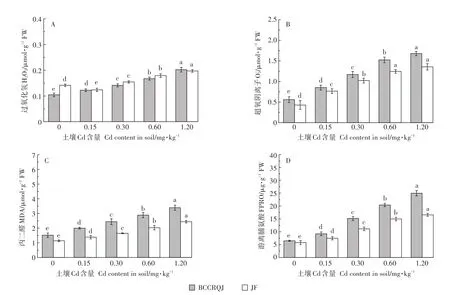
图5 不同浓度外源Cd胁迫下两种白菜氧化损伤指标Figure 5 Oxidative damage factors of two cabbage cultivars under different exogenous Cd concentrations
丙二醛是脂质过氧化的重要产物,而游离脯氨酸通常伴随植物盐胁迫而激增,正常状况下含量极低,二者均可作为评价Cd诱导植物产生氧化损伤程度的重要指标[41],如图5C和图5D。两白菜品种MDA、FPRO含量均随土壤Cd含量升高而显著增高(P<0.05),同对照相比,1.2 mg·kg-1土壤Cd浓度下,BCCRQJ的MDA含量增长了124.1%,FPRO含量增长了284.9%,JF则分别增长了114.4%和186.4%。Mzoughi等[42]也将MDA作为反映植物Cd诱导氧化损伤程度的指标,发现了Cd胁迫菠菜组织MDA大量积累;同样Ozfidan-Konakci等[43]认为FPRO含量增加可视作胁迫发生标志,观察到Cd处理7 d小麦幼苗中FPRO含量显著升高。另外,当外源Cd增至最高(1.2 mg·kg-1),BCCRQJ中 H2O2、O-2、MDA、及FPRO含量水平均高于JF,除O-2外,BCCRQJ各指标增幅也高于JF,孙园园等[44]对于高Cd积累植物黑麦草的研究中也发现,随Cd含量升高脯氨酸、MDA含量有所上升,细胞质、膜过氧化明显。这意味着在较高的污染水平下高Cd积累白菜品种或许会比低Cd积累白菜品种承受更严重的氧化胁迫。
3 结论
(1)20种白菜对于Cd胁迫的敏感性分布具有显著差异,其中JF具有最强Cd耐性,耐受阈值为1.204 mg·kg-1,BCCRQJ次之,为1.036 mg·kg-1,QT Cd耐性最差,仅为0.469 mg·kg-1。
(2)不同土壤Cd浓度下20种白菜可食用部分积累量差异均明显,其中土壤外源Cd含量为1.2 mg·kg-1时种间差异最大,0.6 mg·kg-1时次之。此两浓度下:JF可食用部分Cd积累量均最低,低于国家食品安全标准限值0.2 mg·kg-1(叶菜类产品);迁移、富集系数均小于1,说明其可作为在东北地区安全生产的低Cd积累品种。而BCCRQJ净化率最高,为18.64%,说明其有较好Cd吸收作用,为高Cd积累品种,具有一定植物修复潜力。
(3)JF和BCCRQJ叶、根Cd积累量与土壤Cd含量呈显著正相关,净化率与之显著负相关(P<0.05)。且随Cd胁迫程度加剧,二者氧化损伤越严重,过氧化氢、超氧阴离子、丙二醛、游离脯氨酸含量均随土壤外源Cd含量上升而显著增加(P<0.05),但BCCRQT除超氧阴离子外的氧化损伤指标增幅均高于JF,说明高Cd积累品种能承受更高的氧化损伤风险,而低积累Cd品种JF能更好地抵抗Cd诱导的氧化胁迫。

