靶向烟碱乙酰胆碱受体的戒烟药物的研究进展
张耀红 罗蒙强 王 海
(1.绍兴文理学院 化学化工学院,浙江 绍兴 312000;2.绍兴文理学院 生命科学学院,浙江 绍兴 312000)
0 引言
烟草依赖是由个体持续摄取尼古丁(香烟的主要活性成分)所致的慢性高复发性的成瘾性疾病.吸烟是给人类健康造成严重威胁的罪魁祸首之一,它几乎可以损害人体所有器官.研究表明吸烟不仅与心脏病、癌症、消化系统疾病、呼吸道疾病和心脑血管疾病等密切相关,而且还会导致孕妇流产、胎儿发育不良和中枢神经系统功能异常[1].烟草依赖是危害人类健康的一大公害,由吸烟引起的相关疾病已成为导致人类死亡的首要原因之一.据WHO估计,全球大约有11亿烟民,每年约600万人死于由吸烟引起的相关疾病,约占全部死亡人数的20%,从而产生极大的医疗费用和社会负担[2].中国是世界上最大的烟草受害国,中国现有烟民约3.5亿,占世界吸烟总人数的1/3,受被动吸烟危害的人数有约5.4亿,每年死于烟草相关疾病的人数为100多万,超过因艾滋病、结核、交通事故以及自杀死亡人数的总和[3].中国每年由8%的医疗费用于吸烟相关疾病,由于烟草使用导致的中青年死亡超过7万,劳动力损失更是无法用经济来衡量.因此,如果不能及时有效的戒烟,烟草危害形势将更加严峻.
烟碱乙酰胆碱受体(nAChR)是一个调节神经系统的配体门控离子通道复合体,与5-羟色胺受体(5-HT)、GABA A型受体和C型受体、甘氨酸受体及一些无脊椎动物的谷氨酸和组氨酸受体同源[4].nAChR是由5个亚单位以不同的组合形式构成的5-聚体寡蛋白,在肌肉、中枢神经和周围神经系统广泛表达,参与神经系统的兴奋性传递,介导神经递质的快速突触传递.nAChR通过影响递质释放、细胞兴奋性及神经整合过程等对神经网络进行调节并参与许多生理功能和病理过程.nAChR不但与学习、记忆、注意力、唤醒以及感觉有密切关系,而且nAChR与许多神经系统疾病密切有关,如尼古丁成瘾、帕金森病、阿尔茨海默病、常染色体显性夜发癫痫、精神分裂症、镇痛等[5].然而,从病理学角度讲,人类疾病与nAChR的最基本关系依然是尼古丁成瘾问题[6].
1 烟碱乙酰胆碱受体(nAChR)与尼古丁成瘾
尽管吸烟有害健康,然而烟草依赖者还是持续吸食难以戒掉,这主要是由于吸烟者对尼古丁的依赖以及尼古丁缺乏引起的戒断反应(如恶心、头痛、渴望补充尼古丁等)所致.抽烟成瘾的实质是烟碱(俗称尼古丁)依赖,神经生物学机制除了与神经元nAChR的亚型有关外,还与烟碱对中脑边缘多巴胺(DA)递质系统的影响等相关.
1.1 nAChR亚型与尼古丁成瘾
目前已确认有多种具有不同功能的nAChR亚型存在.在神经系统中,最丰富的受体是α4β2、α7和α3β4,其中最主要的亚型是α4β2受体.α4β2 nAChR在烟碱依赖中起重要作用.α4亚单位是尼古丁敏感性的重要决定因素,一些含α4亚基的nAChR可以控制烟碱刺激DA神经元释放DA,含β2亚基的受体则可以控制烟碱引起的中脑缘DA神经元的反应和突触前膜释放GABA,影响尼古丁的行为效应,含有β2* nAChR的活化还与尼古丁引起的奖赏效应密切相关,促使成瘾的形成[7-8].α7 nAChR与烟碱依赖也有密切关系,α7 nAChR影响VTA区DA神经元的兴奋性输入[9].α7 nAChR参与尼古丁对中枢神经递质释放的调节作用和快速的突触传递,在兴奋输入部位对DA能神经元进行长时程增强效应,而且它对觅药行为的形成可能与烟碱的强化作用有关[10].α7 nAChR的激动与尼古丁引起的戒断反应密切相关[11].尽管其它亚型的nAChR在大脑内表达量相对较少,但也和尼古丁成瘾存在一定的关系,如α3β4nAChR可能与烟碱依赖有关.给小鼠注射α3β4nAChR抑制剂后,可以减弱烟碱引起的行为敏化、自我给药行为、戒断综合症和条件位置偏爱[12].而且β4亚基与烟碱和其它精神药物引起的戒断反应有关,在β4基因缺失的小鼠中,烟碱引起的躯体戒断症状消失[13].含有α5*或α6* nAChR也与尼古丁引起的奖赏效应相关[14].
1.2 中脑边缘DA系统与尼古丁成瘾
中脑边缘系统的腹侧被盖区(VTA)和伏隔核区(NAc)中的DA能神经元,在尼古丁的成瘾过程中起着非常重要的作用[15-16].
1.2.1 中脑缘DA系统的尼古丁的奖赏路径
中脑边缘DA系统的尼古丁的奖赏效应是导致尼古丁成瘾的主要原因之一[17].中脑边缘DA系统主要起源于VTA,由DA能和γ-氨基丁酸(GABA)能神经元组成,投射到伏核、杏仁核和前额皮层.VTA的传入神经纤维主要是来自前额皮层(PFC)、杏仁核和海马的谷氨酸能神经元投射纤维,同时还接受来自中脑被盖外侧核的乙酰胆碱能神经元投射纤维.急性烟碱暴露,GABA神经元和输入到TPP的信号调控奖赏路径起重要作用[18].尼古丁瞬时活化GABA神经元,GABA神经元的nAChR快速脱敏[19],导致NAc急性释放DA,这将导致抽烟引起的短时程兴奋[20].而长期摄取烟碱可以刺激42 nAChR的活化和脱敏,接下来上调42 nAChR,诱导中枢神经系统中42 nAChR的数量和3H烟碱的结合位点明显增加[21-22],导致尼古丁的渴望和需求[23].急性和慢性给药尼古丁都作用于42 nAChR的VTA,然后使nAChR的构象发生变化,nAChR离子通道打开,使钠离子或钙离子进入进一步激活电压-依赖型钙通道,使Ca2+内流增加和突触传递增强,从而增加VTA区DA能神经元的放电,最终使释放到PFC和NAc的DA增加,从而产生奖赏效应(如愉悦感等),进而对尼古丁产生心理依赖.
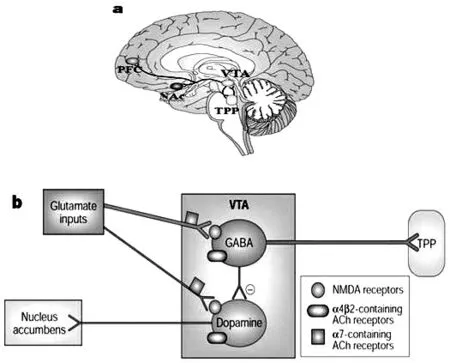
图1 [24]人类中脑缘和中脑皮层DA通路(a)和VTA区的尼古丁奖赏通路(b)
2 戒烟药物的研究进展
目前现存的戒烟药物主要是以nAChR为靶点,以nAChR介导的尼古丁诱导多巴胺和去甲肾上腺素释放作为药物开发方向,存在疗效有限并且高复发率的问题,而nAChR亚型选择性激动剂和拮抗剂均可被开发为新一代治疗药物,都具有潜在的优势和局限性.nAChR受体拮抗剂(部分或全部)通常具有良好的耐受性以及患者依从性,因为它们可以代替使用烟草时产生的快感[25-28],而nAChR的部分或完全激动剂可以缓解戒断症状的发生[29].尽管尼古丁的替代疗法是戒烟的主要方法,但同样存在以nAChR部分激动剂作为治疗药物的一些新的、潜在的治疗方法.nAChR部分激动剂来代替尼古丁作为治疗方法,能缓解戒断症状的产生和减少对烟草的渴求,同时还可以减少尼古丁的强化和由nAChR介导的尼古丁重复给药引起的药物的释放[30-31].与完全激动剂相比,部分激动剂对最大程度释放神经递质的响应能力要小得多,不容易造成药物的滥用[32].然而,激动剂替代疗法的戒烟效果却并不理想[33],其存在的一个潜在的不足之处就是持续刺激nAChR会使戒烟者对烟草使用的依赖性增加.因此,在使用尼古丁替代疗法治疗之后,烟瘾又复发的情况下,会使得尼古丁自身给药的强化效应迅速恢复.目前,靶向nAChR的戒烟药物分为三类:(1)尼古丁替代品;(2)nAChR部分激动剂;(3)nAChR拮抗剂.
2.1 尼古丁替代品
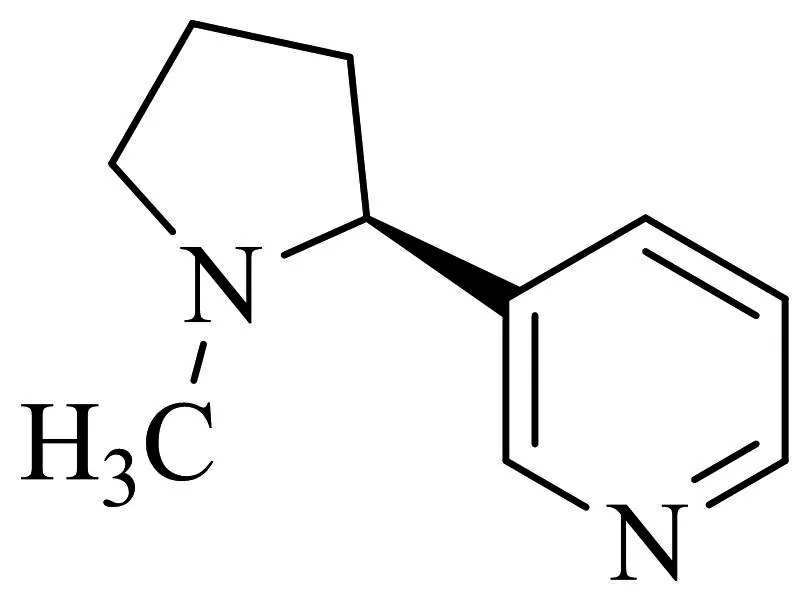
图2-1 尼古丁
尼古丁又名烟碱,是烟叶的主要活性成分,主要作用于中枢α4β2 nAChR,在人体内的半衰期约为2 h[34].尼古丁能增加脑中乙酰胆碱、DA、去甲肾上腺素、5-羟色胺、谷氨酸、GABA的释放,但是具有很强的成瘾性,并且大剂量的尼古丁则会引起恶心呕吐,严重时会导致死亡.尽管使用尼古丁替代品治疗尼古丁成瘾已经在临床上使用多年,而且尼古丁替代品种类也很多(如口香糖、透皮贴剂、含片、鼻喷剂、舌下片、吸入剂),但由于戒烟的过程仍需小剂量医用尼古丁,仍具有成瘾性,而且治疗周期长,复吸率高,成功率较低(3-36.8%)[35-36].
2.2 nAChR部分激动剂
用作戒烟试剂的nAChR部分激动剂主要有:法尼克兰、金雀花碱、Dianicline和ABT-418.
2.2.1 法尼克兰(Varenicline)
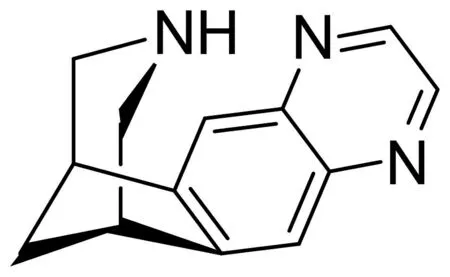
图2-2 法尼克兰
法尼克兰(Chantix)是美国食品药品监督管理局(FDA)批准使用的三种戒烟药物之一,在1997年由辉瑞公司研究开发,2006年5月经美国FDA批准上市成为治疗尼古丁成瘾的药物.为α4β2 nAChR部分激动剂.在[3H]-烟碱与α4β2 nAChR的结合活性测试中,该化合物具有很高的亲和性,Ki为0.4 nM,使受体脱敏的IC50为0.07 nM,使受体活化的激动剂活性EC50为1.4 μM[37].一方面它与nAChR结合后能释放少量的DA,减少对尼古丁的渴望,另一方面阻挡尼古丁和受体的结合,抑制尼古丁诱导的DA的释放[38-39].所以,法尼克兰通过与α4β2 nAChR结合产生激动和拮抗双重作用进行戒烟,既可以减轻对尼古丁的渴望和戒断症状,又可以减少复吸的可能性.法尼克兰还可以提高阿尔茨海默病的认知缺陷,目前处于临床二期[40].体内结合研究发现,法尼克兰对α4β2亚型烟碱乙酰胆碱受体具有很高的亲和力,而对其他亚型几乎不具备亲和力[37].此外,法尼克兰可以使大鼠脑切片中释放较低浓度的多巴胺(40-60%由尼古丁释放)[41].因此,法尼克兰是α4β2*亚型烟碱乙酰胆碱受体的部分激动剂[37].同时,法尼克兰还能完全激动α7亚型烟碱乙酰胆碱受体[42].对人体来说,法尼克兰的最大吸收在口服给药后的3-4 h,半衰期为24h[43],其主要通过肾脏排泄[44],健康成人口服给药后在四天内达到稳态水平[43].临床研究发现,法尼克兰几乎可以完全替代尼古丁,阻断大鼠体内尼古丁的自身给药[41].第二阶段和第三阶段临床试验的结果表明法尼克兰戒烟成功率比安慰剂多了2-3倍[45-46].另外,随机多中心的双盲安慰剂对照试验研究结果表明,戒烟后的9-12周内,使用法尼克兰的戒烟者烟草戒断率达到了44%,高于使用安非他酮(33%)和安慰剂(18%)的烟草戒断率[47].大多数戒烟者在戒烟后9-52周内的随访结果表明,接受法尼克兰的烟草戒断率(22%)依旧高于接受安非他酮(16%)和安慰剂(8%)的戒烟成功率[47],但是接受法尼克兰治疗的戒烟者可能会产生严重的精神症状,包括焦虑,抑郁等负面情绪并且试图自杀,但是所幸这种不良反应的发生几率很小[48].
2.2.2 金雀花碱及类似物
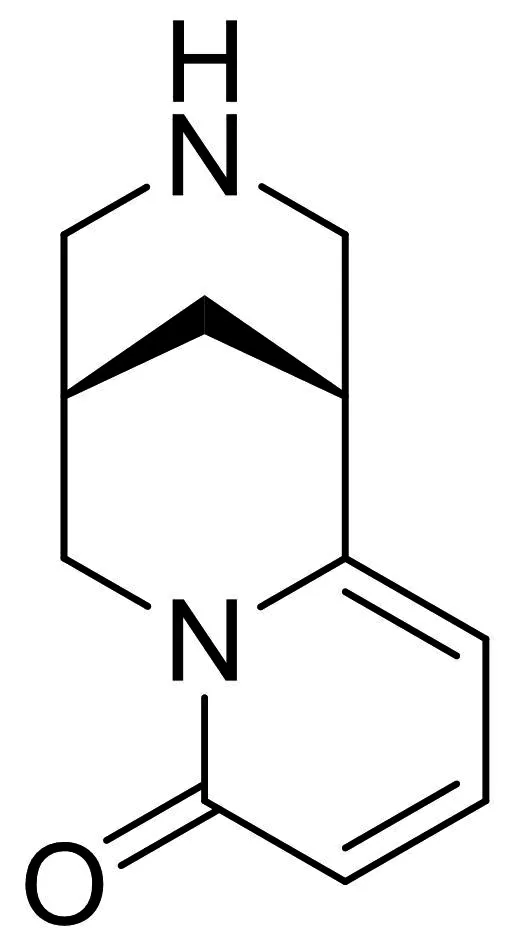
图2-3 金雀花碱
金雀花碱是一种选择性的α4β2 nAChR部分激动剂,在[3H]-地棘蛙素与α4β2 nAChR结合分析中Ki为2 nM,IC50为0.05 nM[49].在体外,它能引起[3H]-DA从中脑皮层的片层结构和突触体中释放,最大有效量为尼古丁的50%,而在伏隔核内,以最大有效量为尼古丁的40%加快DA的释放速率[50-51].金雀花碱戒除尼古丁成瘾的效率约是尼古丁取代治疗的14%,可能与其较差的血脑屏障渗透性有关,ClogP为0.60[52-53].Chellappan等[53]对该化合物进行结构改造,在金雀花碱的6,9和10位分别引入不同的取代基,结果发现在金雀花碱的10号位引入甲基或者乙烯基可以得到对α4β2 nAChR亲和活性和选择性很好的化合物,前者对α4β2 nAChR的亲和性与金雀花碱相当,但是选择性提高很多,在[3H]-地棘蛙素与nAChR结合分析中,与α4β2和α3β4 nAChR结合时,Ki分别为1.9 nM和6 700 nM,亲和选择性(α3β4/α4β2)为3526.后者在[3H]-地棘蛙素与nAChR结合分析中,与α4β2和α3β4 nAChR结合时,Ki分别为0.73 nM和95 nM,而对不同亚型的nAChR的激动剂活性,EC50α4β2和EC50α3β4分别为1.3 μM和30 μM,虽然其激动剂活性与前者相近,但是提高了血脑屏障渗透性,表现出好的理化常数ClogP为1.50.
2.2.3 Dianicline
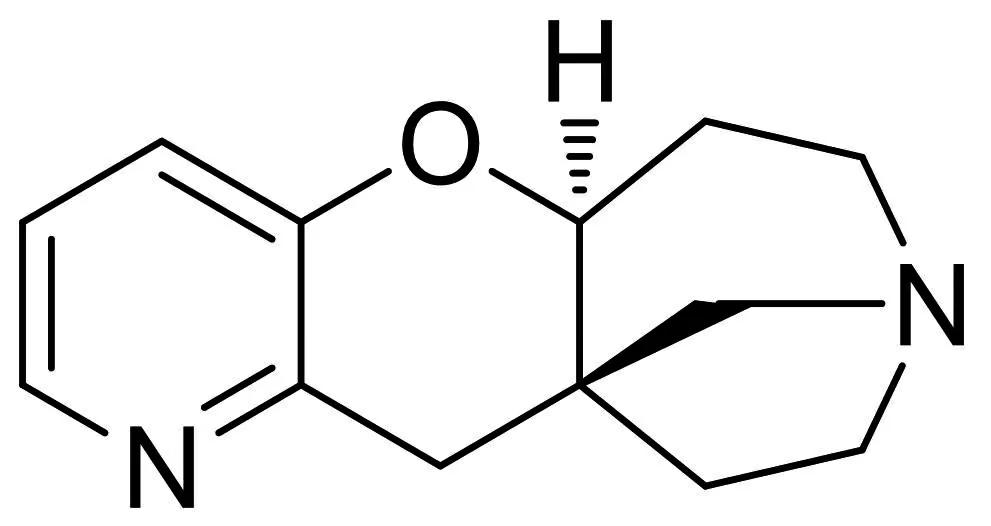
图2-4 Dianicline
Dianicline又名SSR-591813,是法国的赛诺菲-安万特公司开发的用于治疗尼古丁成瘾的部分激动剂,在[3H]-金雀花碱与人类的α4β2 nAChR结合分析中,它对人类α4β2nAChR具有很高的亲和活性,Ki为36 nM,激动剂活性EC50为1.3 μM,然而对于在爪蟾卵母细胞,HEK293细胞和IMR-32细胞表达的其他亚型nAChR则具有较低的亲和性,如Ki α4β2 nAChR为1 791 nM,Ki α3β2 nAChR为116 nM[54].虽然对Dianicline的机理作用了解有限,但它在结构上与伐伦克林和野靛碱相似[54].在电生理学的研究中发现,SSR-591813对烟碱乙酰胆碱的抑制反应的比例仅为19%,这表明Dianicline具有部分激动作用[54].研究表明,伐伦克林和野靛碱对α4β2*亚型的nAChR无选择作用,由于结构相似,因此可以认为Dianicline对α4β2*亚型同样不具备选择性.在药物鉴别研究中,SSR-591813代替了尼古丁,当两种药物的剂量相同时,Dianicline降低了反应的速度[54].临床实验中,该化合物戒烟成功率是16%,而随机双盲安慰剂对照试验为8%[55].但是2008年2月,当该化合物处于临床三期研究时,赛诺菲安万特公司宣布停止对其研发[56-57].
2.2.4 ABT-418&ABT-089

图2-5 ABT-418 & ABT-089
ABT-418是Abbott公司开发的神经型α4β2 nAChR全激动剂,它对α4β2和α2β2 nAChR有高亲和性,EC50分别为6 μM和11 μM,而对α3β4 nAChR的亲和性很低,EC50为188 μM[58].ABT-418用作治疗尼古丁成瘾,在临床2期停止对其研究[59].它对动物模型有增强认知和抗焦虑作用,也用于治疗帕金森病(临床一期停止)[40,60].ABT-089由Abbott公司开发的神经型α4β2 nAChR部分激动剂,有较好的亚型选择性,主要结合到α4β2和α6β2 nAChR.它可以通过活化α6β2和α4β2 nAChR增加纹状体多巴胺的释放.它虽然可以阻止尼古丁寻求行为的恢复,但急性给药ABT-089却不能减少尼古丁的自我给药[61],作为戒烟药物的安全性和耐受性都很好,但是临床试验结果还未见报道[62,63].
2.3 nAChR拮抗剂
用作戒烟试剂的nAChR拮抗剂主要有:安非他酮(Bupropion)、bPiDDB、18-MC和美加明(Mecamylamine).
2.3.1 安非他酮(Bupropion)

图2-6 安非他酮
1997年,安非他酮在获美国FDA批准成为一类有效的戒烟药物并且表现出很好的耐受性.它是α3β4 nAChR非竞争性拮抗剂,IC50为1.8 μM,对α4β2和α7nAChR拮抗的IC50值分别是12 μM和7.9 μM[64].安非他酮不但抑制[3H]-DA被吸收到纹状体突触体,其IC50为2 μM,而且还能抑制DA被吸收到下丘脑突触体,其IC50为5 μM[65].增加细胞外DA和去甲肾上腺素的浓度可能会取代由于抽烟引起的尼古丁诱导的神经递质的释放.安非他酮能特异性抑制nAChR介导的尼古丁引起的[3H]-DA和[3H]-去甲肾上腺素的释放,其IC50分别为1.3和0.32 μM[66].安非他酮诱导的戒烟可能源于2种机制:nAChR拮抗机制和DA/去甲肾上腺素抑制机制.因此,该药物主要通过抑制去甲肾上腺素和多巴胺对神经的激活和强化作用来减少对烟草的渴望和患者的戒断症状,但是服用后会产生湿疹、荨麻疹、血管神经性水肿等不良反应[67].
2.3.2 bPiDDB与r-bPiDDB
化合物bPiDDB是选择性的α6β2 nAChR高效拮抗剂,能特异性的抑制尼古丁诱发的[3H]-DA的释放(IC50=2 nM,Imax=64%),Schild分析表明bPiDDB以受体上内源性配体结合的方式作用在nAChR上介导烟碱诱发的[3H]-DA的释放[68].bPiDDB能通过血脑屏障胆碱转移器进入到大脑,但是口服给药后,bPiDDB在血浆中的浓度很低,并且生物利用度低.为了提高该化合物的成药性,将亲脂性的脂肪环取代吡啶环得到化合物r-bPiDDB.r-bPiDDB不但能有效的降低尼古丁的自身给药,而且口服给药时还表现出很好的生物利用度,并且能有效的抑制[3H]-DA的释放(IC50=0.29 nM,Imax=74%),原因可能是r-bPiDDB的三级胺在生理pH下可以被质子化,然后在生理pH下提供阳离子更有利于与nAChR的结合位点的相互作用.

图2-7 bPiDDB & r-bPiDDB
2.3.3 18-甲氧基狗牙花定(18-MC)

图2-8 18-MC
18-MC是选择性的α3β4 nAChR拮抗剂,在[3H]-地棘蛙素与人类α3β4 nAChR的结合实验中,IC50为0.79 μM,对α4β2 nAChR没有结合性[69].在动物研究中,它可以有效地减少尼古丁、吗啡、可卡因和脱氧麻黄碱等成瘾药物的自我给药和许多滥用药物的条件位置偏爱[70-71].另外,18-MC可以阻止暗示诱发的成瘾行为的强化效应,表明它不仅可以阻止成瘾,而且可以阻止成瘾的复发性[72].Savant HWP公司在2013年1月份宣布该化合物在2014年作为抗成瘾药物在美国进入临床实验,2016年临床实验发现急性口服给药18-MC可以减少尼古丁和酒精的自我给药[73].
2.3.4 美加明(Mecamylamine)
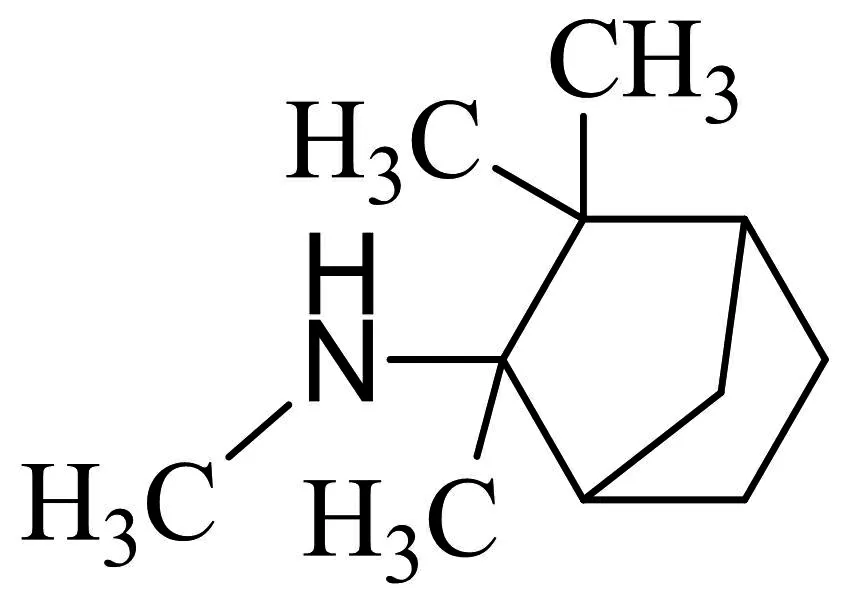
图2-9 美加明
美加明是一类离子通道阻滞剂和α3β4 nAChR的非竞争性的拮抗剂,在通道气孔内与nAChR结合,激动剂的存在加强该化合物进入到位于受体通道孔的结合位点,阻止离子通道的功能.美加明对α3β4 nAChR的结合活性相对较好,IC50为0.6 μM.它与α4β2和α7 nAChR结合的IC50分别为2.5 μM和6.9 μM,但是选择性较差.美加明能特异性的调节尼古丁诱导的DA的释放,以剂量依赖的方式降低尼古丁自身给药[74,75].一些临床研究将该化合物作为nAChR拮抗剂用于治疗尼古丁成瘾[76],但是由于对nAChR亚型缺乏选择性,并且有抗胆碱能的副作用(如便秘,低血压),该化合物的临床应用被受限制[77].
2.3.5 UCI-30002

图2-10 UCI-30002
UCI-30002是另一种新型拮抗剂,为非选择性的nAChR负变构调节剂,以浓度依赖性的抑制神经型α4β2、α7和α3β4nAChR,其IC50分别为1.3 μM,2.0 μM,4.5 μM,并且在α7和α3β4nAChR是全抑制,但是在α4β2nAChR是部分抑制(80%),对肌肉型nAChR没有抑制作用[78-79].UCI-300002可以抑制高剂量尼古丁引起的癫痫发作[80].更重要的是,UCI-300002可以减少尼古丁的自身给药[78],表明该化合物能降低尼古丁的奖赏效应.此外,UCI-30002没有改变食物维持反应,表明它能特定的减少尼古丁的反应[80].该化合物表现出较好的药代动力学性质,容易通过血脑屏障,血浆中半衰期是3h.因此,该化合物可能作为一个潜在的戒烟试剂.
3 结论
尽管近年来靶向nAChR戒烟药物的研究已经取得较大的进展,个别药物疗效显著,但是目前靶向nAChR戒烟药物在治疗烟碱依赖的过程中仍存在一定的问题,如戒烟成功率较低、复吸率高、给药后产生治疗相关的毒副作用等.因此,开发安全有效的靶向nAChR的戒烟药物仍然需要进一步的研究.

