高选择性肾动脉分支阻断与全阻断下腹腔镜保留肾单位手术疗效及肾功能对比
潘秀敏,张金立2,闫红丽,李梦琳,郭敬如
(1.河北大学附属医院泌尿外科,河北 保定 071000;2.保定市第一中心医院麻醉科,河北 保定 071000)
随着腹腔镜技术进步,腹腔镜下保留肾单位手术(laparoscopic nephron sparing surger, LNSS)越来越多应用于临床,LNSS患者肿瘤特异性存活率与根治性切除比较无明显差异,远期死亡风险明显较低[1-2],成为T1期肾肿瘤的首选手术方法[3]。LNSS术后肾功能受基础肾功能、肾单位保留数量及热缺血时间(warm ischemia time, WIT)影响,而WIT在其中起关键作用[4]。肾动脉阻断方式主要包括肾动脉主干全阻断(main renal artery clamping, MRAC)、节段性肾动脉阻断、“零”血管阻断、选择性肾动脉阻断[5-6]。传统保留肾单位手术,多采用MRAC,达到减少术中出血,改善手术视野的目的,利于肿瘤切除及肾脏修复。但该技术会导致肾热缺血并对肾功能产生不良影响[7]。随着腹腔镜技术普及与发展,高选择性肾动脉阻断术(selective segmental renal artery clamping, SSRAC)辅助保肾手术越来越多应用于LNSS,它不仅可以获得肿瘤供应血管阻断效果[8],还能有效减少患者肾脏WIT,降低肾脏损伤风险[9-10]。本研究采用SSRAC下腹腔镜保留肾单位手术治疗T1期局限性肾肿瘤患者,评估其疗效及围术期肾功能变化。
1 资料与方法
1.1 一般资料
回顾性分析2017年10月至2018年10月收治的T1期局限性肾肿瘤患者84例,其中行SSRAC下LNSS 42例(S组),行MRAC下LNSS 42例(M组)。入组标准:(1)术前肾脏CT血管成像(CT angiography, CTA)显示肿瘤血供肾脏二级或三级血管;(2)T1期肿瘤,肿瘤直径≤4 cm(根据美国癌症联合委员会TNM分期);(3)R.E.N.A.L 评分为4~7分;(4)术前血清肌酐值正常;术后病理证实为肾肿瘤。排除标准:(1)孤立肾;(2)伴有严重心脑血管病变、糖尿病;(3)严重肝、肺、凝血、免疫功能异常;(4)合并其他部位恶性肿瘤或区域淋巴结转移、远处转移。2组患者一般临床资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
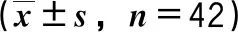
表1 患者临床资料统计
1.2 手术方法
1.2.1 S组手术方法
患者全麻成功,行健侧卧位,腰部抬高。于腰区(患侧)取4孔入路,扩张后腹腔操作空间,形成CO2气腹,压力维持1.60~2.22 kPa。确定腰大肌位置,纵行切开后腹膜,有效分离腹膜及Gerota筋膜外脂肪组织,剪开Gerota筋膜及肾脂肪囊,用超声刀分离肾门周围脂肪,显露肾门部血管。参照肾血管造影结果,检查肾动脉及其分支位置有无变异。分离肾脏肿瘤,明确肿瘤范围及主要血供,游离肾段动脉,用无损伤止血夹夹闭供应肿瘤的肾段动脉,达到全阻断肿瘤动脉血供,计时。切除肿瘤,止血、缝合切缘。开放夹闭的肾段动脉,计时。加强缝合,手术结束。
1.2.2 M组手术方法
建立通道后,打开Gerota筋膜,游离肾脏,显露肾动脉,钳夹肾动脉,阻断血流并开始计时,切除肿瘤,修复创面,去除肾蒂钳恢复血流,肾动脉阻断计时结束,取出肿瘤,关闭切口。
1.3 监测指标
(1)监测组间患者围术期情况:时间、出血量、WIT、术后引流时间、术后住院时间、切缘阳性率。(2)于术前和术后1 d、术后1个月检测SCr、BUN值。(3)记录术中、术后并发症(出血、尿漏、肺部感染、切口感染、肾周感染、)发生率。
1.4 统计学方法
2 结果
2.1 围手术期指标
所有手术顺利完成,均无手术切缘阳性,无术中中转为MRAC。S组手术时间、术中失血量较M组增加,差异有统计学意义(P<0.05),2组术中WIT、术后引流量、术后住院时间差异无统计学意义(P>0.05),见表2。
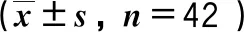
表2 不同组患者围手术期指标比较
2.2 肾功能
2组术前SCr、BUN水平差异无统计学意义(P>0.05),术后1 d SCr、BUN水平较术前显著升高,S组术后1 d SCr、BUN显著低于M组,差异有统计学意义(P<0.05),2组术后1个月SCr、BUN水平比较差异无统计学意义(P>0.05),见表3。
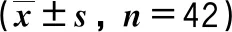
表3 不同组患者围手术期肾功能比较
2.3 并发症
2组患者术中术后并发症发生率差异无统计学意义(P>0.05),见表4。

表4 不同组患者并发症统计(n=42)
3 讨论
肾动脉阻断是保肾手术中为减少肾实质出血常采取的手术方法,由此不可避免会造成肾热缺血损伤[11-12]。热缺血损伤实质是缺血再灌注损伤,术中长时间热缺血损伤会一定程度影响术后肾功能恢复[13-14]。目前,术中阻断肿瘤供应肾段动脉,减少其所支配肾段血供后再行LNSS具有较大临床优越性。不会对肿瘤以外其他正常肾组织血供造成影响,又可减少术中出血。术中肾脏WIT是影响保肾手术术后肾脏功能的独立因素[15]。因此,在保证切缘阴性前提下,如何缩短WIT及再灌注损伤,保留更多有功能的肾单位,是LNSS的关键步骤[16]。LNSS术中操作局限在肾脏肿瘤,无需涉及全肾脏,这些特性使SSRAC替代MRAC成为可能。2011年Gill等[17]首次报道阻断肾脏肿瘤相关肾动脉分支性肾部分切除术,取得较好效果。同年,Shao等[18]报道了应用肾段动脉阻断技术行保留肾单位术,并提出了肾段动脉阻断技术的概念。一定程度减少了术中肾脏热缺血损伤。SSRAC及MRAC 2种技术在腹腔镜下经后腹腔入路肾部分切除术中的应用尚存在争议,本研究对84例T1期局限性肾肿瘤患者分别行SSRAC及MRAC下的腹腔镜肾部分切除手术,比较其临床效果及优缺点。
研究发现,S组手术时间较M组明显延长,术中出血量少量增多,这可能与M组术中需要结合术前 CTA结果判断供应肿瘤的分支血管,并进一步游离肾动脉阻断肾动脉分支有关。同时本研究还发现,S组术中WIT、术后引流量、术后住院时间、术中术后并发症等指标较M组并未增加,且SSRAC对患者肾脏功能影响较小。究其原因在于,S组仅阻断肿瘤供血动脉,其他肾实质尚余血供,可减少正常肾组织缺血损伤,并且SSRAC手术时限较宽,使术者能从容准确切除肿瘤,降低切缘阳性率,使手术切缘更薄,保留更多的正常肾单位,细致地缝合创面,一定程度上保证了手术效果,减少术中术后并发症,降低对肾脏功能影响。国外报道,与MRAC相比,SSRAC术后患者肾小球滤过率下降幅度明显减少[19-20]。与本结果相似。随术后时间延长,保留肾单位手术患者肾脏功能逐渐恢复正常,2组之间SCr、BUN差异无统计学意义。
综上所述,SSRAC技术虽会轻度延长手术时间及增加术中出血,但成功避免了肾热缺血,获得优于MRAC术后早期肾功能恢复。虽然SSRAC阻断肿瘤相关肾动脉分支,可减少其余肾组织的缺血损伤,但目前SSRAC尚不能完全实现零缺血,因此,应尽量提升术者技术水平,SSRAC将在保肾手术中具有更广阔前景。

