妥珠单抗和间充质干细胞治疗5例新型冠状病毒肺炎重症患者临床分析
李 鹏,殷 刚,王 瑞,郭海平
(1.中国人民解放军第985医院,山西 太原 030001;2.郑州联勤保障中心卫勤处,河南 郑州 450000;3.武汉泰康同济医院,湖北 武汉 430050)
新型冠状病毒肺炎(COVID-19)已在全世界引起大流行,目前境外输入病例已成为我国主要病例来源。该型病毒传染性极强、传播途径多样且人群易感、潜伏期较长均为其特点[1]。有研究发现ACE2是COVID-19的细胞受体,新冠肺炎患者血浆中血管紧张素Ⅱ显著升高[2,3]。肺脏、肝脏、肾脏等组织器官广泛分布ACE2,重症患者由于肺部免疫细胞过度活化,产生大量炎症因子,形成细胞因子风暴,发生急性肺损伤至严重急性呼吸窘迫综合征和多脏器功能衰竭。研究发现,重症病例还存在明显的免疫抑制,CD04+T 细胞、CD8+T 细胞、自然杀伤细胞水平低于轻症患者[4]。目前已有多种方法用于重症病例的治疗,包括妥珠单抗和间充质干细胞的临床应用,但尚缺乏有效证据。本文通过回顾性分析军队支援武汉泰康同济医院感染病区使用托珠单抗和干细胞治疗重症患者临床资料,为新冠肺炎重症患者的治疗提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2020年2月19日~4月3日在武汉泰康同济医院接受治疗的5例新冠肺炎重症患者的临床资料。COVID-19患者诊断和临床分型参照《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[5]。所有患者病程中核酸检测至少一次阳性。临床表现包括发热、咳嗽、咳痰、气喘、头晕、出汗等症状。入院时,未吸氧状态下指脉氧饱和度均低于95%,血气分析计算氧合指数示呼吸功能障碍。5例患者均为男性,年龄47~74岁;2例妥珠单抗治疗患者合并糖尿病、冠心病等基础疾病,既往基础病药物治疗;3例干细胞治疗患者无基础病;5例患者中,1例身份为在职公务员,4例退休人员。
1.2 方法
1.2.1 基础治疗 入院后依据新冠肺炎诊疗方案给与基础治疗。持续氧疗:鼻导管吸氧2~5 L/min;抗病毒治疗:阿比多尔 0.2 g tid、血必净 100 mL bid;中药治疗:莲花清瘟 1.4 g tid、清肺排毒汤 bid;扩张支气管、化痰治疗:哆嗦茶碱 0.3 g qd、盐酸氨溴索 30 m gqd;糖尿病、冠心病等基础药物治疗。
1.2.2 妥珠单抗治疗 确诊新型冠状病毒肺炎普通型(含重症高危因素)、重型患者,IL-6升高>14 pg/mL,年龄18~85周岁,无明确使用说明禁忌。签署知情同意后,单次给予妥珠单抗400 mg于0.9%氯化钠溶液稀释至100 mL,避光静脉滴注1 h以上。
1.2.3 间充质干细胞治疗 确诊新型冠状病毒肺炎重型、危重型患者,胸部CT双肺广泛弥漫性炎症病变。签署UC-MSCc辅助治疗重症新冠肺炎患者知情同意后,由上海东方医院(同济大学附属东方医院)专业人员具体操作。于第1天、第5天、第10天分别给与输注间充质干细胞100 mL。
1.3 观察指标
入科后即刻在未吸氧状态下行指脉氧饱和度监测,出于对患者生命和病情的负责态度,入病房后随即给与吸氧治疗。于第二日清晨空腹采集血常规、凝血、D-二聚体、生化全套、C反应蛋白、IL-6、降钙素原等,并根据病情变化即时行血气检查。于干细胞治疗后3 d、7 d、14 d后复检上述指标;于妥珠单抗治疗后第(7±2 d)、第(14±2 d)及出院前复检上述指标。
2 结果
2.1 妥珠单抗治疗有助于降低炎症反应,临床症状改善明显
两例患者基础治疗同时,给与妥珠单抗治疗。治疗后患者临床症状改善明显,活动耐量正常,晨起偶有干咳,发热、咳痰、气喘等症状消失;指脉血氧饱和度、氧合指数显著明显升高;D-二聚体、C反应蛋白明显下降;淋巴细胞计数、肝肾功能指标恢复正常;血气乳酸下降缓慢;见表1。结果提示,妥珠单抗可减轻新冠肺炎重症患者炎症反应,早期应用有助于临床症状改善。
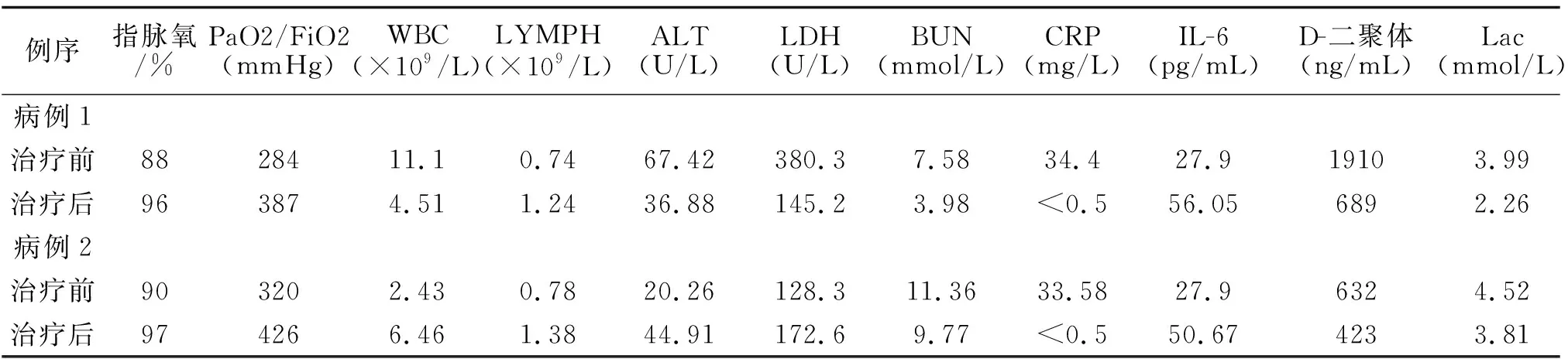
表1 使用托珠单抗治疗2例COVID-19重症患者治疗前后实验室检查结果对照
2.2 间充质干细胞治疗有助于部分炎症治疗下降,临床症状改善一般
3例患者基础治疗同时,给与间充质干细胞治疗。治疗前3例患者均存在不同程度低氧血症,D-二聚体、C反应蛋白指标较高,淋巴细胞计数偏低;治疗后低氧血症得到一定程度纠正,氧合指数回升;C反应蛋白等炎症指标恢复正常。与妥珠单抗治疗后类似,均存在血气乳酸恢复缓慢的情况,见表2。3例干细胞治疗中,1例治疗后患者临床症状明显改善,活动耐力恢复正常,胸部CT较前对比吸收明显,达到临床治愈出院标准;另2例治疗后临床症状改善一般,仍存在明显的轻微活动后即气喘等临床症状,胸部CT未见吸收,干细胞治疗效果差。
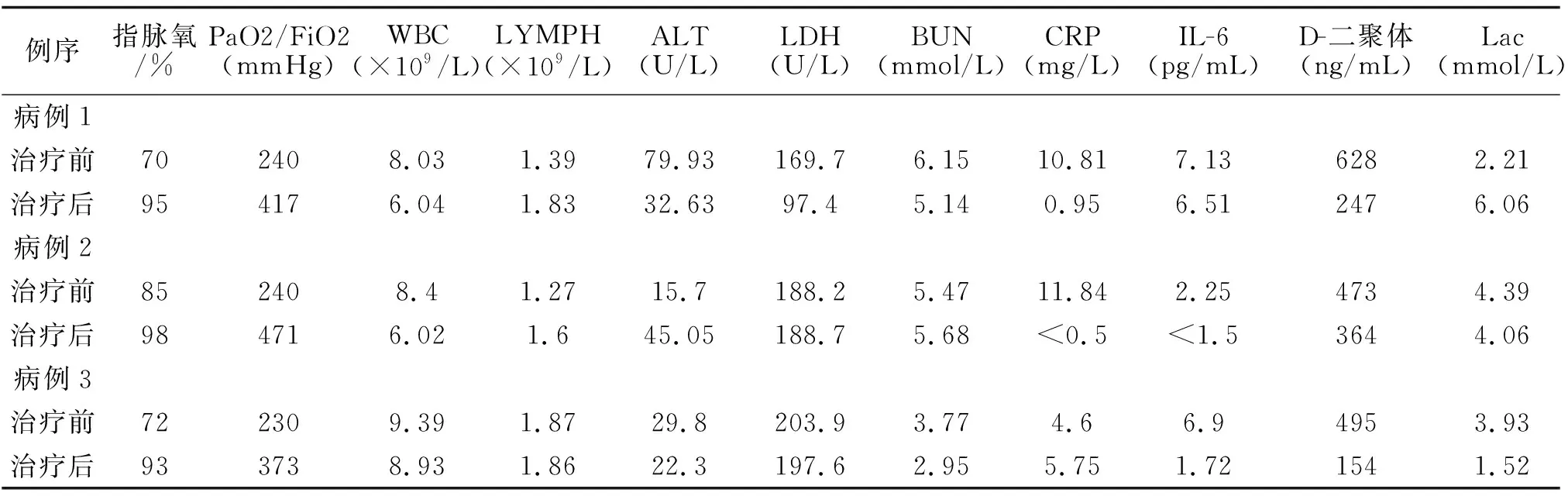
表2 使用干细胞治疗3例COVID-19重症患者治疗前后实验室检查结果对照
3 讨论
新型冠状病毒肺炎重症病例(包括重型、危重型)存在低氧、咳嗽、呼吸困难及轻微活动后气喘等典型的呼吸道症状,可发生急性呼吸窘迫综合征(ARDS)和多器官功能衰竭(MOF),甚至死亡。多项研究显示引发重症感染的因素很多,细胞因子风暴又称“炎症风暴”是机制之一,肺组织通过气道与外界直接相通,新冠病毒刺突蛋白通过识别肺组织血管紧张素转换酶2感染机体后,开始繁殖复制[6],从而迅速激活CD4+细胞,使之增殖分化为Th1细胞并分泌 IL-6、γ干扰素和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等一系列促炎性细胞因子。其中,GM-CSF又可激活单核细胞进一步释放IL-6和其他因子,因此IL-6和GM-CSF可能诱发炎症风暴导致新冠重症患者出现ARDS、MOF等[7]。同时免疫抑制也是导致新冠肺炎重症患者的重要机制,冠状病毒感染T淋巴细胞更容易受到抑制,外周血CD4和CD8细胞数量显著减少,并过度激活,表现为高刺激性CCR4+CC64+Th17细胞增加和CD8细胞的高细胞毒性,提示了新冠重症患者存在严重的免疫系统受损。针对新冠肺炎重症患者出现的炎症风暴和免疫抑制,许多药物探索性的应用于临床,包括妥珠单抗、间充质干细胞及康复期血浆等。
妥珠单抗是一种重组人源的IL-6单克隆抗体,通过抑制IL-6与溶解型和膜结合型IL-6受体的结合,从而阻断IL-6信号传导,主要用于治疗自身免疫性疾病[8]。本案中2例妥珠单抗治疗的患者,临床症状改善效果明显,指脉氧均可维持在95%以上,活动后气喘等呼吸道症状基本消失;淋巴细胞计数明显回升,C反应蛋白、D-二聚体显著下降,表明妥珠单抗可能对新冠肺炎重症患者炎症状态改善和免疫机能恢复具有一定效果;而IL-6水平对比入院初部分升高,但在监测中,2例患者IL-6均曾升高至80~100 pg/mL,而后IL-6水平呈下降趋势,说明妥珠单抗仍有较好的阻断IL-6效果,限于重症病例病程持续进展,我们判断妥珠单抗在此2例重症患者中应用较早,因此临床效果显著。
干细胞应用于ARDS已多有研究[9],但尚缺乏有效临床资料。间充质干细胞(MSCs)来源于间质、具有自我更新能力和强大的分化潜能,通过趋化作用,归巢于肺组织,分化为肺泡上皮细胞、肺血管内皮细胞,通过其旁分泌血管生成素,促进肺泡上皮细胞再生和修复[10],同时具有免疫调节作用,减轻炎症对肺组织损伤,增强免疫细胞的增殖能力和改善免疫功能[11],同时产生多种细胞因子修复肺损伤[12]。本案使用干细胞治疗患者,从临床表现和一般状态评估,1例取得良好临床效果,活动耐量基本正常,2例临床症状未见明显改善。3例患者的低氧血症均得到一定程度纠正,C反应蛋白、D-二聚体下降明显,淋巴细胞回升,提示干细胞在新冠重症患者应用具有部分临床疗效,可减轻患者炎症反应和增强免疫功能,但个体区别临床获益差异较大,极有可能与病程进展阶段相关。新冠患者普遍存在病程长达1~2月,甚至更长,这在重症病例中体现明显,疾病进展后期,双肺弥漫性磨玻璃及实变影,两肺密度大幅度增加,呈“白肺”改变,肺功能已受损严重[13]。病情恢复会极其漫长,且治疗效果较差。
综上所述,新冠肺炎患者需密切监测血氧、血常规、C反应蛋白、IL-6等指标,及时发现重症因素,提早干预;发现IL-6升高,指脉氧及氧合指数进行性下降,“白肺”未形成时,可应用妥珠单抗、间充质干细胞等多种治疗手段,避免肺功能出现不可逆的严重损伤;疾病进展晚期,干细胞治疗效果不佳,也可能与样本量太小有关,还需进一步积累多中心大样本资料进行分析。

