钝叶柃花器官性别分化的形态学研究*
顾 梨 何 平,2 邓洪平,2 倪东萍 王 茜 程莅登 巴罗菊
(1.西南大学生命科学学院 三峡库区生态环境教育部重点实验室 重庆 400715;2.重庆市科学技术研究院 重庆 400715)
钝叶柃(Euryaobtusifolia)为山茶科(Theaceae)柃木属(Eurya)常绿灌木或小乔木,我国主要分布于陕西、湖北、湖南、贵州、四川及云南等省的海拔400~1 450 m的山地疏林、密林以及林缘路旁灌丛中。柃木属植物是热带和亚热带常绿阔叶林灌木层优势种之一(马德风等,1993),其物种的稳定对维持森林生态系统有重要的作用。传统认为柃木属植物是严格的雌雄异株,但在重庆缙云山发现钝叶柃中存在雌株、雄株以及Leaky个体等类型,Leaky个体指典型的两性变异株在性别表达上偏离于正常雌株及雄株:有的具有两性功能;有的仅具雌性功能,但具不同程度退化的雄蕊;有的仅具雄性功能,但不育雌蕊发育明显(王茜等,2012;李运婷,2016;李运婷等,2016)。这一现象在自然种群中发生的频率不高,随着野外工作的深入,相关的报道越来越多,柿科(Ebenaceae)(Venkatasamyetal.,2007)、茄科(Solanaceae)(Martineetal.,2014;Andersonetal.,2015)等10余科中均发现了这一现象,但目前对出现这一现象的原因尚不清楚。
植物性别分化是雌蕊和雄蕊的发生及分化的过程,具体包括雌、雄性别的决定和配子体的分化、发育与成熟等阶段。对于雌雄异株和雌雄同株植物来说,性别分化是原始两性花原基的雄性或雌性选择性败育及相应的雄蕊或雌蕊中配子体发生分化的结果(张大勇,2004)。目前对钝叶柃出现Leaky现象的研究仅在生理生化、传粉、群落特征等方面(王茜等,2012;李运婷,2016;李运婷等,2016),对其花芽分化及花器官发育过程的形态学研究仍然缺乏。因此,本文采用常规石蜡切片法对钝叶柃3种典型雌株、雄株、两性变异株不同分化时期的花芽形态和结构进行观察,探讨3种不同性别花器官发育过程的异同,明确性别分化的关键时期,为探讨性别分化的相关机制及植物类群之间的系统进化关系提供重要的形态学证据。
1 材料与方法
1.1 试验材料 试验材料采自重庆缙云山国家级自然保护区金果园(106°17′—106°24′E,29°41′—29°52′N),该区属中亚热带季风湿润性气候,平均气温3.1 ℃。区域内以常绿阔叶林、针阔混交林等植被类型为主,灌木层主要优势种为柃木属植物。2016年2月,盛花期时选取长势健壮且一致的钝叶柃典型雌株、雄株、两性变异株各12株,平均树高2.5 m,胸围6.4 cm,冠幅3.4 m2,进行挂牌标识。
1.2 试验方法 2016年7月—2018年3月,随机选取典型雌株、雄株、两性变异株各12株,每株当年生新枝上形成的顶梢下第3-5芽位,采集结构完整、无病虫害的花芽共30个,每3天1次。选择其中的8~10个形态大小一致的花芽,用MODEL C-BD230解剖镜测量花芽的长度、宽度,同时拍照记录外部形态特征;剩余花芽根据其大小分别采用FAA固定液(甲醛∶冰醋酸∶70%酒精=5∶5∶90,体积比)固定,存于4 ℃冰箱。
固定24 h,取出固定后的花芽,针对钝叶柃花芽包裹紧实、难以浸蜡的特点,对常规石蜡切片法(李桂琴,2002)加以改进:材料脱水之前用质量分数20%的盐酸软化24 h,流水冲洗1~2天后制作石蜡切片,切片厚度8~10 μm;采用苏木精-铁矾、番红-固绿对染,加拿大中性树胶封片,制成永久切片。用NIKON ECLIPSE 型显微镜观察花芽纵切面及横切面的解剖结构并拍摄照片,记录花芽分化过程中解剖结构的变化特征。到花芽开放时,5%~25%花朵开放确定为始花期;25%~75%花朵开放确定为盛花期;75%以上的花朵开放确定为末花期。
记录的数据采用Microsoft Office Excel 2016和SPSS 20.0进行统计分析。
2 结果与分析
2.1 钝叶柃成花物候期及花芽解剖结构特征1) 成花物候期 对钝叶柃成花物候进行观测(图1),7月底至8月上旬,3种不同性别钝叶柃植株的当年生新枝及2年生枝叶腋内出现1~4个芽;8月下旬,苞片原基开始分化与发育,花原基出现,进入花芽分化阶段;8月底至11月上旬,花芽的各轮花器官相继分化、发育;12月中下旬至1月底,气温急剧下降,花芽进入休眠时期,此时雌雄蕊已分化发育完全;次年2月初,气温持续回升10~15天,进入始花期。雄株的始花期早于雌株花期3~4天,两性变异株始花期晚于雌花11~14天,盛花期一般在始花期后的5~12天出现,维持7~10天,步入终花期,终花期维持5天左右。以花器官原基出现的时间以及花芽外部形态特征为划分标准(王彩云等,2002),将花芽分化期分为苞片分化期(stage of bract differentiation,SBD)、萼片分化期(stage of sepal differentiation,SSD)、花瓣分化期(stage of petal differentiation,SPD)、雌雄蕊分化期(stage of stamen and pistil differentiation,SSPD)、雌雄蕊成熟期(stage of stamen and pistil formation,SSPF)5个时期。
钝叶柃3种不同性别花芽在分化初期形态变化及内部结构保持一致,仅发育的时间有所差异,雌花芽发育滞后雄花芽8~10天,两性变异花芽滞后雌花芽15~20天。

图1 不同性别钝叶柃开花物候期Fig.1 Blossoming phenophase among different sexes of E.obtusifoliaSBD:苞片分化期;SSD:萼片分化期;SPD:花瓣分化期;SSPD:雌雄蕊分化期;SSPF:雌雄蕊成熟期;FP:始花期;FS:盛花期;TF:终花期。SBD:Stage of bract differentiation;SSD:Stage of sepal differentiation;SPD:Stage of petal differentiation;SSPD:Stage of stamen and pistil differentiation;SSPF:Stage of stamen and pistil formation;FP:Flowering period;FS:Full-blooming stage;TF:The final flowering.
2) 苞片分化期(SBD) 8月中旬至9月初左右,叶腋2枚小苞片原基包裹着芽尖,此时植株由营养生长转为生殖生长,小苞片原基逐渐发育呈片状结构,同时在中间位置分化出半球形的凸起(花原基)(图2A、B、C)。
3) 萼片分化期(SSD) 9月初到9月中下旬,进入萼片原基分化期,2枚小苞片中间的花原基分化形成萼片原基,外层细胞分裂速度较快,萼片原基呈“钩”状,接着中间突起生长点细胞继续侧向分裂,伸长并向内弯曲,最终形成片状弧形,在纵切面上仅见2个萼片原基(图2D、E、F)。
4) 花瓣分化期(SPD) 9月中旬到10月初,在萼片原基分化的同时,中央的生长锥细胞继续分裂形成花瓣原基,花芽进入花瓣分化期,15~17天。花瓣原基与萼片原基分裂的方式相似,生长锥细胞先进行横向分裂,中央位置微凹,后进行侧向分裂,伸长并向内弯曲,呈片状弧形(图2G、H、I)。
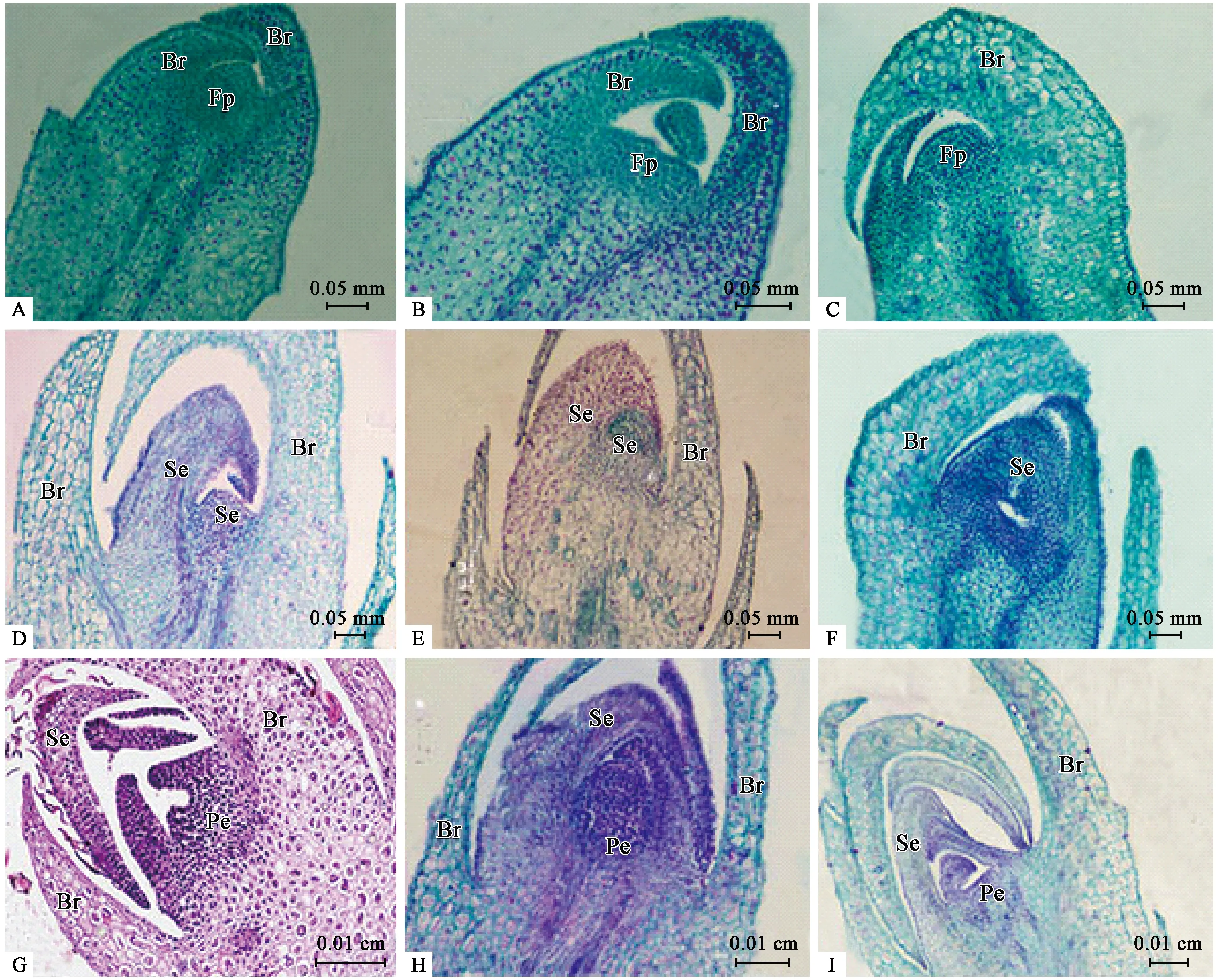
图2 钝叶柃花芽分化中苞片、萼片及花瓣分化时期石蜡切片Fig.2 Section observation of the development of bracts,sepals and petal during the flowering stages of E.obtusifolia.A,B,C:分别为雌花芽、雄花芽和两性变异花芽的苞片分化期;D,E,F:分别为雌花芽、雄花芽和两性变异花芽的萼片分化期;G,H,I:分别为雌花芽、雄花芽和两性变异花芽的花瓣分化期。Fp:花原基;Br:苞片;Se:萼片原基及萼片;Pe:花瓣原基。A,B,C:Stage of bract differentiation in female,male and bisexual flower buds,respectively;D,E,F:Stage of Sepal differentiation in female,male and bisexual flower buds,respectively;G,H,I:Stage of petal differentiation in female,male and bisexual flower buds,respectively.Fp:Flower primordium;Br:Bracts;Se:Sepal primordia and sepals;Pe:Petal primordia.
5) 雌雄蕊分化期(SSPD) 雄花芽的雌雄蕊分化:9月底至10月初,萼片和花瓣原基分化的后期,花瓣内侧的生长锥持续分裂,中央位置出现雌蕊原基,两侧形成指状的雄蕊原基(图3B)。雄蕊原基和雌蕊原基同时分化,后期分化过程中,雌蕊原基停止分化形成半球形突起(图3E、H)。
雄花芽的花丝花药分化:10月初至10月上旬,萼片和花瓣继续伸长分裂,相互叠压,随后进入花药、花丝的分化,指状雄蕊原基上部膨大,下部纤细且短,呈“棒槌”状。膨大部分侧向生长旺盛,分化为花药,基部进一步伸长,分化为花丝(图3H、图4B)。
雌花芽的雌蕊分化:10月初至10月中下旬左右,花瓣原基分化末期,花芽中央染色较深部分为雌蕊原基,不产生雄蕊原基(图3A)。雌蕊原基不断分裂,切片可见产生2个心皮原基,心皮原基持续分裂,基部愈合形成大的突起(图3D、G)。
两性变异花芽的雌雄蕊分化:10月中旬至10月底,两性变异花芽开始进入雌雄蕊的分化期,与雄花芽的分化初期相似,同时出现雄蕊原基和雌蕊原基(图3C、F),雌雄蕊原基正常发育,雄蕊原基发育的速度较雌蕊原基慢,心皮原基远大于雄蕊原基(图3I)。
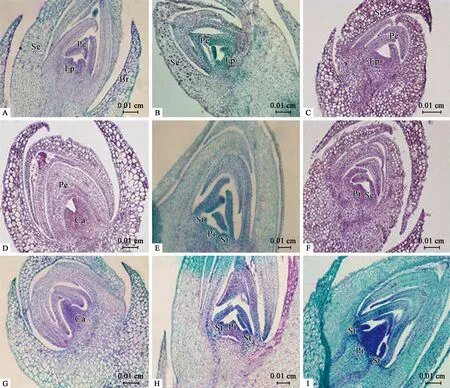
图3 钝叶柃花芽分化中雌雄蕊分化期石蜡切片Fig.3 Section observation of the stage of stamen and pistil differentiation during the flowering stages of E.obtusifoliaA:雌花芽中雌蕊原基的分化初期;B:雄花芽中雌雄蕊原基的分化初期;C:两性变异花芽中雌雄蕊原基的分化初期;D:雌花芽中心皮原基的分化;E:雄花芽中雌蕊、雄蕊原基同时分化;F:两性变异花芽中雌蕊、雄蕊原基的分化;G:雌花芽心皮原基愈合;H:雄花芽中心皮原基、花药、花丝的分化;I:两性变异花芽中雌、雄蕊原基的发育。Br:苞片;Se:萼片原基及萼片;Ep:花原基;Pe:花瓣原基;Pi:雌蕊原基;St:雄蕊原基;Ca:心皮原基。A:Initial differentiation of the pistil primordium in female flower buds;B:Initial differentiation of the primordium of pistil and stamen in male flower buds;C:Initial differentiation of the primordium of pistil and stamen in bisexual flower buds;D:Differentiation of the carpel primordium in female flower buds;E:Pistil and stamen primordia differentiate simultaneously in male flower buds;F:Differentiation of pistil and stamen primordia in bisexual flower buds;G:Basal union of carpel of female flower buds;H:Differentiation of carpels,anthers and filaments in male flower buds;I:Development of the primordium of pistil and stamen in bisexual flower buds.Br:Bracts;Se:Sepal primordia and sepals;Ep:Flower primordium;Pe:Petal primordia;Pi:Pistil primordium;St:Stamen primordium;Ca:Carpel primordium.
6) 雌雄蕊成熟期(SSPF) 10月中下旬至12月下旬,雌花芽中,心皮原基基部膨大,形成子房原基的小室,中部纵向凹陷形成空腔(图4A、D),顶部愈合向上分化成花柱;随后,子房基部内侧分化形成中轴胎座,胎座两侧分化出胚珠原基(图4E),最终形成倒生胚珠;花柱继续纵向伸长,顶端形成柱头,子房逐渐膨大呈囊状,胚珠逐渐成熟(图4F)。雄花芽中,花丝继续伸长,花药形成花粉囊(图4G、H)。在两性变异花芽中,雌雄蕊皆发育完全(图4C),也有少数花芽中雄蕊或雄蕊原基发育不正常(图4I)。

图4 钝叶柃花芽分化中雌雄蕊成熟期石蜡切片Fig.4 Section observation of the stage of stamen and pistil formation during the flowering stages of E.obtusifoliaA:雌花芽中子房的形成;B:雄花芽中雄蕊原基的分化后期;C:两性变异花芽中雌、雄蕊的发育;D,E:雌花芽中子房的发育;F:雌花芽中胚珠的发育;G,H:雄花芽花药、花丝发育;I:两性变异花芽中退化雌蕊。Pi:雌蕊原基;St:雄蕊原基;Ov:子房;Op:胚珠原基及胚珠;An:花药;Fi:花丝。A:Ovary formation in female flower buds;B:Anaphase of stamen primordium in male flower buds;C:Development of pistil and stamen in bisexual flower buds;D,E:Ovary development in female flower buds;F:Ovule development in female flower buds;G,H:The anther and filament development in male flower buds;I:Pistil degradation in bisexual flower buds.Pi:Pistil primordium;St:Stamen primordium;Ov:Ovary;Op:Ovules and ovule primordia;An:Anthers;Fi:Filaments.
2.2 花芽分化外观形态的变化特征 如图5所示,钝叶柃3种不同性别花芽在分化过程中,雌花芽、两性变异花芽的长宽比均呈先上升后下降的趋势,在雌雄蕊分化期(SSPD)分别达到最高1.27、1.36,此时花器官处于分化的最高峰,后期由于子房、花药不断膨大,长宽比有所下降。雄花芽在萼片分化期(SSD)前,花芽纵向生长较横向生长迅速,而随着雄蕊原基的不断发育,横向生长速度加快,长宽比逐渐下降,到雌雄蕊成熟期最低(1.09)。从整个分化时期看,两性变异花芽与雌花芽的长宽比动态变化相似,但两性变异花芽的长宽比始终高于雌花芽。
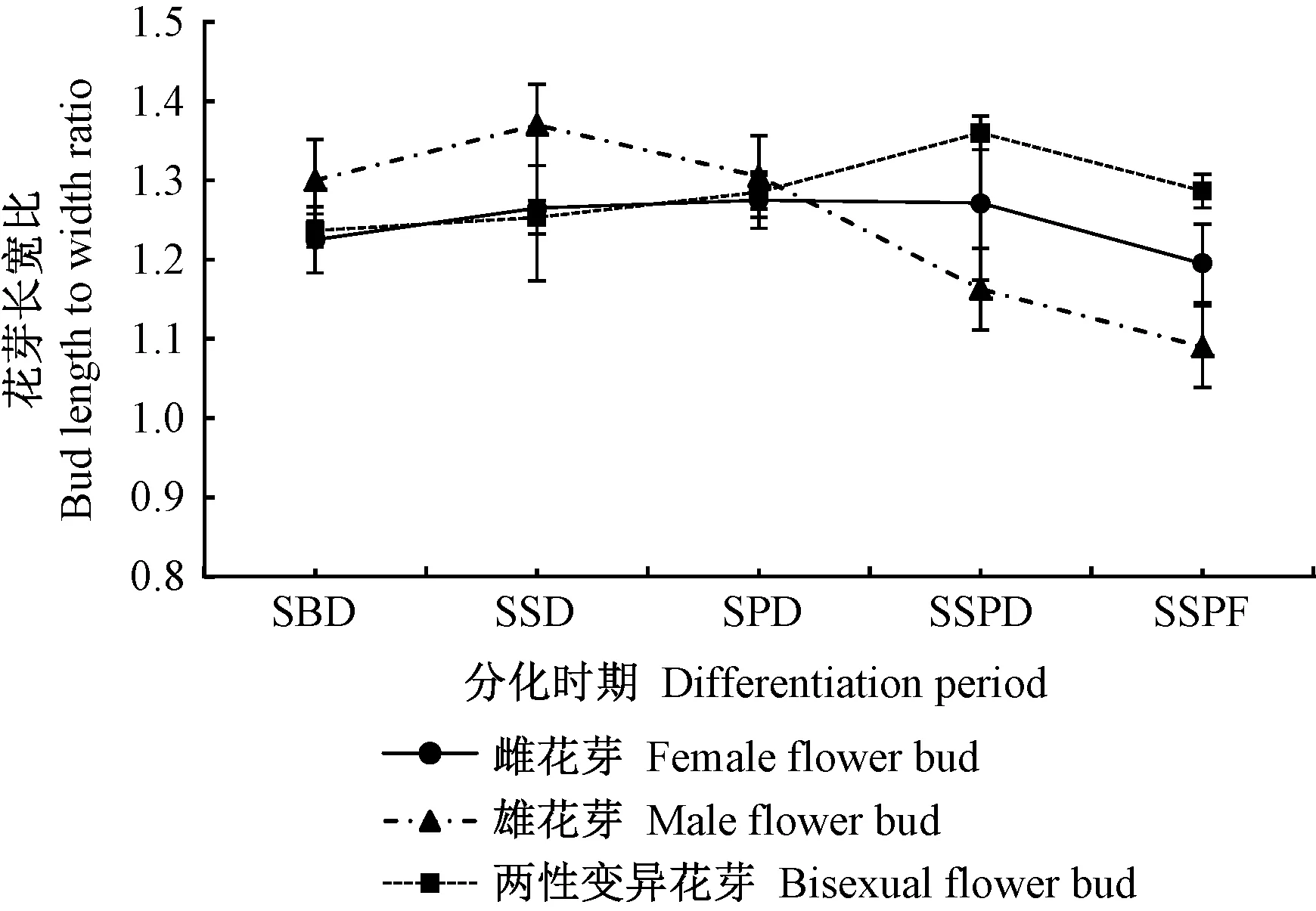
图5 钝叶柃花芽长宽比动态变化Fig.5 The flower bud length to width ratio of E.obtusifolia
钝叶柃花芽在分化过程中外部形态特征随着发育时期的不同会发生相应的改变,不同性别花芽之间也存在差异。在苞片分化期,下部宽胖顶端尖,呈三角形,扁平,绿色,表面有透明的柔毛,长0.645~0.745 mm、高0.470~0.572 mm(图6A、E、I),长宽比1.22~1.30;萼片分化期,体积膨大,呈椭圆形或近圆形,绿色褪尽,呈深紫红色,表面粗糙,白色柔毛增长,花芽长1.044~1.467 mm、宽0.874~1.035 mm(图6B、F、J);花瓣分化期,花芽圆胖,明显伸长、变宽,2枚小苞片紧包,呈绿色三角形,顶端深褐色,皆被透明长柔毛,长1.160~1.565 mm、宽0.891~1.125 mm(图6C、G、K)。3种不同性别花芽在前3个时期的外部形态和色泽方面的变化一致,但体积方面雄花芽>两性变异花芽>雌花芽。
雌雄蕊分化期,雄花芽顶端圆钝,迅速增大增长,表面绿色加深,紫红色逐渐褪去,长1.889~2.429 mm、宽1.671~2.106 mm,长宽比1.16(图6H,图7E)。雌花芽顶端渐尖,相对雄花芽较小,椭圆形,紫红色逐渐褪去,绿色加深,被白色长毛,花芽长1.577~1.645 mm、宽1.035~1.241 mm(图6D,图7 A)。两性变异花芽,与雌花芽相似(图6L,图7I)。
雌雄蕊成熟期,雄花芽变得更加圆润,长宽比降至1.09,雌花芽和两性变异花芽继续增长加宽,萼片、花瓣也逐渐发育完全,覆瓦状排列,花药由白色变为浅黄色,子房绿色逐渐加深。此时花芽外部紫红色完全褪尽,由嫩绿色逐渐变成黄绿色或棕绿色,2枚小苞片顶端出现深褐色,雌花芽、两性变异花芽5枚萼片大小相近,深紫红色,而雄花芽呈现绿色(图7B、F、J);5枚花瓣,白色,花药由无色透明转变成深黄色,子房翠绿色,花柱微带橘色(图7C、G、K)。
1月底至2月初,进入始花期,雌花芽花瓣反卷,柱头三裂,子房、花柱绿色透明(图7D);雄花雄蕊9~11枚,呈“灯笼”型(图7H);两性变异花芽,雄蕊群不定数,雌蕊中胚珠不定数(图7K、L)。
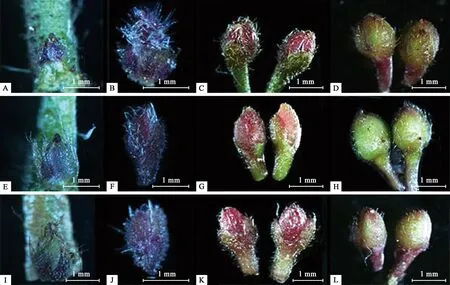
图6 钝叶柃花芽分化早期阶段的形态变化Fig.6 Morphological changes at early stage of flower bud differentiation of E.obtusifoliaA,B,C,D:分别为雌花芽的苞片分化期、萼片分化期、花瓣分化期、雌蕊分化初期;E,F,G,H.分别为雄花芽的苞片分化期、萼片分化期、花瓣分化期、雌雄蕊分化初期;I,J,K,L:分别为两性变异花芽的苞片分化期、萼片分化期、花瓣分化期、雌雄蕊分化初期。A,B,C,D:Stage of bract differentiation,sepal differentiation,petal differentiation and initial pistil differentiation in female flower buds,respectively;E,F,G,H:Stage of bract differentiation,sepal differentiation,petal differentiation and initial pistil and stamen differentiation in male flower buds,respectively;I,J,K,L:Stage of bract differentiation,sepal differentiation,petal differentiation and initial pistil and stamen differentiation in bisexual flower buds,respectively.

图7 钝叶柃花芽分化后期阶段的形态变化Fig.7 Morphological changes at late stage of flower bud differentiation of E.obtusifolia A:雌花芽雌蕊分化后期;B:3种不同性别花芽雌雄蕊成熟初期(由左至右:两性变异花芽、雌花芽、雄花芽);C:图J中雌花芽解剖图;D:雌花芽始花期;E:雄花芽雌雄蕊分化后期;F:3种不同性别花芽的雌雄蕊成熟中期(由左至右:两性变异花芽、雌花芽、雄花芽);G:图J中雄花芽解剖图;H:雄花芽始花期;I:两性变异花芽雌雄蕊分化后期;J:3种不同性别花芽雌雄蕊成熟后期(由左至右:两性变异花芽、雌花芽、雄花芽);K:图J中两性变异花芽解剖图;L:两性变异花芽始花期。A:Late pistil differentiation in female flower buds;B:Early maturation of pistil and stamen in flower buds(left-right:bisexual,female,male flower buds);C:Anatomy of female flower buds in Fig.J;D:Female flower buds in early blooming;E:Late pistil and stamen differentiation in male flower buds;F:Middle maturation of pistil and stamen in flower buds(left-right:bisexual,female,male flower buds);G:Anatomy of male flower buds in Fig.J;H:Male flower buds in early blooming;I:Late pistil and stamen differentiation in bisexual flower buds;J:Late maturation of pistil and stamen in flower buds(left-right:bisexual,female,male flower buds);K:Anatomy of bisexual flower buds in Fig.J;L:Bisexual flower buds in early blooming.
3 讨论
花芽分化是复杂的形态建成和生理生化过程,是有花植物发育的关键时期,也是植物体内外多重因子共同作用、相互协调的结果(郜爱玲等,2010;张波等,2017)。钝叶柃花芽分化划分为苞片分化期、萼片分化期、花瓣分化期、雌雄蕊分化期、雌雄蕊成熟期。不同研究者对同科同属近缘种花芽分化时期的划分不尽相同,此划分结果与王湘南等(2011)、朱雯等(2016)分别对油茶(Camelliaoleifera)和广宁红花油茶(Camelliasemiserrata)划分的花芽分化时期相类似,而与施雁飞等(2015)对茶(Camelliasinensis)的划分结果存在较大差异,前者与孙建云等(2005)的观点一致,将雌雄蕊成熟阶段纳入花芽形态分化的范围,认为花药、花丝的分化以及子房(胚珠、胚囊)、花柱、柱头的分化和发育是雌雄蕊原基继续分化的结果,是非常重要的阶段。
钝叶柃花芽形态分化始于8月,至12月中下旬基本完成5个阶段的分化,其中雌雄蕊成熟期历时相对较长,达35~40天。发育完成后,花芽仍处于休眠状态,到次年的2—3月进入始花期,而在同属细枝柃(Euryaloquaiana)中并未出现这一现象(巴罗菊,2017);花芽进入始花期的早晚可能与开花前一段时间内的平均气温、日照长短密切相关,杨康明等(1989)也表明影响杭州桂花(Osmanthusfragrans)开花的主要气象因子是开花前10天的平均气温以及最低气温。
真花学说提出,被子植物的花是由类似于裸子植物本内苏铁目(Bennettitales)两性孢子叶球上排列的胚珠和花粉器官演化而来(陈之端等,1997;冷琴等,2001),植物的性别差异主要取决于花器官的发育,单性花是在两性花的基础上其雌性或雄性器官退化进化而来(Aryaletal.,2014)。刘亭亭(2017)认为不同种类的花虽然在结构上存在差异,但其花原基发生的早期阶段可能是一致的,而结构相似的花在花器官发育的某些阶段也可能存在较大差异。本研究也发现,3种不同性别花芽在不同的分化时期其内部结构变化既存在相同之处,也有所差异。在雌雄蕊原基产生之前3种不同性别花芽的外部形态(长宽比、色泽)及内部组织结构的变化基本一致,花器官成熟时萼片和花瓣都为覆瓦状排列,与山茶科植物其他类群的研究结果相吻合(张逸,2012);而在雌雄蕊分化期至雌雄蕊成熟期3种不同性别花芽各具特点,雌花芽中只有雌蕊原基生长发育,雄花芽和两性变异花芽的雌雄蕊原基基本同时出现,雄花芽中雌蕊原基发育一段时间后停止分化,这可能是植物进化中两性花向单性花进化的结果,此发育方式与细枝柃花器官分化类似,而与张瑞菊(2006)描述的柃木属植物不符。两性变异株的花芽中,少数花芽出现雄蕊或雄蕊原基发育不正常,这也体现钝叶柃在进化过程中的不稳定,可能是控制花器官发生的某些基因在进化过程中,受环境、激素等因子选择性表达的结果。近年来,相关研究已经取得了一定的成果,在某些物种中,阻滞发生在花芽分生组织的细胞分化阶段,使其不能产生花器官原基(雄蕊或心皮),如大麻(Cannabissativa)花中不存在任何异性器官的痕迹(Calderon-Urrea,1993)。而在某些物种中,这种阻滞发生在花器官发育后期,从而留下退化的异性器官,比如番木瓜(Caricapapaya)雄花中仍然有心皮的存在,雌花中无雄蕊(Mitchelletal.,2005),与本文研究结果一致。
钝叶柃雌花芽、两性变异花芽为中轴胎座、倒生胚珠,与近缘属代表种猪血木(Euryodendronexcelsum)、厚叶红淡比(Cleyerapachyphylla)、厚皮香(Ternstroemiagymnanthera)的结果一致;但雄蕊原基的发育方式与近缘属代表种有所差异,钝叶柃中雄蕊原基单个发育分化成花药和花丝,与细枝柃类似,而细齿叶柃(Euryanitida)、猪血木、厚皮香的雄蕊以雄蕊束的方式分化(巴罗菊,2017;张瑞菊,2006),这一差异可作为区分不同类群的依据。
4 结论
对钝叶柃雌花芽、雄花芽和两性变异花芽的分化和发育进行了详细的细胞形态学观察,不同性别花芽分化时期可划分为苞片分化期、萼片分化期、花瓣分化期、雌雄蕊分化期、雌雄蕊成熟期,花芽性别分化的关键时期为雌雄蕊分化期,其两性变异花芽的外部形态变化与雌花芽一致,内部结构发育方式与雄花芽相似,雌雄蕊发育完全,但发育过程也存在不稳定性,少数雌、雄蕊出现不同程度的退化,只具有单性花功能。研究结果为今后探讨钝叶柃性别分化的控制机制以及性别遗传和性别鉴定提供理论依据。

