杨树根际解无机磷细菌Mp1-Ha4的鉴定及其解磷机理
韩雪娇 曾庆伟 赵玉萍
(淮阴工学院生命科学与食品工程学院,淮安 223003)
磷是植物生长发育所需的重要营养物质,在植物的生长过程中起到重要作用[1]。然而,土壤中的
磷源往往以不溶性形态存在,植物无法吸收利用,土壤缺磷已成为制约农业发展的重要问题[2]。为改善土壤缺磷的情况,现代农业生产中磷肥被大量施用,但磷肥中的有效磷成分(磷酸根阴离子)易与土壤中的Ca2+、Al3+、Fe3+等发生螯合作用而被固定,磷肥的利用率仅有10%-30%[3]。长期大量的磷肥施用还会破坏土壤生态,并最终造成土壤肥力下降,同时水体的富营养化也与磷肥的大量使用存在联系[4]。解磷微生物是土壤中一类能够溶解难溶性磷化合物,增加土壤可溶性磷含量的微生物[5]。研究表明接种解磷微生物能够改善土壤营养条件,并有效促进植物的生长[6-7]。解磷微生物的开发和利用为解决土壤缺磷问题,实现农业可持续化发展提供了新的思路。土壤中的解磷微生物种类繁多,包括细菌、真菌和放线菌等[8]。解磷细菌作为解磷微生物的重要组成部分,受到了学者的大量关注。
根据所溶解的难溶性磷源种类的不同,解磷微生物又被分为解无机磷微生物与解有机磷微生物[9]。许多研究表明,解无机磷微生物通过酸化、螯合、交换反应和聚合物质的形成等方式将不溶性磷转化为可溶性形式,这可能与有机酸的产生、质子(H+)的释放、氧化还原活性金属等有关。其中,低分子量有机酸的分泌是与解无机磷微生物的解磷能力密切相关[10]。
杨树是苏北的重要经济林木,具有成材快,易种植等优势,然而短期轮阀的经营模式造成土壤肥力的大量流失,土壤缺磷问题已逐渐显现[11]。本实验室前期从杨树根际筛选获得了一株解无机磷细菌,初步筛选发现该菌株具有较强的解磷活性,然而该菌株的种属、解磷能力及机理尚不清楚,因此本研究对该菌株进行种属鉴定,测定其解磷能力,并对其解磷机理进行初步的探索和研究,以期为该菌株后期解磷菌剂开发和使用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株 解无机磷细菌Mp1-Ha4分离自江苏省淮安市清江浦区(东经119°01'21",北纬33°35'34"),现保存于淮阴工学院生命科学与食品工程学院生物催化实验室。
1.1.2 培养基 国际植物研究所磷酸盐生长培养基(National botanical research institute’s phosphate growth medium,NBRIP):葡萄糖 10 g,磷酸钙 5 g,MgCl 5 g,KCl 0.2 g,MgSO4·7H2O 0.25 g,(NH4)2SO40.1 g,去离子水1 L,pH7.0,固体培养基添加1.5%的琼脂粉。
LB培养基:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,蒸馏水1 L,pH7.0,固体培养基添加1.5%的琼脂粉。
葡萄糖蛋白胨水培养基:蛋白胨5 g,葡萄糖5 g,K2HPO42 g,去离子水1 L,pH7.2-7.4。
淀粉培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,可溶性淀粉2 g,去离子水1 L,固体培养基添加1.5%的琼脂粉。
1.2 方法
1.2.1 解无机磷细菌Mp1-Ha4的生物学特征 将-80℃保藏的解无机磷细菌Mp1-Ha4菌株划线接种于LB平板,28℃培养活化2次。挑取活化后的菌株单菌落划线接种于LB固体平板,28℃倒置培养48 h,观察单菌落的形状、大小、表面光泽度和湿润度等特征。同时将Mp1-Ha4菌株在LB固体平板上划十字接种,并将无菌载玻片覆盖于十字交叉位置,同样条件下培养48 h后观察菌株生长情况。挑取适量Mp1-Ha4菌体,进行革兰氏染色,荚膜和鞭毛染色,并使用显微镜镜检观察,同时进行KOH溶解性检测,过氧化氢酶监测,甲基红(MR)检测,伏普(VP)检测和淀粉水解检测,具体方法参照《微生物学实验指导》[12]。
1.2.2 解无机磷细菌Mp1-Ha4分子生物学鉴定 挑取上述活化后的菌株单菌落接种于50 mL LB液体培养基,28℃,180 r/min培养12 h,即为种子液(OD600nm=0.806)。准确吸取1.5 mL菌液至2 mL离心管中,12 000 r/min离心1 min,去上清,无菌水洗涤菌体3次,使用基因组DNA提取试剂盒(DP302,TIANGEN)提取该菌株DNA。采用琼脂糖凝胶电泳检测基因组DNA完整性,NanoDrop 2000c检测核酸浓度及纯度。以Mp1-Ha4菌株DNA为模板,细菌16S rDNA通用引物(27f:GATTTGATCCTGGCTCAG;1492r:TAGGCTCCTTGTTACTGACTT)为引物,进行该菌株16S rDNA扩增。PCR扩增体系(50 μL):25 μL Taq Master Mix,上下游 引 物各 1 μL,DNA 模板 1 μL(100 ng),无菌水 22 μL ;扩增条件:94℃持续 3 min;94℃持续 45 s,54℃持续 45 s,72℃持续90 s,30个循环;72℃持续4 min。琼脂糖凝胶电泳检测扩增产物,选取电泳条带单一,片段大小合适的扩增样品送至南京擎科生物公司进行测序。
16S rDNA测序结果在NCBI和Eztaxon server上进行序列比对。下载标准菌株的16S rDNA序列进行多序列同源性分析,并利用软件MEGA7.0,采用Neighbour joining(NJ)法构建系统发育树(Bootstrap method=1000)。
1.2.3 解无机磷细菌Mp1-Ha4对不同磷源的解磷能力 分别以磷酸钙、磷酸铝、磷酸铁为唯一磷源配制NBRIP固体及液体培养基,取10 μL Mp1-Ha4种子液点接于上述3种磷源的NBRIP平板,28℃培养箱中静置培养,每种磷源各设置3个重复。7 d后观察测定溶磷圈与菌落直径,并计算“溶磷圈直径/菌落直径”比值。取500 μL Mp1-Ha4种子液分别接种于含有上述3种磷源的50 mL NBRIP液体培养基,28℃,180 r/min振荡培养,每种磷源设置3个重复,以不接菌作为空白对照。培养72 h后,培养液10 000 r/min离心2 min,取上清,上清通过0.22μm滤膜过滤并收集滤液。采用钼锑抗比色法[13]测定滤液可溶性磷含量,使用pH计测定培养基pH值,酸碱滴定法[14]测定滤液可滴定酸度。
1.2.4 解无机磷细菌Mp1-Ha4解磷动力学 将Mp1-Ha4种子液按1%的接种量接种于50 mL以磷酸钙为唯一磷源的NBRIP液体培养基,28℃,180 r/min振荡培养9 d,每隔24 h取3组重复,以不接菌的空白培养基作为对照,按1.2.2的操作方法测定上清液的可溶性磷含量、pH值及可溶性磷含量。
1.2.5 有机酸的测定 取1.2.3中培养第7天的样品,10 000 r/min离心10 min,取上清,上清通过0.22μm滤膜过滤,向滤液中按照滤液∶甲醇=1∶3的比例加入甲醇溶液,混匀,12 000 r/min离心1 min,取上清。采用高效液相色谱法(High performance liquid chromatography,HPLC)对上清中的葡萄糖酸、α-酮戊二酸、丙酮酸、苹果酸、丙二酸、酒石酸、草酸、马来酸及柠檬酸含量进行测定色谱条件参照Zeng等[15]的测定条件。
2 结果
2.1 解无机磷细菌Mp1-Ha4的生物学特征
解无机磷细菌Mp1-Ha4的在LB平板上的菌落呈圆形,乳白色,边缘整齐,表面湿润光滑(图1-A),为一株严格的好氧性细菌(图1-B)。显微镜下观察该菌株菌体为球形,直径约0.8-1.0 μm。该菌株革兰氏检测结果为阴性,其他生理生化分析结果见表1。
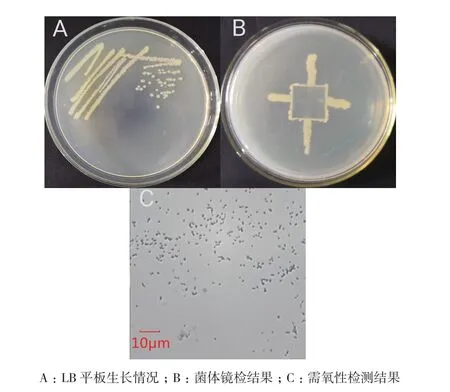
图1 菌株Mp1-Ha4的菌落形态和需氧性结果

表1 解无机磷细菌Mp1-Ha4生理生化分析结果
2.2 解无机磷细菌Mp1-Ha4的分子生物学鉴定
BLAST比对结果显示Mp1-Ha4的16S rDNA与西地西菌(Cedeceasp.)(MK101024.1)具有较高的同源性,为100%。Eztaxon系统比对结果显示该菌株的16S rDNA与西地西菌属Cedeceasp.具有较高的同源性,为98.8%。根据16s rDNA序列构建的系统发育树如图2所示,从图中可以看出解无机磷细菌Mp1-Ha4与其他菌属之间的进化关系,其中与Cedeceasp.(MK101024.1)的亲缘关系最为接近。因此,将解无机磷细菌Mp1-Ha4鉴定为西地西菌(Cedeceasp.)。
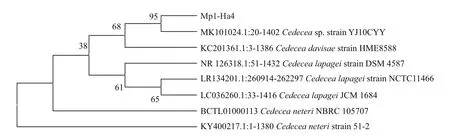
图2 基于16S rDNA序列构建的解无机磷细菌Mp1-Ha4系统发育树
2.3 解无机磷细菌西地西菌(Cedecea sp.)Mp1-Ha4对不同磷源的解磷能力
平板实验结果显示,解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4能够在以磷酸钙、磷酸铝和磷酸铁为唯一磷源的NBRIP平板上生长,其在磷酸钙平板上能够产生明显的溶磷圈(溶磷圈直径/菌落直径=1.33),而该菌株对磷酸铝和磷酸铁的溶解效果较差(图3,表2)。在NBRIP液体培养基中,Mp1-Ha4菌株对磷酸钙的解磷能力最强,达到了321.95 mg/L,显著高于(P<0.01)该菌株对磷酸铁(17.07 mg/L)、磷酸铝(30.46 mg/L)的解磷能力(图 4)。
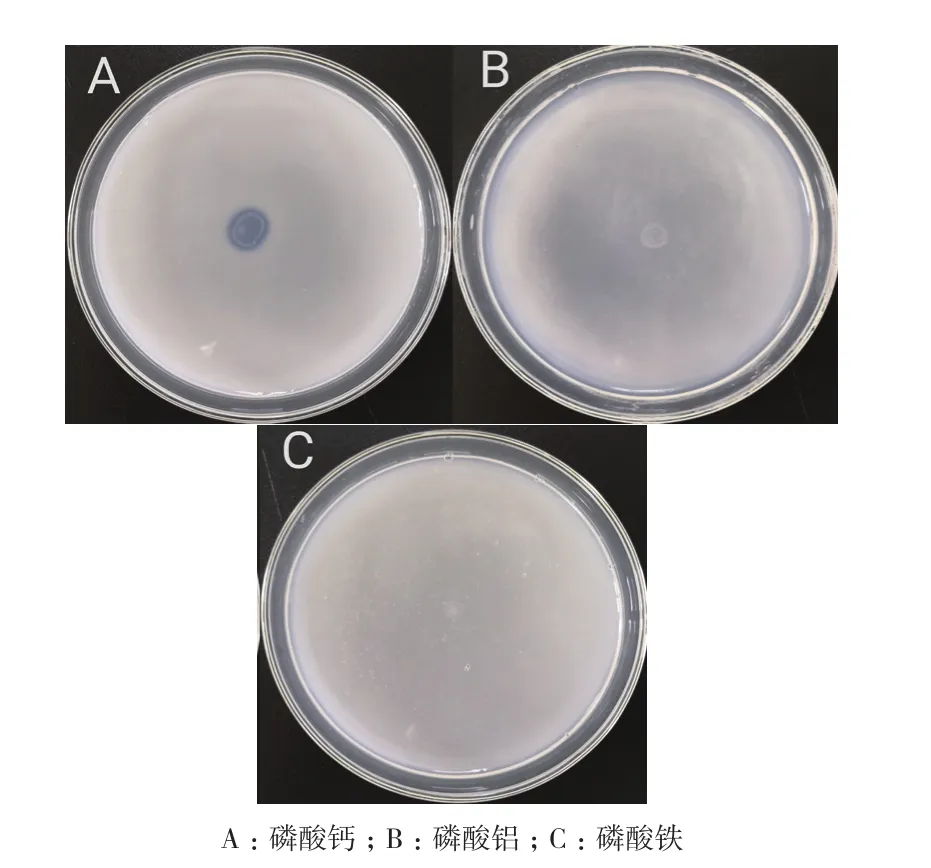
图3 解无机磷细菌西地西菌(Cedecea sp.)Mp1-Ha4在不同磷源NBRIP平板上的生长及解磷情况情况
在对磷酸钙的溶解过程中,培养基pH下降到了3.9,在对磷酸铝、磷酸铁溶解过程中,培养基pH分别下降到4.27和5.21。培养基pH与Mp1-Ha4菌株的解磷能力呈负相关(相关系数,R=-1.000)。对培养基可滴定酸度的测定结果显示,Mp1-Ha4菌株对3种磷源溶解过程中,培养基可滴定酸度分别为2.10、0.22、0.15 mL,与该菌株的解磷能力呈正相关(相关系数,R=1.000)。
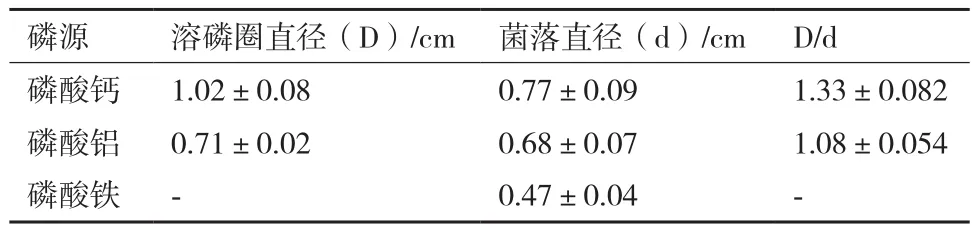
表2 解无机磷细菌西地西菌(Cedecea sp.)Mp1-Ha4在不同磷源NBRIP平板上的解磷情况
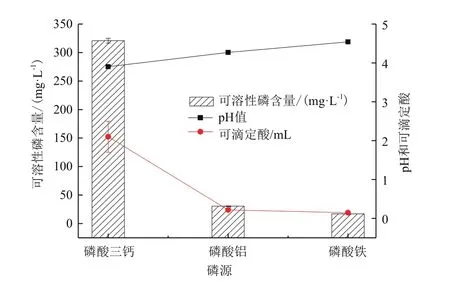
图4 解无机磷细菌西地西菌(Cedecea sp.)Mp1-Ha4对不同磷源的解磷能力
2.4 解无机磷细菌Mp1-Ha4解磷动力学
解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4对磷酸钙表现出较强的解磷能力(图5)。在培养的1-3 d内,发酵液中可溶性磷含量增速较快,4-7 d内,可溶性磷含量的增速较慢,并在第7天达到了最大值,其可溶性磷含量最大值为497.4 mg/L。随着培养时间的增加,该菌株的解磷能力呈现出先增长再降低的趋势。
随着培养时间的变化,培养基pH与可滴定酸度也发生了明显的变化(图5)。在1-3 d内,pH值从4.76降到了4.22,此后一直保持较平稳的状态,培养基pH与Mp1-Ha4菌株解磷量呈负相关(R=-0.812)。培养基可滴定酸度随着培养时间的增加逐渐增加,到第7天达到最大(3.53 mL),后缓慢下降,培养基可滴定酸度与Mp1-Ha4菌株解磷量呈正相关(R=0.911)。

图5 解无机磷细菌西地西菌(Cedecea sp.)Mp1-Ha4对磷酸钙的解磷动力学
2.5 有机酸的测定
HPLC检测结果表明,解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4在对磷酸钙溶解过程中能够分泌大量的有机酸(表3),其中α-酮戊二酸、酒石酸和苹果酸含量分别为858.12、627.11和99.36 mg/L,而草酸、柠檬酸、丙二酸、马来酸和葡萄糖酸没有被检测到。这可能是发酵液pH下降的原因。
3 讨论
为了获得更加优良的种质资源,解磷微生物的分离、筛选工作仍在大量开展。已报道的解磷细菌种属主要有节杆菌属(Arthrobacter)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、类芽孢杆菌属(Paenibacillus)、欧文式菌属(Eerwinia)、沙门氏菌属(Salmonelza)、固氮菌属(Azotobacter)、泛菌属(Pantoea)等[16-20]。本研究通过分子生物学鉴定Mp1-Ha4为西地西菌(Cedeceasp.),其对磷酸钙的溶解能力达到了497.4 mg/L。Mónica等[21]从酸性土壤中分离得到解磷细菌,其解磷活性在100 mg/L-300 mg/L。叶维雁等[22]从番木瓜中分离得到一株解磷细菌PK-1,其对磷酸钙的溶解能力为1.63 mg/L。王舒等[23]从油菜根际分离得到的解磷细菌的解磷能力在400 mg/L左右。由此可见,解磷菌株西地西菌(Cedeceasp.)Mp1-Ha4为一株高效的解无机磷细菌。

表3 解无机磷细菌西地西菌(Cedecea sp.)Mp1-Ha4的有机酸分泌情况
分泌小分子量有机酸被认为是解无机磷细菌溶解难溶性磷酸盐的主要机制[24]。解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4在对磷酸钙溶解过程中,分泌了大量的有机酸,包括α-酮戊二酸、酒石酸和苹果酸,总量达1 584.59 mg/L。张英等[25]研究发现,解磷微生物解磷过程中α-酮戊二酸、酒石酸与苹果酸的量与溶磷量呈线性相关。刘胜亮等[26]在研究解磷微生物分泌有机酸与解磷量的关系时发现,酒石酸、草酸等有机酸的分泌与解磷量之间显著相关。这3种有机酸的分泌可能在解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4解磷过程中发挥了重要作用。
研究表明,解磷细菌所分泌的有机酸在其解磷过程中充当螯合剂或通过降低环境pH来溶解释放不溶性磷酸盐中的磷酸根离子[27]。本研究发现,解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4解磷过程中,培养基pH与其解磷量呈显著负相关,而培养基可滴定酸含量与其解磷量呈显著正相关。赵为容[28]在对27株解磷细菌进行研究时发现,解磷菌株的解磷量与pH值之间呈负相关,本实验结果与此研究结果表现一致。这些结果表明,分泌大量小分子有机酸,降低环境的pH可能是其溶解难溶性磷酸盐的主要机制。
解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4对磷酸钙具有较强的溶解能力,对磷酸铝和磷酸铁的溶解能力相对较弱,这与Pérez等[29]的研究结果相一致。一般中性、弱碱性土壤中的不溶性磷酸盐以磷酸钙为主,而酸性土壤则以磷酸铁、磷酸铝较多。我国北方地区土壤以中性、弱碱性偏多。长期的自然选择使得北方土壤中分离获得的解无机磷细菌西地西菌(Cedeceasp.)Mp1-Ha4对磷酸钙有较好的溶解能力。这些结果表明,该菌株是一株优良的生物菌肥资源菌株,具有在北方土壤中适地施菌的巨大潜力。本研究将为解无机磷细菌西地西菌Cedeceasp. Mp1-Ha4的种质资源开发奠定基础,也为该菌株后期的田间应用提供理论指导。
4 结论
通过生理生化分析和分子生物学方法确定解无机磷细菌Mp1-Ha4为西地西菌(Cedeceasp.),其对磷酸钙具有较强的溶解能力,通过对有机酸种类及含量的测定初步判定分泌有机酸降低环境pH是其主要解磷机理。

