灌胃吡喹酮在中华草龟体内的代谢动力学研究
张晓雨,庞溦,潘连德、3*,鲍晓颖
(1.上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2.上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306; 3.上海海洋大学 国家水生动物病原库, 上海 201306 )
近年来,随着人们对龟鳖自然资源保护的重视,以及其观赏、药用与食用价值的不断提高,龟鳖健康和疾病问题也越来越被重视,其临床兽医学研究亟待开展。当前研究工作中,常用抗菌类药物恩诺沙星连续肌注对中华草龟Chinemysreevesiis的急性与慢性毒理[1]和强制口服在该龟体内的药代动力学研究[2],以及麻醉药物舒泰50对中华草龟的麻醉效果与体内药代动力学特征研究[3],为抗菌药物和麻醉药在龟鳖临床的使用提供了可靠的科学依据。
吡喹酮(Praziquantel)具有高效、广谱、低毒、剂型多等优点,被广泛应用于哺乳动物、爬行动物[4]及水产动物[5-6]等的临床驱虫,防治龟鳖体内外寄生虫病的驱虫效果已有不少研究,对治疗绿海龟自发性心血管吸虫感染具有良好疗效[7]。吡喹酮和艾默德斯(Emodepside)(Profender©,Bayer)的组合滴剂对俄罗斯陆龟、赫尔曼陆龟、穆尔西腊陆龟和豹龟4种野生陆龟的蛔虫等寄生虫感染的驱虫效果显著[8]。体表滴涂给药操作相对简单,但药物经皮吸收缓慢,另外,针对红耳巴西龟等水生物种,吡喹酮经体表滴涂后,水龟放入水中后吡喹酮会很快被稀释,影响吸收效果,无法达到有效血药浓度,并且相关试验仅测定了体表滴涂给药前0 h与给药后5、24、48 h时的吡喹酮血药浓度,药动力学数据较少,对药动力学的统计贡献相对有限[9]。目前,针对吡喹酮在龟鳖体内药物代谢动力学研究,仅见单剂量和多剂量口服吡喹酮后测定海龟血浆内吡喹酮浓度及药代动力学特征的初步研究[10],但该试验过程与结果存在较大的缺陷。中华草龟是中国常见的本土龟类,由于其适应力强、来源广、用途多等原因已成为科学研究的模式试验龟[1-3]。本试验中,选取成年中华草龟为试验对象,探究不同性别、不同剂量、不同给药次数对灌胃吡喹酮在中华草龟体内的药代动力学规律和特征的影响,以补充和完善龟鳖体内药动学与不良反应的研究,旨在为吡喹酮在临床上治疗龟鳖寄生虫性疾病提供数据资料。
1 材料与方法
1.1 材料
试验动物:试验用人工养殖的中华草龟购于安徽省阜阳市界首市养龟场, 雌性6只(7龄),体质量为(0.745±0.066) kg,雄性6只(8龄),体质量为(0.361±0.066) kg。按性别分组暂养在两只水族箱(100 cm×80 cm×80 cm)中,试验用水为充分曝气的自来水,水温控制在(27±2)℃,稳定饲养约45 d。暂养期间每2 d换水1次,每天观察并记录摄食、排便、活动及精神状态。以摄食良好、排便成型、四肢活动力强、精神佳、无明显外伤与异常行为者,视为正常个体,用作试验动物。
主要仪器:液相色谱-质谱联用仪(离子阱)(Thermo Scientific LTQ-XL)、高速冷冻离心机(Eppendorf 5424R)、漩涡振荡器(IKA Vortex-3)和氮吹仪(QGC-24T)等。
主要药品与试剂:吡喹酮标准品(纯度99.7%) 购自河南普天同创生物科技有限公司;吡喹酮片(每片成分含量约200 mg)购自华畜商贸有限公司;甲醇、乙酸乙酯、乙腈、超纯水等均为色谱纯,购自上海安谱实验科技股份有限公司。
1.2 方法
1.2.1 分组与给药 精确称取吡喹酮片研磨成细密粉末,根据各组给药剂量设定,每只试验龟按体质量计算所需药量,并精确称量药粉置于10 mL离心管中,用2 mL葡萄糖生理盐水溶解,旋涡振荡1 min制成悬浊液。利用2.5 mL无菌注射器和输液软管制成灌胃工具,经胃插管灌胃给药,管内残留物加2 mL葡萄糖生理盐水二次冲洗,振荡1 min后灌胃。试验前禁食24 h,给药后8 h开始喂食。
参考吡喹酮片兽用说明书和海龟体内驱虫效果[7]和药动学[10]研究的报道,以及上海海洋大学攀世水族宠物健康中心临床驱虫实践选定用量,试验分4组,每组设3个平行,每个平行用1只龟,分组和用药情况见表1,胃插管灌胃吡喹酮操作见图1。试验Ⅳ组于0、3、6 h采血后立即进行灌胃给药,每次剂量为10 mg/kg(体质量),累计剂量为30 mg/kg。
表1 吡喹酮对中华草龟代谢学影响试验的分组及灌胃给药剂量
Tab.1 TurtleChinemysreevesiisgrouping and oral administration dose of praziquantel during the metabolic experiment

组别group龟编号turtle No.体质量/kgbody weight给药量/mgdrug amount剂量/(mg·kg-1体质量)dose试验Ⅰ组单次给药雌龟组A10.66820.0430A20.70621.1830A30.70421.1230试验Ⅱ组单次给药雄龟组B10.2848.5230B20.3029.0630B30.3309.9030试验Ⅲ组单次给药雄龟组B40.4246.3615B50.4466.6915B60.3785.6715试验Ⅳ组3次给药雌龟组A40.7427.42×310A50.8368.36×310A60.8128.12×310
1.2.2 采样 采用背颈静脉窦连续采血法,在给药前0 h和给药后0.5、1、3、6、12、24、48、72、96 h共10个采样时间点,从每只龟的背颈静脉窦中连续采集血样(图2),每次采血量为0.5~1 mL,置于含肝素锂的2 mL抗凝管中,混匀,置于碎冰上,并在收集后15 min内于4 ℃下以10 000 r/min高速离心5 min,分离取血浆置于2 mL离心管中,标号,-40 ℃下冻存待测。
1.2.3 样品前处理 样品前处理方法参考文献[10-11]并稍做修改。取-40 ℃下冷冻保存的血浆于室温下自然解冻,用移液器准确吸取500 μL于10 mL离心管中,加入5 mL 100%乙酸乙酯进行萃取,漩涡混匀3 min,再以4500 r/min(4 ℃)离心10 min,吸取上清液于15 mL干净离心管内,向剩余残渣中加入5 mL乙酸乙酯二次萃取,漩涡振荡3 min,以4500 r/min(4 ℃)离心10 min,吸取上清液合并到15 mL离心管中,混匀,将萃取液在(40±5)℃氮气下蒸发至干。将残余物复溶于500 μL乙腈中, 漩涡混匀3 min,并超声处理5 min,再加超纯水定容至1 mL,漩涡混匀3 min,以4500 r/min(4 ℃)离心5 min,用1 mL灭菌注射器吸取上清液过0.22 μm滤膜转移至进样瓶中,上机测定或-40 ℃下保存待测。
1.2.4 测定条件 色谱条件:色谱柱Thermo Scientific Hypersil GOLD C18(2.1 mm×150 mm,5 μm),柱温为40 ℃,进样量为2 μL; 流动相A为水(含0.1%甲酸),B为甲醇。梯度洗脱程序:0~0.5 min,30%B;0.5~2 min,30%B~98%B;2~5 min,98%B,保持3 min;流速为0.2 mL/min。
质谱条件:采用大气压电喷雾离子源(ESI),喷雾电压为3.5 kV,离子传输毛细管温度为325 ℃,碰撞气氩气压力为2.0 mTorr,鞘气流量为10 L/min,辅助气流量为30 L/min;采用选择反应监测模式(SRM),吡喹酮母离子为313 m/z,定量子离子为203 m/z,碰撞能量为13 eV。
1.2.5 标准曲线和回收率 称取吡喹酮标准品10 mg溶于甲醇水溶液(体积比4∶1)中,配制成100 μg/mL吡喹酮标准品母液,4 ℃下保存备用。
标准曲线的制备:将100 μg/mL吡喹酮标准品母液依次稀释成1.0、0.5、0.2、0.1、0.05 μg/mL标准工作液,过0.22 μm滤膜,利用液相色谱-质谱联用仪(LC-MS)进行测定。用Xcalibur软件统计得到吡喹酮标准工作曲线和回归方程。
回收率、精密度的测定:取500 μL空白血浆,分别加入10.0、1.0、0.1 μg/mL标准品工作液0.1 mL,按“1.2.3”节方法处理样品,最终配制成1.0、0.1、0.01 μg/mL 3个高、中、低质量浓度的加标样品,每个浓度设3个平行,使用LC-MS进行测定,得到实测浓度并计算回收率,即相对回收率=样品实测浓度/样品理论浓度×100%。
将上述加标样品在1 d内的3个不同时间点分别上机重复检测,并连续3 d进行测定,然后计算求得血浆样品中吡喹酮的日内和日间平均变异系数,以衡量检测方法和仪器的精密度。
变异系数(CV)=S/X×100%。
其中:S为标准偏差;X为平均值。
1.2.6 灌胃吡喹酮对中华草龟不良反应的评价 试验动物在给药后会出现明显的不良反应,表现为摄食能力和运动能力下降,后肢拖行或踹尾等行为异常,精神状态变差,严重者甚至死亡。按不良反应严重程度划分为5个评价等级(表2)。
表2 吡喹酮对中华草龟的不良反应评价等级和行为特征
Tab.2 Evaluation of adverse reactions and behavioral characteristics of each level of praziquantel against turtleChinemysreevesiis

等级degree行为特征behavioral characteristics4摄食不佳,运动障碍,精神沉郁,一个月内死亡3摄食不佳,运动障碍,精神沉郁,一个月后死亡2摄食正常,后肢运动障碍且难以恢复,精神尚可1摄食正常,后肢运动障碍但可恢复,精神尚可0摄食良好,运动正常,精神佳
1.3 数据处理
采用Excel 2010软件绘制药时曲线;采用 Kinetic 4.4药代分析软件进行药代动力学参数的拟合和计算。
2 结果与分析
2.1 吡喹酮标准工作曲线、回收率与精密度
本试验中采用液相色谱-质谱联用法测定中华草龟体内吡喹酮的药物浓度,在测定条件下吡喹酮约在4.40 min时出峰, 基线平稳,峰形对称,药峰与杂峰分离良好(图略), 在血液中的定量限为0.002 μg/mL,故该方法可作为本试验中检测样品的有效方法。
以药物浓度为横坐标(x, μg/mL)、峰面积为纵坐标[y,μg/(mL·h)]建立标准曲线图(略)。标准工作曲线方程为y=113807+4.75727×106x,R2=0.9996,在浓度为0.01~1.00 μg/mL时线性关系良好。
通过测定1.0、0.1、0.01 μg/mL 3个高、中、低质量浓度的加标样品,计算所得到的吡喹酮的平均回收率为(98.7±1.2)%,日内和日间平均变异系数均小于10%。
2.2 吡喹酮在中华草龟体内的药时曲线和药代动力学参数
每个试验组分别有3个平行,计算每个采血点各试验组的平均血药浓度和标准差,双峰效应的首峰位于0.5 h(试验Ⅰ、Ⅱ、Ⅳ组)和3 h(试验Ⅲ组),第二峰位于12 h(试验Ⅰ组和Ⅳ组)和72 h(试验Ⅱ组和Ⅲ组) (表3),根据平均血药浓度与时间的关系绘制吡喹酮的药时曲线图(图3)。使用Kinetic 4.4药代分析软件对数据进行模型拟合,得到主要的药代动力学参数(表4),灌胃吡喹酮在中华草龟体内的药代动力学特征均适合用一室开放模型来描述。
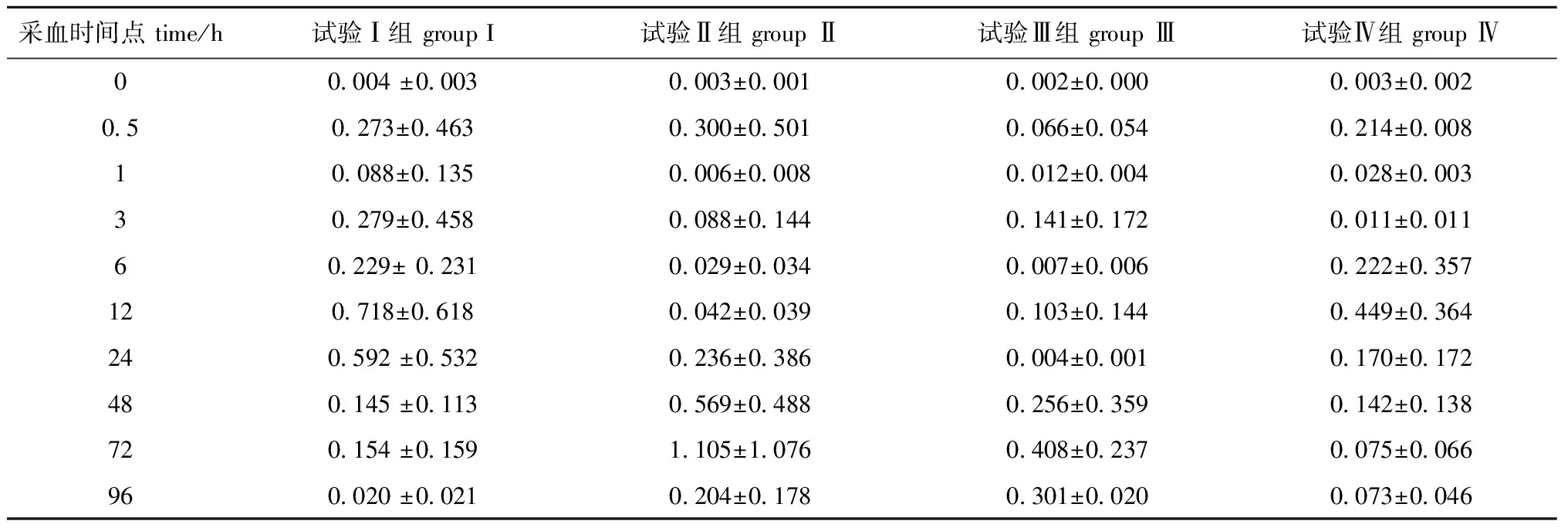
表3 中华草龟体内吡喹酮的平均血药浓度Tab.3 Average concentration of praziquantel in blood of turtle Chinemys reevesiis μg/mL
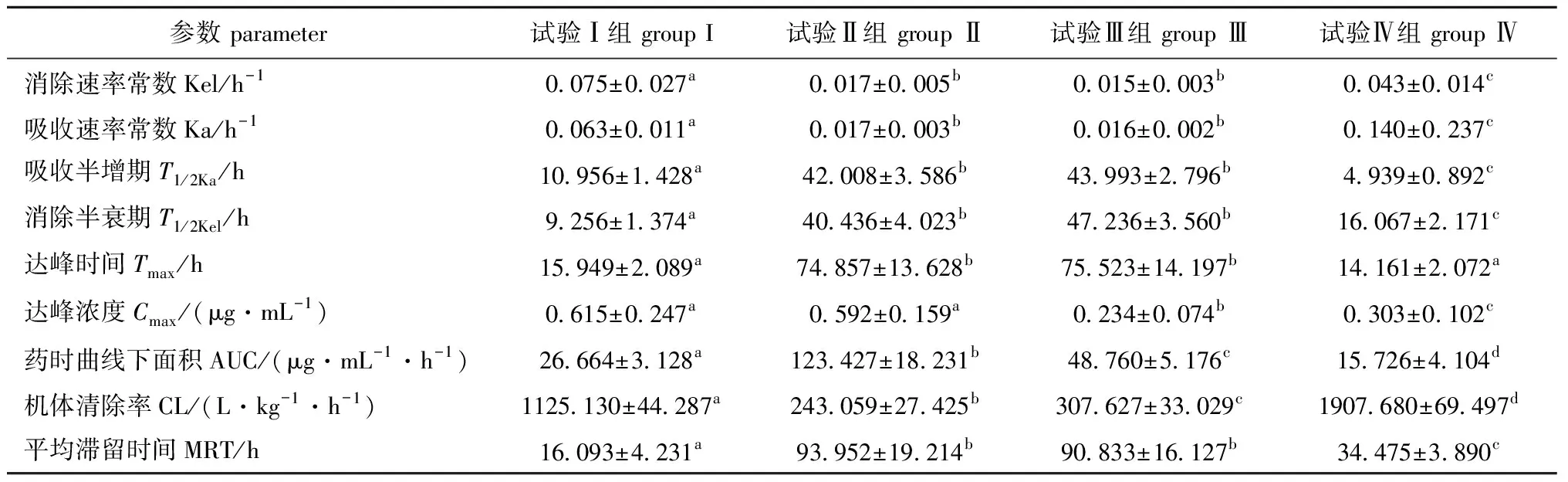
表4 中华草龟体内吡喹酮的药代动力学参数Tab.4 Pharmacokinetic parameters of praziquantel in turtle Chinemys reevesiis
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same line are significantly different among the groups at the 0.05 probability level, and the means with the same letters within the same line are not significant differences
2.3 灌胃吡喹酮对中华草龟不良反应的评价
2.3.1 30 mg/kg剂量组单次灌胃给药试验 按该剂量单次灌胃给药后,试验Ⅰ组的3只雌龟(A1、A2、A3)和试验Ⅱ组的3只雄龟(B1、B2、B3),24 h内出现了强烈的不良反应,共同症状表现为精神状态不佳,神情呆滞,头脚及四肢蜷缩不动,运动失调,后肢严重无力,几乎失去运动能力,但后肢有反射和痛觉,拉伸可回缩,运动时前肢划水,后肢或蜷缩或拖地,后肢踹尾巴等异常行为,病情严重者食欲废绝。
在给药后96 h时,试验Ⅰ组3只雌龟后肢开始逐渐恢复运动能力,但食欲和运动力较试验前的健康状态明显下降。其中雌龟A1在给药后第15天时死亡;A3于给药后第35天时死亡,剖检发现,A1、A3两只龟的肝脏、肾脏等均有明显病变坏死;A2在康复期间病情不稳定,出现呼吸困难、摄食无力等症状,于第20天时转危为安,摄食运动能力正常,较试验前状态活跃度变差。
试验Ⅱ组雄龟组对吡喹酮的不良反应较试验Ⅰ组雌龟组症状更加明显和严重,运动时后肢始终蜷缩或拖行,未见好转。给药后第28天时雄龟B1死亡,剖检结果与试验Ⅰ组基本一致,主要病变为肝脏变性,局部坏死,肾脏肿大,颜色呈淡黄色,结构不规整,后肢分布大量黑色变性脂肪,肌肉萎缩;B3于第41天濒死状态下剖检,症状基本相同;B2摄食正常,自主摄食龟粮,但是后肢运动功能始终未恢复。
2.3.2 15 mg/kg剂量组单次灌胃给药试验 按该剂量单次灌胃给药后,试验Ⅲ组试验龟(B4、B5、B6)24 h内未见明显异常。给药后雄龟B5于25 h出现了类似2倍剂量组的不良反应,后肢开始拖行,拉伸无力,但仍有痛觉和反射,可回缩,摄食排便正常,精神尚可,但是后肢运动功能仍未恢复;B4于给药后108 h出现与B5相同症状,给药后第18天时翻缸溺水,剖检发现其尚有气息和心跳,其肝脏明显肿大,表面分布大量沙粒大小的黄白色结节,肾脏肿大,膀胱尿充盈,有尿酸,肺脏和肠胃含有大量积水,确诊是溺水,后肢基部脂肪变性呈黑色;B6拒食嗜睡,因疾病原因于第12天死亡。
2.3.3 总剂量30 mg/kg平分3次给药试验 按每次10 mg/kg剂量灌胃给药,给药间隔3 h,试验Ⅳ组自第一次给药后96 h内,该组3只雌龟(A4、A5、A6)均无异常,摄食良好,摄食精准,四肢运动正常。A4于第一次给药后第8天时开始出现呼吸困难,运动力下降,后肢运动力尚可,但明显运动失衡,动作笨拙,于第19天麻醉处死,剖检发现其肝脏肿大,呈黄褐色,颜色分布不均上有白色条纹和结节,脾脏充血,四肢基部脂肪变性呈黑色;A5、A6雌龟行为表现正常。
综上,各组中华草龟的不良反应评价等级如表5所示。
表5 吡喹酮对中华草龟的不良反应评价
Tab.5 Evaluation of adverse reactions of turtleChinemysreevesiisto praziquantel
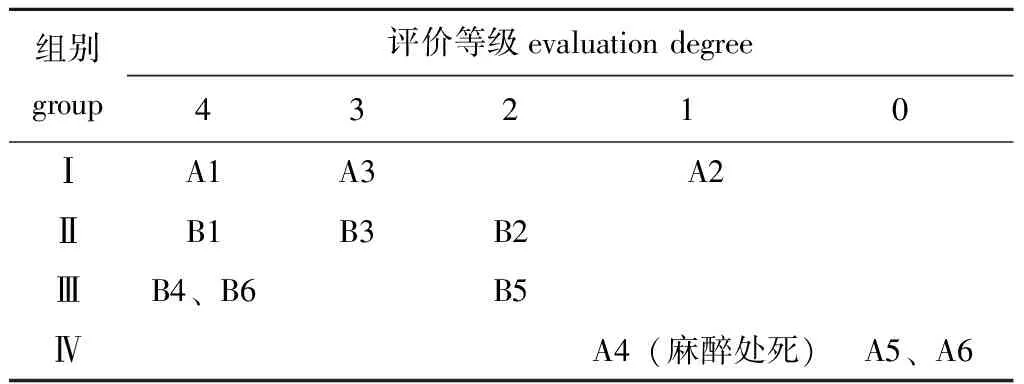
组别group评价等级evaluation degree43210ⅠA1A3A2ⅡB1B3B2ⅢB4、B6B5ⅣA4(麻醉处死)A5、A6
3 讨论
3.1 吡喹酮在中华草龟体内的药代动力动学特征和“双峰效应”
中华草龟灌胃吡喹酮,其药代动力学过程符合一室开放模型,这与口服吡喹酮在绒山羊[12]、家兔[13]体内的药动学特征模型基本相同。水牛按20 mg/kg(体质量)单剂量内服吡喹酮片后,其血浆吡喹酮的Tmax、Cmax、AUC分别为(0.60±0.29)h、(0.57±0.37)μg/mL、(0.80±0.70)μg/(mL·h)[14]。草鱼按10 mg/kg(体质量) 单剂量口灌吡喹酮,其药时数据符合二室开放模型,Tmax、Cmax、AUC分别为1.0 h、0.41 μg/mL、46.39 μg/(mL·h)[15]。本试验中吡喹酮在中华草龟体内的代谢有“双峰效应”,与透皮给药吡喹酮在小鼠肝脏、脾和肾脏内各出现两个药峰值的结果相似[16]。不同盐酸氯苯胍(ROBH)口灌剂量在异育银鲫血浆等组织中的药时曲线也出现双峰效应[17]。本试验中第96 h各组试验龟血浆内仍可检测到吡喹酮(>LOQ),其中,试验Ⅱ组、Ⅲ组雄性龟组的血药浓度仍高于最低有效血药浓度(0.20 μg/mL),说明灌胃吡喹酮在中华草龟雄龟体内代谢消除缓慢,药物残留时间长。
3.2 中华草龟对吡喹酮的代谢和不良反应因性别和给药次数呈有明显差异
本试验表明,中华草龟雌性相对于雄性对吡喹酮的吸收速率更快,但吸收程度相对较小,前者的机体清除率(CL)大于后者,滞留时间(MRT)小于后者,表明雌性龟对吡喹酮的消除速率更快,维持时间较短。两组试验龟(试验Ⅰ、Ⅱ组)均出现了严重的不良反应(100%),临床症状与剖检结果基本吻合,说明单次灌胃30 mg/kg吡喹酮对中华草龟是过量的,会造成组织器官严重病变。试验Ⅲ组剂量为试验Ⅱ组剂量的一半,即15 mg/kg,比较试验Ⅱ组和试验Ⅲ组的药动学参数,试验Ⅱ组的Cmax、AUC均明显高于试验Ⅲ组,其他参数值相似,说明灌胃吡喹酮在中华草龟体内的Cmax、AUC随剂量增加而增大,给药浓度越大,则吸收水平越高,但达峰时间、吸收速率与消除速率基本不变。该组试验龟除B6(考虑自身疾病原因)外,其他两只先后出现了后肢丧失运动能力的不良反应,且幸存下来的B5目前仍没有恢复后肢的运动力,濒死龟剖检结果与试验Ⅱ组基本一致,表明15 mg/kg吡喹酮单次灌胃对中华草龟仍属过量。
试验Ⅳ组分3次灌胃与试验Ⅰ组进行比较,总给药量均为30 mg/kg时,达峰时间Tmax相近, 试验Ⅳ组的Cmax与AUC均小于试验Ⅰ组,但Ka、MRT较大,Kel较小,说明吸收更快,消除较慢,机体内滞留时间更长,药效更持久。该组仅一只试验龟出现不良反应,由于试验需要麻醉处死,该龟死前后肢运动力下降但尚存,不排除自身恢复的可能性,其他两只龟较为健康。芬苯达唑会造成赫尔曼陆龟短暂的低血糖、高尿酸血症等病症[18],红耳巴西龟注射0.3 mg/kg伊维菌素会产生中毒反应,36 h内死亡[19]。小鼠口服吡喹酮片剂有时会出现心动过缓、房颤等副作用[16]。本试验中,单剂量灌胃30、15 mg/kg吡喹酮对中华草龟均产生了明显的不良反应,组织器官明显病变坏死,与大鼠口服1500 mg/kg吡喹酮的结果[20]相似。但海龟口服吡喹酮治疗扁钩虫时并未观察到肝脏明显病变[7]。
3.3 灌胃吡喹酮对中华草龟体内驱虫剂量和临床应用建议
龟鳖临床驱虫常用的驱虫药主要包括吡喹酮[7-10]、甲硝唑[21]、芬苯达唑[22]、奥芬达唑[23]、伊维菌素、阿维菌素等,也有学者强烈推荐中草药驱虫[24]。在本试验条件下,中华草龟按10 mg/kg(体质量)剂量,雌龟每间隔3 h灌胃给药吡喹酮3次, 累计给药30 mg/kg,具有低毒性,且能够较长时间维持有效血药浓度。龟鳖临床上使用吡喹酮驱虫时,推荐中华草龟单次灌胃剂量为10 mg/kg以下,如果需要提高剂量,可以多次给药,雌龟控制在连续3次以内,也可供其他龟类用药参考。

