木薯MebZIP7和MebZIP9基因的克隆及其转录活性分析
孟宇红 陈 新 马平安 宋 羽 张圣奎 王文泉*
(1.海南大学 热带农林学院,海口 571101;2.中国热带农业科学院 热带生物技术研究所,海口 571101;3.新疆农业科学院农作物品种资源研究所, 乌鲁木齐 830091)
木薯(ManihotesculentaCrantz)起源于中南美洲亚马逊热带雨林地区,分属大戟科(Euphorbiaceae)木薯属(ManihotP. Mill.)多年生植物[1]。木薯、马铃薯和甘薯并称世界三大薯类作物,所产淀粉广泛用于食品和工业原料,是重要的粮食和经济作物[2]。木薯野生祖先种与栽培种的全基因组分析显示:木薯栽培种的淀粉合成相关基因转录活性增强[3],而木薯块根淀粉积累是一个复杂的生理代谢过程,会受到内源激素的调控,研究发现脱落酸(ABA)对木薯块根淀粉积累起促进作用[4]。其他植物,如小麦内源激素ABA通过调节籽粒中蔗糖-淀粉代谢的关键酶活性,促进籽粒灌浆[5],外源ABA处理水稻种子后籽粒千粒重增加,产量增加[6]。
碱性亮氨酸拉链(bZIP)是家族成员众多的一类转录因子。bZIP转录因子有高度保守的bZIP区,由一个碱性区和一个亮氨酸拉链组成[7]。依据bZIP相似的碱性区和附加的保守序列将模式植物拟南芥的bZIP基因划分为10个亚族,分别为A-I和S亚族,其中 A亚族与ABA相关,属于脱落酸响应元件结合因子(ABF)[8]。ABF可以反式激活在启动子区含有脱落酸响应元件(ABA response element,ABRE)的效应基因,它的表达受ABA和各种胁迫诱导[9]。ABF参与ABA信号通路,ABA结合PYL后破坏了SnRK2蛋白激酶和PP2C的相互作用,进而激活SnRK2蛋白激酶使ABF磷酸化,从而调节响应ABA信号相关基因的表达[10-12]。拟南芥ABF2过表达植株中SuSy1(Sucrose synthase1)的表达水平低于野生型,高浓度盐处理后SuSy1在转基因植株中的转录水平高[13]。
基因组研究表明木薯碱性亮氨酸拉链(MebZIP)同样是一个大的转录因子家族[14],目前对其研究报道相对较少。本研究针对bZIP A亚族基因:MebZIP7和MebZIP9,通过测定它们在淀粉积累效率不同木薯野生和栽培品种中的转录活性,以及在外源ABA诱导下的表达模式,分析MebZIP成员是否参与木薯块根淀粉合成代谢调节,旨在为深入研究bZIP在ABA参与木薯块根淀粉调控中的作用提供一些试验依据。
1 材料与方法
1.1 试验材料
试验选用栽培木薯KU50、SC8、Arg7和野生亚种W14(Manihotesculenta.ssp.flabellifolia),3个 栽培种的块根淀粉含量高于野生型。KU50和W14用于木薯全基因组测序。SC8是中国热带农业科学院培育的代表性品种,用于ABA处理的组培苗。种植在海南澄迈试验基地,在种植后90(块根形成期)、180(块根膨大期)和210 d(块根成熟期)分别取块根及功能叶用于分析。
选择苗龄45 d,长势均一的SC8组培苗进行ABA处理。每个培养瓶中加入1.0 mL 100 μmol/L的ABA溶液,使其均匀覆盖于培养基表面。分别处理1、6、12和24 h,取处理后的叶片和块根做后续试验。每个处理3次重复和1个对照(未经ABA处理)。3个重复的混合样放入液氮中速冻,-80 ℃保存待用。
1.2 10个MebZIP基因的确定及实时荧光定量表达分析
在转录因子数据库(http://planttfdb.cbi.pku.edu.cn/)中搜索到104个木薯的bZIP转录因子,结合本实验室已有的木薯转录组数据[3],挑选栽培型与野生型块根中相对表达量比值≥2的MebZIP基因,初步筛选到10个MebZIP基因(表1)。将初步筛选到的10个MebZIP基因,根据基因ID号依次命名为MebZIP1~MebZIP10。
取木薯栽培种KU50、Arg7、SC8和野生型W14的块根及功能叶,利用实时定量PCR(qPCR)检测10个MebZIP在不同品种和不同组织部位的差异表达。用Primer- BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计定量引物并检测引物的特异性,qPCR引物序列见表2。使用木薯Manes.02G137500作为内参基因[14]。用Mx3000P QPCR仪,大连宝生物公司的PowerUpTMSYBRTMGreen Master Mix试剂进行试验。qPCR程序: 95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸20 s,40个循环,溶解曲线95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s,并用2-ΔΔct法整理分析数据[15]。
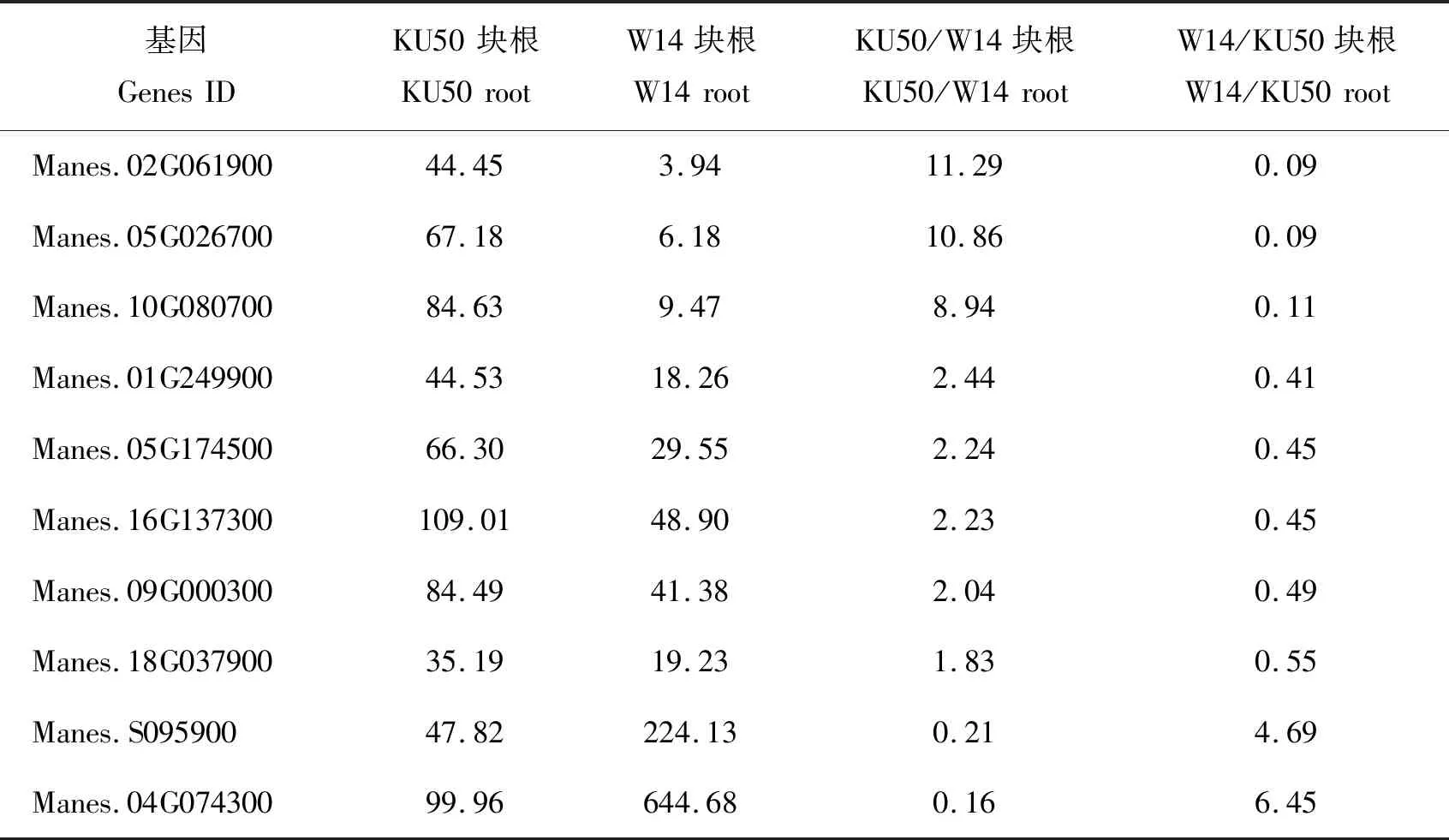
表1 10个 MebZIP在栽培种KU50和野生型W14块根中的转录本数量及比值Table 1 The transcription and ratio of ten MebZIP in the cultivated species KU50 and wild-type W14
表2 10个MebZIP基因实时定量分析所用引物序列Table 2 Primer sequences of ten MebZIP genes for qPCR
1.3 植物总RNA提取及单链cDNA的合成
使用RNA plant Plus Reagent植物总RNA提取试剂,购于天根(北京)公司。进行木薯总RNA的提取。RNA质量及浓度通过琼脂糖凝胶电泳和微量紫外分光光度计检测。使用Prime ScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒购于宝生物(大连)公司合成单链cDNA,并用木薯通用Actin引物检测第一链cDNA。RNA保存于-80 ℃,cDNA保存于-20 ℃。
1.4 10个木薯MebZIP与127个拟南芥AtbZIP氨基酸序列比对
在转录因子数据库(http://planttfdb.cbi.pku.edu.cn/)中搜索拟南芥bZIP基因,得到127个bZIP。下载拟南芥所有bZIP基因的氨基酸序列与木薯候选的10个bZIP基因的氨基酸序列经CLUSTAL W进行序列比对,之后使用MEGA 5.0构建系统进化树。进化树的构建使用NJ(Neighbor-Joining)法,并经1 000次Bootstrap统计检测。
1.5 MebZIP7和MebZIP9基因的克隆及MebZIP-GFP载体的构建
从木薯基因组数据库(https://phytozome.jgi.doe.gov)中搜索目的基因序列(从10个MebZIP中选择2个MebZIP),并用Primer-BLAST设计特异性扩增引物,引物序列信息:MebZIP7上游引物(5′TGTTCATGGTTGTTAGGAATTGGT 3′)和下游引物(5′TCCTTGCACCACACAAATGG 3′);MebZIP9上游引物(5′AAGAAACTGAACA-GGAACGTCTG 3′)和下游引物(5′CTTCCCTT-CCACTGCTATACCT 3′)。用大连宝生物公司的Primer STARMax DNA Polymerase,以KU50块根cDNA为模板进行基因扩增。PCR程序:98 ℃预变性5 s,98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸15 s,30个循环后72 ℃延伸5 s,用MEGA5.0进行测序后序列比对。
MebZIP基因插入pCAMBIA1302载体中,所用引物见表3。通过激光扫描共聚焦显微镜观察MebZIP-GFP的融合蛋白亚细胞定位。
表3 构建MebZIP-GFP载体所用引物Table 3 Primer sequences for constructing MebZIP-GFP plasmid
2 结果与分析
2.1 木薯MebZIPs在木薯栽培种和野生型中具有不同的表达谱
荧光定量表达分析结果,MebZIP1~MebZIP10在栽培品种KU50块根中的相对表达量均高于野生亚种W14,表达量比值在1.4~185.0倍,其中MebZIP9最高,MebZIP1最低,MebZIP7达到2.3倍,6个成员如MebZIP2、MebZIP3、MebZIP4、MebZIP7、MebZIP8和MebZIP9表达差异达到显著和极显著水平(图1(a))。 而在功能叶中,MebZIP4、MebZIP9和MebZIP10在栽培品种的相对表达量高于野生型,相差倍数>2(图1(b))。特别是MebZIP9在块根和功能叶中的相对表达量栽培品种均显著高于野生型,倍数在39~185。表明块根淀粉积累效率高的栽培品种块根中存在MebZIP成员的优势表达,且在功能叶中也有少数成员高表达。
2.2 系统分类表明MebZIP7和MebZIP9与ABA信号通路相关
从转录因子数据库(http://planttfdb.cbi.pku.edu.cn/)中搜索到拟南芥bZIP 127个,10个MebZIP与AtbZIP的蛋白质序列构建进化树。bZIP转录因子家族总共划分为10个亚族,分别为A、B、C、D、E、F、G、H、I和S亚族,而木薯MebZIP5、MebZIP7和MebZIP9属于bZIP家族的A亚族,MebZIP2、MebZIP3和MebZIP10属于S亚族,MebZIP1和MebZIP4属于G亚族,MebZIP8属于C亚族,MebZIP6属于B亚族(图2)。A亚族在 ABA信号转导中起重要作用,C亚族可能调控贮藏蛋白在拟南芥胚乳里的表达,G亚族在光信号转导和种子成熟过程中起作用,S亚族在蔗糖信号以及响应胁迫中起作用等。系统分类结果证明,MebZIP7和MebZIP9属于A亚族,归于ABF类,是ABA信号通路成员。
2.3 MebZIP7和MebZIP9定位于细胞核内
激光共聚焦显微镜下观察DAPI染色后的洋葱表皮细胞,MebZIP7-GFP和MebZIP9-GFP表达的蛋白均定位于细胞核,在细胞壁及细胞质内无绿色荧光,而对照试验CaMV35s::GFP在整个洋葱表皮细胞都有GFP分布(图3)。据此,可以确定MebZIP7和MebZIP9均具有细胞核定位特征。bZIP是一个大的转录因子家族,该试验证明木薯中这2个成员属于转录因子功能蛋白。
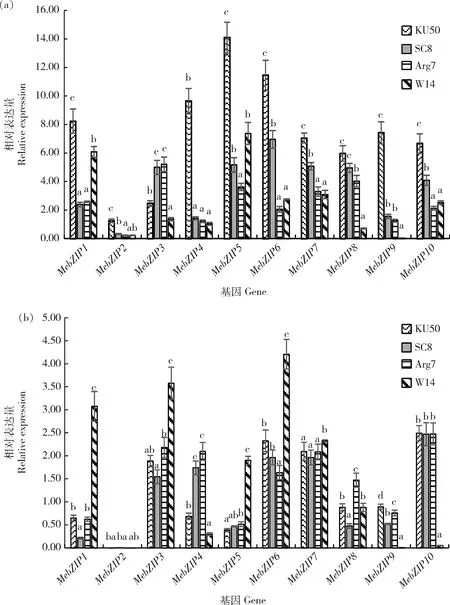
KU50,SC8和Arg7是栽培木薯;W14是野生木薯。KU50,SC8 and Arg7 are cultivated cassava. W14 is wild cassava.同组柱形图不同小写字母表示品种间表达差异显著(P<0.05)Different letters above the column indicate significant differences in expression between the two varieties of cassava.图1 10个MebZIP基因在栽培和野生型块根(a)与叶片(b)中的表达差异Fig.1 Tissue-specific expression of ten MebZIP genes in root (a) and leaves (b) of cultivated and wild species
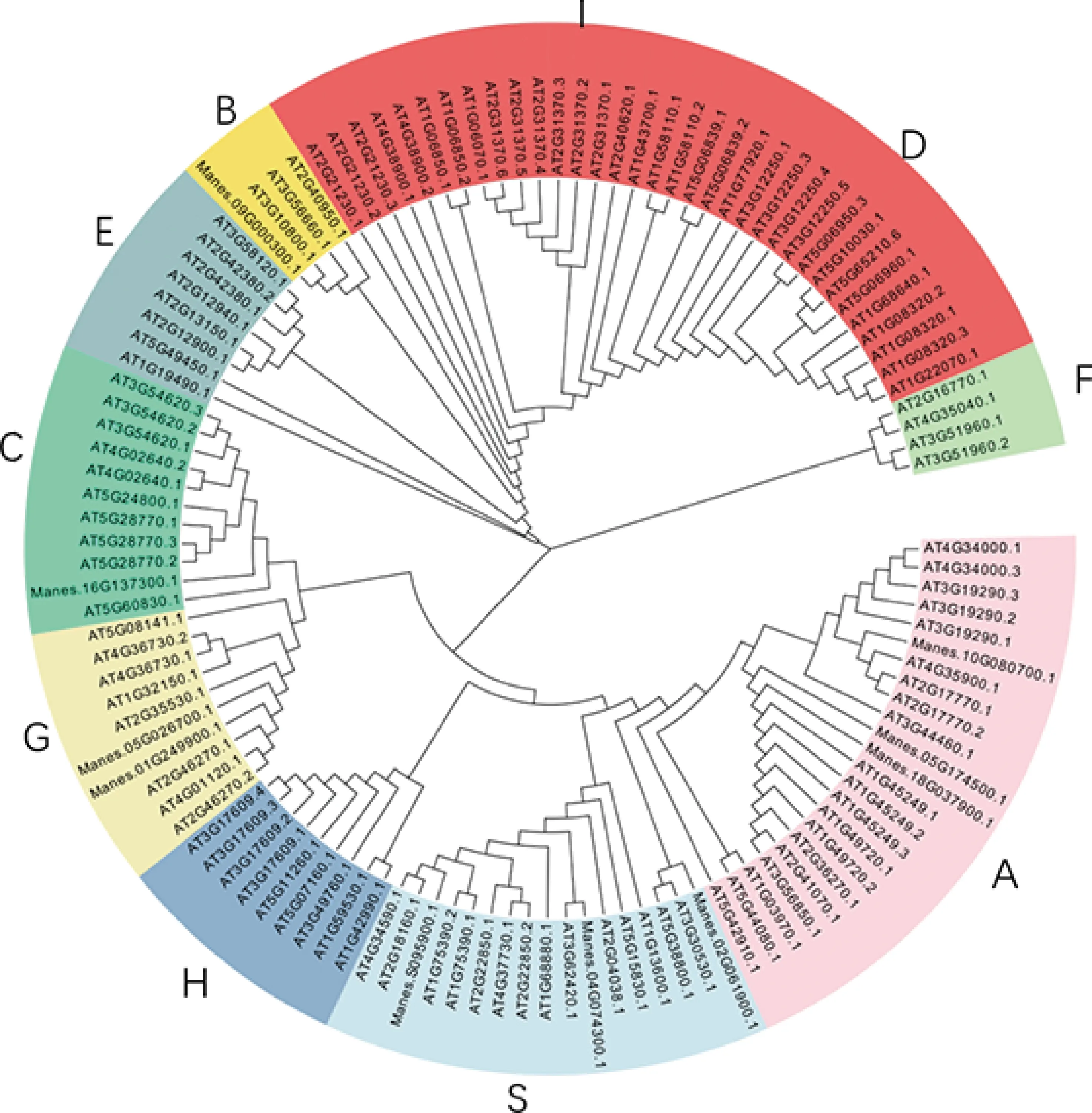
图2 构建10个MebZIP系统发育树Fig.2 Constructing phylogenetic tree of ten MebZIPs
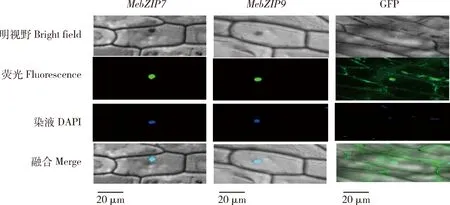
绿色,GFP是绿色荧光蛋白,激光共聚焦显微镜下发出绿色荧光;蓝色,DAPI染液染色,激光共聚焦显微镜下发出蓝色荧光。标尺:20 μmGreen,GFP are green fluorescent proteins,which emit green fluorescence under laser confocal microscopy; Blue,DAPI dye staining and emits blue fluorescence under laser confocal microscopy. Bar: 20 μm图3 MebZIP7和MebZIP9在洋葱表面亚细胞定位Fig.3 MebZIP7 and MebZIP9 locate in the nucleus of onion surface cell
2.4 MebZIP7和MebZIP9受外源ABA诱导上调表达
ABA处理木薯后1 h,MebZIP7被强烈诱导表达且相对表达量达到峰值,此时根中和叶片的相对表达量分别是对照的10.7和4.5倍;MebZIP7的相对表达量随处理时间的增加而逐渐降低,24 h时与初始水平一致(图4)。MebZIP9同样被ABA诱导上调,1 h根中的相对表达量达到峰值,是对照的6.3倍;在叶片中的相对表达量在6 h达到最高,是对照的4.5倍;MebZIP9在ABA处理下的相对表达量先升高后下降,24 h根中的相对表达量低于初始水平(图5)。尽管在幼苗培养条件下与自然生长发育条件有很大差异,仍然可以捕捉到木薯根和叶片中MebZIP7和MebZIP9受到外源ABA信号诱导而增强表达,说明2个bZIP成员确实参与ABA信号途径。
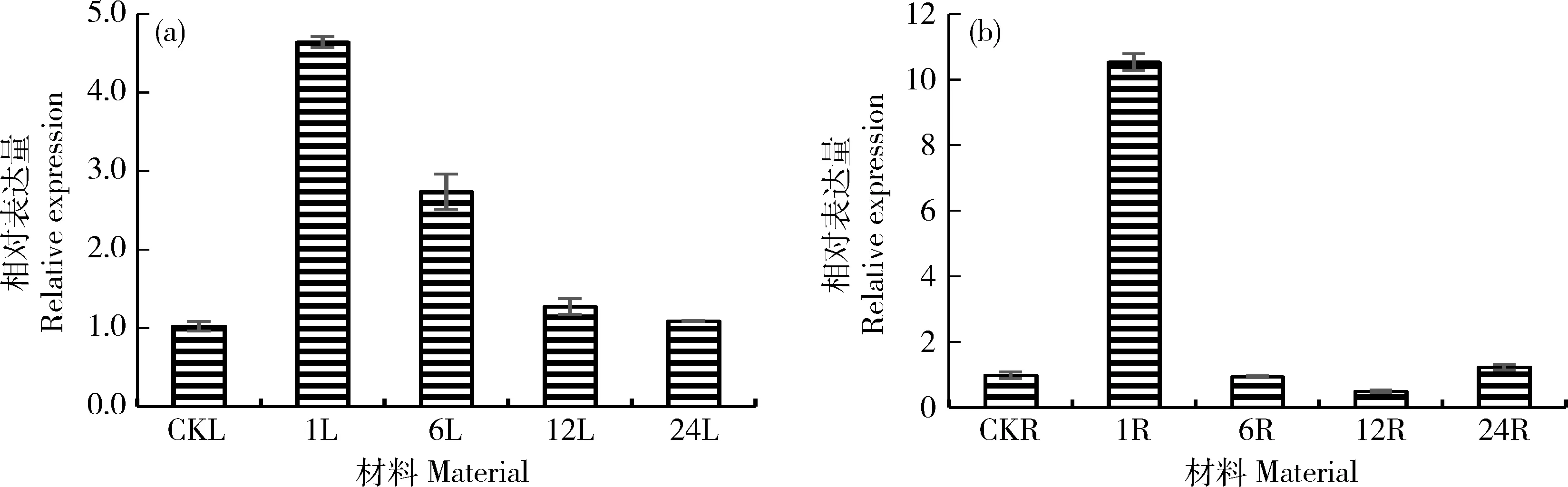
1L和1R:叶片,块根ABA处理1 h;6L和6R: 叶片,块根ABA处理6 h;12L和12R:叶片,块根ABA处理12 h;24和24R:叶片,块根ABA处理24 h。下同。1L and 1R, leaf and root are treated by ABA for 1 h; 6L and 6R, leaf and root are treated by ABA for 6 h; 12L and 12R,leaf and root are treated by ABA for 12 h; 24L and 24R, leaf and root are treated by ABA for 24 h. The same below. 图4 MebZIP7受ABA诱导在叶片(a)和块根(b)中的表达分析Fig.4 The expression profiles of MebZIP7 induced by ABA in leaf (a) and storage root (b)
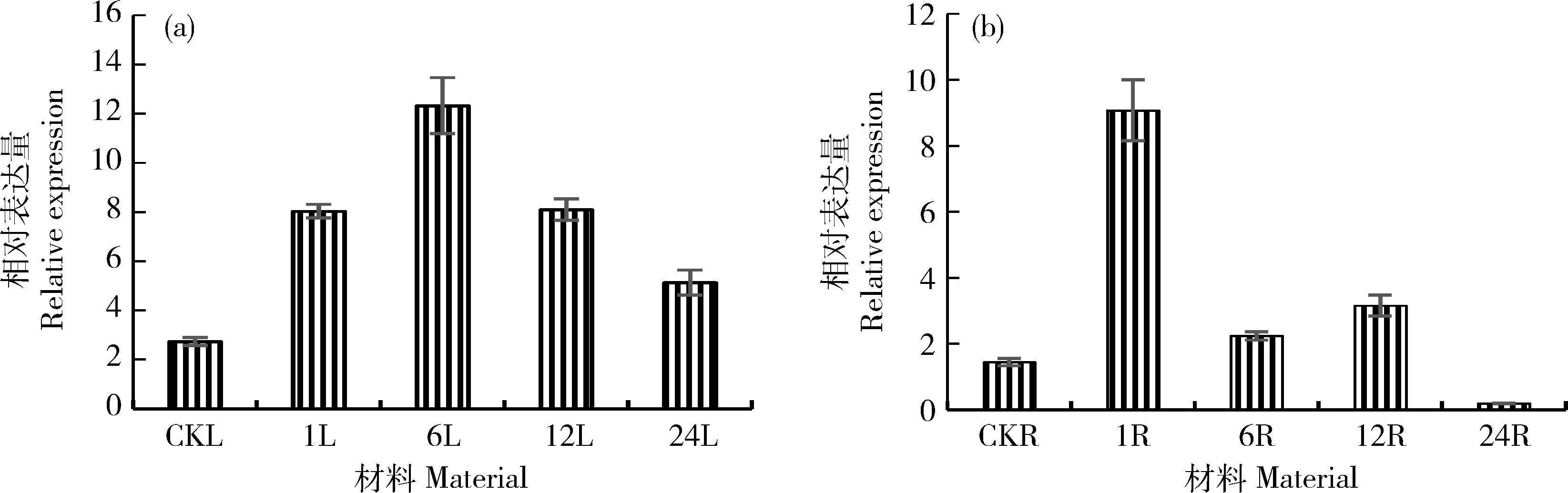
图5 MebZIP9受ABA诱导在叶片(a)和块根(b)中的表达分析Fig.5 Expression profiles of MebZIP9 induced by ABA in leaf (a) and storage root (b)
2.5 MebZIP9在栽培木薯中的转录活性高于野生型
对于另一个基因MebZIP7在栽培品种和野生型不同发育时期块根及叶片中均有表达,表达差异不能够明确区别。如在块根发育90 d,180 d时KU50、SC8和Arg7中表达量高于W14,而在210 d时差异不明显;叶片中,90 d时W14的表达量高于几个栽培品种,其他时间点表达量差异不显著(图6)。MebZIP9在栽培与野生型的块根和叶片中表现出完全不同的表达模式。在野生型W14整个生长期的块根和叶片中相对表达量均很低,而在不同木薯栽培品种不同发育时期的块根和叶片中均保持较高表达量,块根中表达量更高一些。其表达量总体有前期高后期下降的趋势,如在KU50块根形成期相对表达量最高,在块根膨大期和块根成熟期的相对表达量相同,最高值与最低值相差2倍;在SC8块根形成期和块根膨大期的表达量相近,是块根成熟期的1.4倍;在Arg7 块根膨大期相对表达量高,是块根形成期和成熟期的3.6倍(图7)。此外,MebZIP7比MebZIP9在块根和叶片发育不同时期整体表达量更高。
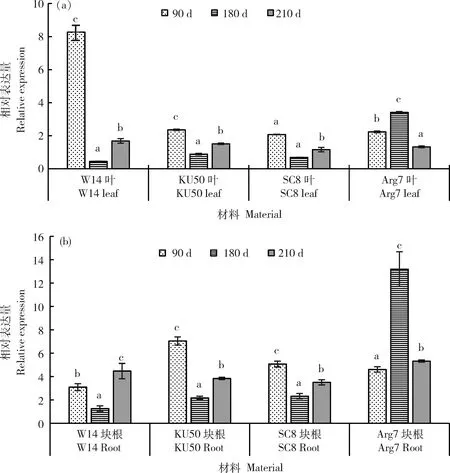
同组不同小写字母表示表达量差异显著(P<0.05)系指每组材料间表达差异显著性。下同。The marked in the figure refers to the significance of difference in expression quantity between each group of materials. The same below.图6 MebZIP7在木薯栽培型及野生型叶片(a)和块根(b)中的差异表达Fig.6 Spatio-temporal expression profiles of MebZIP7 in leaf (a) and root (b) of four cassava varieties
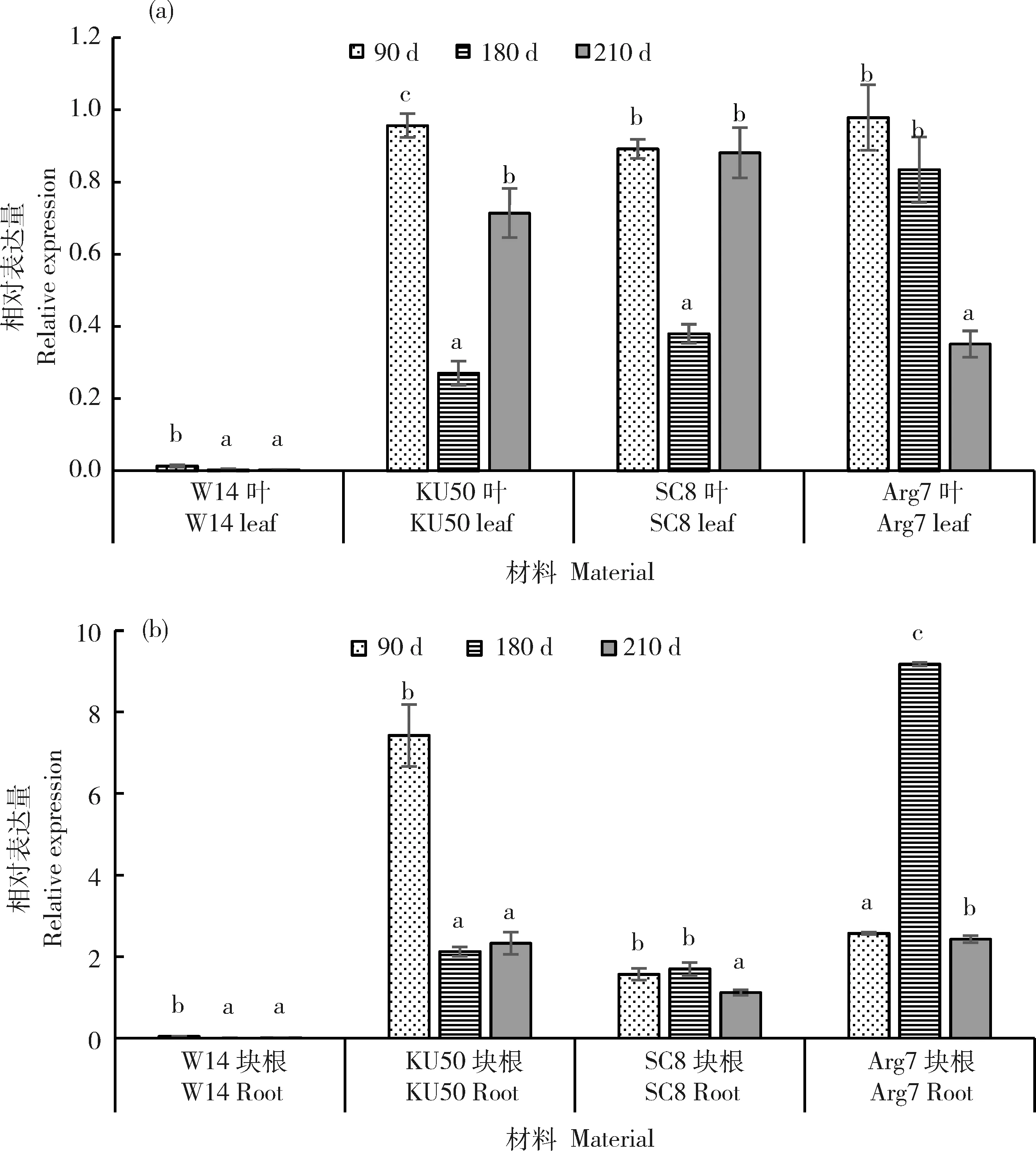
图7 MebZIP9在木薯栽培品型及野生型叶片(a)和块根(b)中的差异表达Fig.7 Spatio-temporal expression profiles of MebZIP9 in leaf (a) and root (b) of four cassava varieties
3 讨 论
3.1 木薯bZIP成员在块根中有优势表达,可能与其淀粉积累效率有关
MebZIP9在栽培木薯块根中的转录活性显著高于野生型,MebZIP9在同一木薯同时期块根和叶片中的表达水平低于MebZIP7。
MebZIP7在栽培种块根形成期(90 d)和块根膨大期(180 d)块根中的相对表达量都显著地高于野生型,MebZIP9在栽培种整个生长期块根中的相对表达量都显著的高于野生型,特别是MebZIP9在W14块根中几乎不表达。栽培木薯淀粉含量显著高于野生型[3],木薯栽培品种淀粉含量(干重)为28%~32%,野生型W14淀粉含量是3%~5%。综上所述,推测MebZIP7和MebZIP9可能参与木薯块根淀粉合成。现有研究发现:bZIP可以调节淀粉合成,例如,水稻C亚族的OsbZIP58在胚乳中高表达,其蛋白可直接与6个淀粉合成相关基因(OsAGPL3,Wx,OsSSIIa,SBE1,OsBEIIb和ISA2)的启动子区结合并调控它们的表达活性,是水稻籽粒中淀粉合成的重要调节因子[16]。玉米I亚族的ZmbZIP91可与玉米淀粉合成相关基因启动子的ACTCAT元件结合,进而调节玉米淀粉相关基因的表达[17]。据此推测MebZIP可能调节木薯块根淀粉合成相关基因的表达或淀粉合成酶的活性。
3.2 木薯bZIP成员受外源ABA诱导表达
高浓度的ABA抑制水稻籽粒灌浆期淀粉合成基因的表达和淀粉合成酶的酶活,导致籽粒充实率降低[18],而适中浓度ABA能增强水稻籽粒灌浆期SuSy的活性[19]。拟南芥叶片中β-淀粉酶1(BAM1)和α-淀粉酶3(AMY3)受ABA诱导表达,导致BAM1酶活提高,叶片淀粉含量降低[20]。MebZIP7和MebZIP9受ABA诱导表达,原因可能是:一方面,MebZIP7、MebZIP9是ABF(ABRE),ABF是ABA信号通路中的成员[21- 22],ABA结合PYL后破坏了SnRK2蛋白激酶和PP2C的相互作用,进而激活SnRK2蛋白激酶使ABF磷酸化,即ABF (MebZIP7和MebZIP9)表达量增加,从而调节响应ABA信号相关基因的表达。另一方面相关文献报道[13-14]bZIP响应各种非生物胁迫,植物做出一系列抵抗外源ABA胁迫的机制,响应ABA的相关基因转录活性增强,因而与其上游启动子结合的MebZIP转录因子的表达量增高。综上推测栽培木薯中MebZIP受适量ABA诱导高表达并与淀粉合成相关基因的启动子区结合,调节块根淀粉合成。
此外,转录因子在植物里的表达水平很低[23],本研究选用管家基因Manes.02G061900[14],其在木薯各组织部位及胁迫处理后的表达水平都很稳定,而且比常用的木薯Actin基因Manes.12G150500低1.3倍,使用Manes.02G061900做内参基因,便于对表达量低的转录因子进行分析。MebZIP7和MebZIP9在栽培木薯块根中的表达水平显著高于野生型且受ABA诱导表达,为后续分析MebZIP在沟通ABA信号通路和块根淀粉合成途径中的作用提供有效借鉴。

