桦木酸对人胃癌SGC-7901细胞增殖的影响*
陈亚楠, 邵淑丽,2Δ, 何孟奇, 黄 鑫, 张伟伟,2, 张珍珠,2
(1. 齐齐哈尔大学生命科学与农林学院, 齐齐哈尔 161000; 2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 齐齐哈尔 161000)
胃癌(gastric carcinoma, GC)是一种预后极差的恶性肿瘤[1]。目前早期胃癌已经能够得到较好的控制,晚期胃癌仍以化疗为主要治疗方式且难以治愈[2]。尽管化疗的方法在治疗胃癌中起到显著作用,但是化疗时间长,价格高昂,且对患者身心造成一定伤害,因此急需寻找合适的胃癌治疗药物。在胃癌治疗中,化疗药物5-Fu具有较大的毒副作用,如能寻找一种毒副作用较低的抗癌新药,将会对胃癌治疗提供新的方向。以往研究发现,已有多种天然产物在肿瘤治疗中发挥重要作用。
桦木酸(betulinic acid,BA)是一种天然存在于桦树皮中的五环三萜类化合物,具有抗病毒、抗炎症的作用[3,4]。已有研究表明,桦木酸可以通过诱导线粒体凋亡,进而抑制耐紫杉醇人肺癌H460细胞增殖[5];还可通过激活AMPK信号抑制胰腺癌细胞增殖[6]。然而,桦木酸对人胃癌SGC-7901细胞增殖影响的相关研究鲜有报道。因此本实验以人胃癌SGC-7901细胞为研究对象,探究桦木酸对人胃癌SGC-7901细胞增殖及其对细胞周期的影响, 为桦木酸在治疗胃癌方面的进一步应用提供理论及实验依据。
1 材料与方法
1.1 实验细胞
人胃癌SGC-7901细胞购自中国医学科学院肿瘤研究所。
1.2 实验试剂
胎牛血清(Biological Industries,以色列);桦木酸(汉博生物,上海);5-氟尿嘧啶(生工生物,上海);RPMI-1640培养基(Gibco,美国);吉姆萨染液(普立科生物,重庆);反转录试剂盒(全式金生物,北京);UN1Q-10柱式Trizol总RNA提取试剂盒、全蛋白提取液、Power 2×SYBR real-time PCR premixture试剂(百泰克生物,无锡);cyclin B1、cyclin D1、β-actin抗体(博奥森,北京);BeyoClickTMEdU-488体外成像试剂盒(碧云天生物,上海)。
1.3 细胞培养及药物配制
用于人胃癌SGC-7901细胞的RPMI 1640完全培养基含有10%胎牛血清,100 U/ml青霉素和0.1 mg/ml链霉素;细胞的培养条件为37℃、5%CO2以及饱和湿度;20 mg桦木酸标准品溶于4 ml DMSO后分别配置成终浓度为10 μg/ml,20 μg/ml,40 μg/ml,80 μg/ml,100 μg/ml的工作液;阳性对照组将1 mg 5-Fu溶于5 ml DMSO中后由培养基配置成终浓度为30 μg/ml工作液[7]。
1.4 台盼蓝拒染法绘制细胞生长抑制曲线
将细胞以1×105cells/ml浓度接种于6孔板中培养至对数生长期;桦木酸处理后培养24 h、48 h、72 h后收集细胞进行染色,光学显微镜下进行细胞计数;计算半数抑制浓度值IC50值。细胞的增殖抑制率=1-(试验组的平均活细胞数/对照组的平均活细胞数)×100%。并绘制生长抑制曲线。
1.5 GIEMSA染色法检测克隆形成率
将人胃癌SGC-7901细胞于6孔板中进行培养,加入不同浓度的桦木酸处理48 h,当6孔板中出现肉眼可见的细胞克隆时,终止培养。多聚甲醛固定后使用GIEMSA染色20 min后于倒置显微镜下对大于10个细胞的克隆进行计数,并计算克隆形成率。
1.6 EdU法检测细胞的增殖
将人胃癌SGC-7901细胞于6孔板中培养,分别加入不同浓度的桦木酸,处理48 h后按照BeyoClickTMEdU-488体外成像试剂盒操作方法对细胞增殖进行检测。
1.7 流式细胞术检测细胞周期
人胃癌SGC-7901细胞接种于培养瓶中, 培养至对数生长期。加入不同浓度的桦木酸处理48 h, 通过收集细胞、重悬、染色、上机的流程,具体按照Chen Z等人[8]的方法进行操作。
1.8 qRT-PCR检测cyclin B1、cyclin D1的mRNA表达
在细胞的对数生长期以不同浓度的桦木酸处理, 培养48 h后收集各组细胞, 提取总RNA后反转录成cDNA, 进行qRT-PCR检测,所用引物序列见表1。实验数据采用2-ΔΔCt计算获得细胞中细胞周期相关蛋白cyclin B1、cyclin D1 mRNA的相对表达量。

Tab. 1 Primer sequences for qRT-PCR analysis
1.9 Western blot检测cyclin B1、cyclin D1的蛋白表达
细胞培养至对数生长期,加入不同浓度的桦木酸处理48 h后,加入RIPA裂解液裂解细胞并提取总蛋白,经电泳、转膜、封闭、一抗孵育/二抗孵育[9]后用红外激光扫描成像系统进行检测,用Image J 软件进行灰度分析。
1.10 统计学处理
2 结果
2.1 人胃癌SGC-7901细胞生长抑制曲线
利用台盼蓝拒染法检测桦木酸对人胃癌SGC-7901细胞生长的抑制作用,并绘制生长抑制曲线。在一定浓度范围内,随着处理时间增加,细胞抑制率逐渐增大,说明桦木酸能够抑制人胃癌SGC-7901细胞增殖,且呈时间和剂量依赖性(表2)。桦木酸分别处理24 h、48 h、72 h后人胃癌SGC-7901细胞的IC50值分别为44.046 μg/ml、21.055 μg/ml、 10.338 μg/ml。

Tab. 2 The growth inhibition rate of SGC-7901 cells (n=3)
2.2 桦木酸对人胃癌SGC-7901细胞克隆形成率的影响
为研究桦木酸对人胃癌SGC-7901细胞克隆形成率的作用,通过不同浓度的桦木酸处理细胞48 h后,采用GIEMSA染色检测细胞克隆形成率的情况。与桦木酸0 μg/ml组和5-Fu对照组相比,随桦木酸浓度增加,细胞克隆形成率均显著下降(P均< 0.05,表3),且在桦木酸浓度为30 μg/ml时下降最显著(P<0.01,表3)。实验结果表明,桦木酸能够抑制人胃癌SGC-7901细胞的增殖。
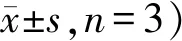
Tab. 3 Effects of betulinic acid on the clone formation rate of human gastric cancer SGC-7901 cells (%,
2.3 桦木酸对人胃癌SGC-7901细胞增殖的影响
用不同浓度的桦木酸处理人胃癌SGC-7901细胞48 h后,采用EdU检测细胞增殖情况。如图1、表4所示,与桦木酸0 μg/ml组相比,随桦木酸浓度的增加,细胞增殖率显著降低,分别降低19.94%,30.16%,35.16%(P均<0.05)。与5-Fu阳性对照组相比,桦木酸浓度为20 μg/ml,30 μg/ml时,细胞增殖率均显著低于5-Fu组(P均<0.05)。实验结果表明,桦木酸能够显著抑制人胃癌SGC-7901细胞的增殖(图1,见彩图页Ⅲ)。

Fig.1 Effects of BA on SGC-7901 cells proliferation(Bar=50 µm,n=3)
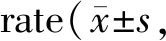
Tab. 4 The relative EdU positive n=3)
2.4 桦木酸对人胃癌SGC-7901细胞周期的影响
不同浓度桦木酸作用48 h后,通过流式细胞术检测桦木酸对人胃癌SGC-7901细胞周期的影响。与桦木酸0 μg/ml组相比,随着桦木酸浓度增加,G0/G1期细胞所占比例显著升高,而S期和G2期细胞所占比例显著降低(P均<0.05,表5),10 μg/ml桦木酸处理的效果与阳性对照5-Fu处理效果相似。实验结果表明桦木酸将人胃癌SGC-7901细胞阻滞在G1/G0期,从而抑制细胞增殖。
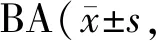
Tab. 5 Changes of cell cycle after treated with n=3)
2.5 桦木酸对细胞周期蛋白cyclin D1和cyclin B1 mRNA表达的影响
用不同浓度桦木酸处理细胞48 h后,利用qRT-PCR分析细胞周期蛋白cyclin D1和cyclin B1的mRNA表达情况。与桦木酸0 μg/ml相比,不同浓度桦木酸处理人胃癌SGC-7901细胞,cyclin D1和cyclin B1的mRNA表达明显下降(P<0.01,表6),10 μg/ml桦木酸处理的效果与阳性对照5-Fu的效果相似。

Tab. 6 The effects of BA on mRNA levels of cyclin D1 and cyclin n=3)
2.6 桦木酸对细胞周期蛋白cyclin D1和cyclin B1蛋白表达的影响
不同浓度桦木酸处理人胃癌SGC-7901细胞48 h后,利用Western blot检测cyclin D1和cyclin B1蛋白的表达。如图2、表7所示。与桦木酸0 μg/ml相比,不同浓度桦木酸处理人胃癌SGC-7901细胞,cyclin D1和cyclin B1的mRNA表达明显下降(P<0.05),10 μg/ml桦木酸处理的效果与阳性对照5-Fu的效果相似。表明随桦木酸可以降低人胃癌SGC-7901细胞周期蛋白表达。

Fig. 2 The effects of BA on protein levels of cyclin D1 and cyclin B1
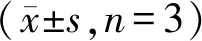
Tab. 7 The effects of BA on protein levels of cyclin D1 and cyclin B1
3 讨论
胃癌作为引起人类死亡的主要原因之一,越来越受到大家的关注[10]。迄今为止,化疗是治疗肿瘤最常规的手段,其作用机制是通过抑制肿瘤细胞增殖,从而有效控制肿瘤的发展。5-Fu作为胃癌治疗常规的化疗用药已广泛使用,但其治疗剂量与中毒剂量极为接近,毒副作用较大[11]。与化疗药物相比,中草药具有毒副作用较小、价格相对便宜等特点。目前,黄芩素已被证实能够抑制口腔癌细胞增殖[12],同时,杨芽黄素也被报道与前列腺癌凋亡相关[13]。除此以外,雷公藤碱等多种天然产物均已在抑制肿瘤细胞增殖方面取得较为显著的效果[14]。桦木酸是从桦树皮中提取的天然成分,已被发现具有抑制肿瘤增殖的作用。相关研究表明,桦木酸通过诱导卵巢癌A2780细胞凋亡,抑制细胞增殖[15]。在乳腺癌MCF-7细胞的研究中发现,桦木酸可激活GRP78触发ER应激介导的细胞凋亡[16],以及通过PI3K-Akt信号通路调控宫颈癌HeLa细胞增殖等功能[17]。据此,本实验以5-Fu处理组为阳性对照,首先通过台盼蓝拒染法、GIEMSA染色法、EdU等实验手段,探究桦木酸对人胃癌SGC-7901细胞增殖的影响。本实验结果表明,随桦木酸浓度升高,SGC-7901细胞生长抑制率显著升高,克隆形成率和细胞增殖率均明显降低。可见桦木酸可以抑制人胃癌SGC-7901细胞增殖。
细胞周期的失调是癌症恶性增殖的标志[18]。细胞周期由相关的细胞周期蛋白所调控[19],其中cyclin B1和cyclin D1可以分别调控细胞G2/M和G1/S期的转换过程,在细胞周期调控方面发挥重要作用。本实验首先利用流式细胞术检测桦木酸处理48 h后人胃癌SGC-7901细胞的细胞周期,发现随桦木酸浓度升高,细胞G1/G0期细胞占比显著升高;随后通过qRT-PCR和Western blot分别检测相关cyclin B1、cyclin D1的mRNA和蛋白表达水平。结果表明,cyclin B1、cyclin D1的mRNA和蛋白表达水平均降低,进而影响细胞周期,且在桦木酸浓度为30 μg/ml效果最显著。
综上所述,桦木酸通过下调cyclin B1和cyclin D1基因和蛋白表达,将人胃癌SGC-7901细胞阻滞在G1/G0期,从而抑制细胞增殖,为桦木酸的开发应用提供理论依据。

