小麦RCAR基因家族的鉴定、进化与逆境响应
史梦梦, 温思钰, 赵佳佳, 乔玲, 武棒棒, 郑兴卫,*, 郑军,*
(1. 山西大学生物工程学院,太原030006;2.山西农业大学小麦研究所,山西 临汾 041000)
脱落酸(abscisic acid,ABA)是调节植物生长发育的重要激素,参与植物的胚胎发生、种子发育、侧根发生、叶片衰老和气孔关闭等过程,是植物响应干旱胁迫的关键信号分子[1],而ABA受体是ABA信号通路领域研究的核心。2009年,中国、美国、日本和欧洲的研究小组几乎同时证实了RCAR(regulatory components of ABA receptor)家族是ABA的直接受体[2-3],是ABA调控的核心元件。RCAR(也称PLY)家族成员具有RCAR-like结构域,属于结合疏水配体保守结构域SRPBCC(START/RHO-α-C/PITP/Bet-v1/CoxG/CalC)家族,通过深层疏水配体结合囊与ABA结合。逆境胁迫下ABA与RCAR结合后抑制下游蛋白磷酸酶(PP2C)的活性,从而恢复蛋白磷酸激酶活性,参与抵御逆境胁迫[4]。
拟南芥中RCAR家族共有14个成员,分别为RCAR1~RCAR14,除了AtRCAR7以外,可在植物体内激活ABA下游基因的表达[5-9],提高植物抵御逆境胁迫的能力,不同成员间表达水平不同,功能上存在冗余。AtRCAR5过表达能显著提高种子萌发、幼苗生长和气孔开闭等过程中对ABA 的敏感性,还能提高抗旱能力[10-11];AtRCAR1过表达诱导叶片提前衰老,使水分流向发育中组织,显著提高拟南芥抗旱能力[12];同时敲除AtRCAR1和AtRCAR3使侧根生长静止期延长,与仅敲除AtRCAR3相比,初生根和侧根都对ABA的敏感性降低[13]。可以看出,RCAR基因家族可显著提高拟南芥的抗旱能力,且不同成员参与调控机制存在差异。
水稻中RCAR基因也参与逆境胁迫调控,多数研究主要集中在旱胁迫方面。Kim等[14-15]从水稻基因组中筛选出13个RCARs,其中OsRCAR5能提高种子萌发和幼苗阶段对ABA的敏感性,增强成株期抗旱和抗盐碱能力。OsRCAR3和OsRCAR9也参与水稻的非生物胁迫,过表达能够提高水稻耐旱性和耐冷性[16]。此外,玉米中有13个RCARs,ZmRCAR3、ZmRCAR9、ZmRCAR10和ZmRCAR13的过表达均可提高ABA敏感性,增加脯氨酸积累,进一步证实RCARs在旱胁迫中具有重要作用[17-19]。小麦是重要的粮食作物,非生物胁迫是小麦减产的主要因素,而小麦是异源六倍体,抵御非生物胁迫的调控机制较为复杂[20],随着高质量基因组序列的公布,抗逆相关基因资源的挖掘亟待开展。本研究从小麦基因组中分离RCAR家族基因,分析了家族成员序列、表达以及进化特性,以期为阐明小麦RCAR基因家族在非生物胁迫中的调控机制奠定基础。
1 材料与方法
1.1 数据来源
拟南芥、水稻的RCARs基因和蛋白序列信息参考TAIR数据库(https://www.arabidopsis.org/index.jsp)和国家水稻数据中心(http://www.ricedata.cn/gene/index.htm),玉米和大麦的基因组数据参考JGI数据库(https://phytozome.jgi.doe.gov/pz/portal.html),六倍体小麦基因组序列信息来源于IWGSC数据库(http://www.wheatgenome.org/)。
1.2 小麦RCAR基因的鉴定
利用拟南芥和水稻RCAR基因序列对小麦全基因组进行本地Blast,设置E-value<1e-5,初步筛选出小麦RCAR家族候选基因。Pfam数据库(http://pfam.xfam.org)和SMART数据库(http://smart.embl-heidelberg.de/)验证蛋白保守结构域。利用ExPASy ProtParam(https://web.expasy.org/protparam/)分析小麦RCAR蛋白的分子量、等电点和疏水性等理化性质,CELLO(http://cello.life.nctu.edu.tw/)进行亚细胞定位预测。
1.3 基因系统进化分析
利用MEGA6.0软件的MUSCLE默认参数设置生成多序列比对,使用MEGA6.0软件最大似然法(maximum likelihood,ML),bootstrap number设为1 000次重复,构建系统发育树。
1.4 基因结构和蛋白质序列分析
GSDS2.0(http://gsds.cbi.pku.edu.cn/)分析TaRCARs基因结构,MEME Suite 4.12.0(http://meme-suite.org/index.html)搜索蛋白质序列保守基序,最大保守基序数目设为10,每一基序长度设为6~300个氨基酸残基。
1.5 启动子顺式作用元件分析
截取起始密码子上游3 000 bp的基因组序列作为启动子区,利用PlantCARE(http://bioinformatics.pAet.ugent.be/webtools/plantcare/html)数据库分析顺式作用元件。
1.6 基因家族的表达模式分析
从expVIP数据库检索TaRCARs在14个组织器官中的表达数据,相关表达数据进行log2转换处理,分析家族成员的表达模式。
1.7 基因进化和正选择检测
在构建进化树的基础上,通过PAML软件利用树枝模型法(branch model)分析系统发育树中每个Group的进化速率,似然比测验(LRTs)用于检测无效模型和备择模型;在检测选择位点时,利用BEB(bayes empirical bayes)方法计算每个位点在不同选择模型的后验概率。
1.8 基因表达检测
挑选完整无损、大小均匀一致的“中国春”种子(本实验室保存),将露白种子种于育苗盘,在光温培养箱中16 h光照/8 h黑暗,23 ℃条件下生长一周,进行胁迫(30%PEG和42 ℃)处理。处理0、6、12、24和48 h取根、茎和叶组织,液氮速冻,-80 ℃ 保存。RNA提取和cDNA的制备参考Zhao等[12]方法。不同组织样品RNA提取后,采用SpectraMax QuickDrop 超微量分光光度计(Molecular Devicess, America)测定核酸浓度,取不同组织RNA等浓度混合反转录。Realtime-PCR按照TaKaRa SYBR PremixExTaq使用说明,在ABI7300 Realtime PCR仪(Thermo Fisher, America)上运行反应程序,甘油醛-3-磷酸脱氢酶基因GAPDH(GenBank登录号: EF592180.1)作为内参,2-ΔΔCT[21]计算目标基因的相对表达量。
2 结果与分析
2.1 TaRCAR基因家族信息
小麦基因组中共检索到27个RCARs,除第5和6同源群外,其余同源群均有分布。在染色体上分布并不均匀,第1同源群中分布最多,为3个,第3和7同源群中均为2个,第2和4同源群中分布的数目均为1个,且部分同源群间无缺失,将RCAR基因命名为TaRCAR1-1AS~TaRCAR9-7DL(表1)。TaRCAR分子量为19 177.66~30 169.25 Da之间,等电点差异较大,介于4.97~9.17之间。亚细胞定位预测发现除了TaRCAR8定位于细胞质上和TaRCAR5-3BL定位于细胞核上外,其余TaRCARs均定位于叶绿体上。此外,TaRCAR1-1AS、TaRCAR4-2DS、TaRCAR5-3DS、TaRCAR7-4AS和TaRCAR9还定位于细胞核上,TaRCAR3-1AL、TaRCAR3-1BL、TaRCAR4-2AS、TaRCAR4-2BL和TaRCAR6-3DL还定位于线粒体上。TaRCAR6-3BL、TaRCAR7-4BL和TaRCAR7-4DL均是疏水蛋白,其余为亲水蛋白。
2.2 TaRCAR蛋白的系统进化分析
选取拟南芥、水稻、玉米、大麦和小麦的RCAR蛋白构建系统发生树,结合拟南芥和水稻基因分析发现,RCAR蛋白主要分为6个亚组(图1),分别为GroupA~F,HvRCAR与TaRCAR亲缘关系最近, 其次为玉米、水稻和拟南芥。其中GroupD成员最多,为22个,含有9个TaRCARs;GroupA、GroupB和GroupF成员分别为14、10和21个,TaRCARs数目均有6个;GroupC和GroupE成员最少,是拟南芥特有分支,GroupC中AtRCAR8~10较为特殊,均以单体的形式存在,在没有ABA的情况下能够抑制PP2Cs[22-23];GroupE分支中的AtRCAR7不依赖ABA就能抑制PP2C家族的成员PP2CA,但不能抑制成员ABI1、HAB1和AHG1[24],推测拟南芥的这6个成员在进化的过程中发生了功能分化。GroupA和GroupB组中仅包含禾本科植物RCAR蛋白序列,暗示其可能分化于双子叶植物分化之后。GroupD和GroupF组中同时包含拟南芥和禾本科植物RCAR蛋白,且有2组旁系同源AtRCAR,推测这类基因的分化在单、双子叶植物分化之前以物种特有的方式进行扩张。
2.3 TaRCAR基因结构与蛋白质保守基序分析
27个TaRCARs大多没有内含子,只有TaRCAR1(TaRCAR1-1AS、TaRCAR1-1BS、TaRCAR1-1DS)和TaRCAR8(TaRCAR8-7AL、TaRCAR8-7BL、TaRCAR8-7DL)中有2个内含子(图2)。TaRCARs保守基序个数为4~6,其保守基序类型及排列顺序基本一致,基序1、2、3和4的保守性最高,除TaRCAR3-1BL和TaRCAR6-3BL的基序3外,所有TaRCARs均具有基序1、2、3和4。基序8、9和10的保守性相对较低,基序8只在TaRCAR7-4BL和TaRCAR7-4DL存在,基序9只在TaRCAR3中发现,基序10仅存在于TaRCAR1和TaRCAR5。

表1 小麦RCAR家族成员鉴定及蛋白质理化分析Table 1 Identification and protein physic-chemical analysis of the wheat RCAR gene family
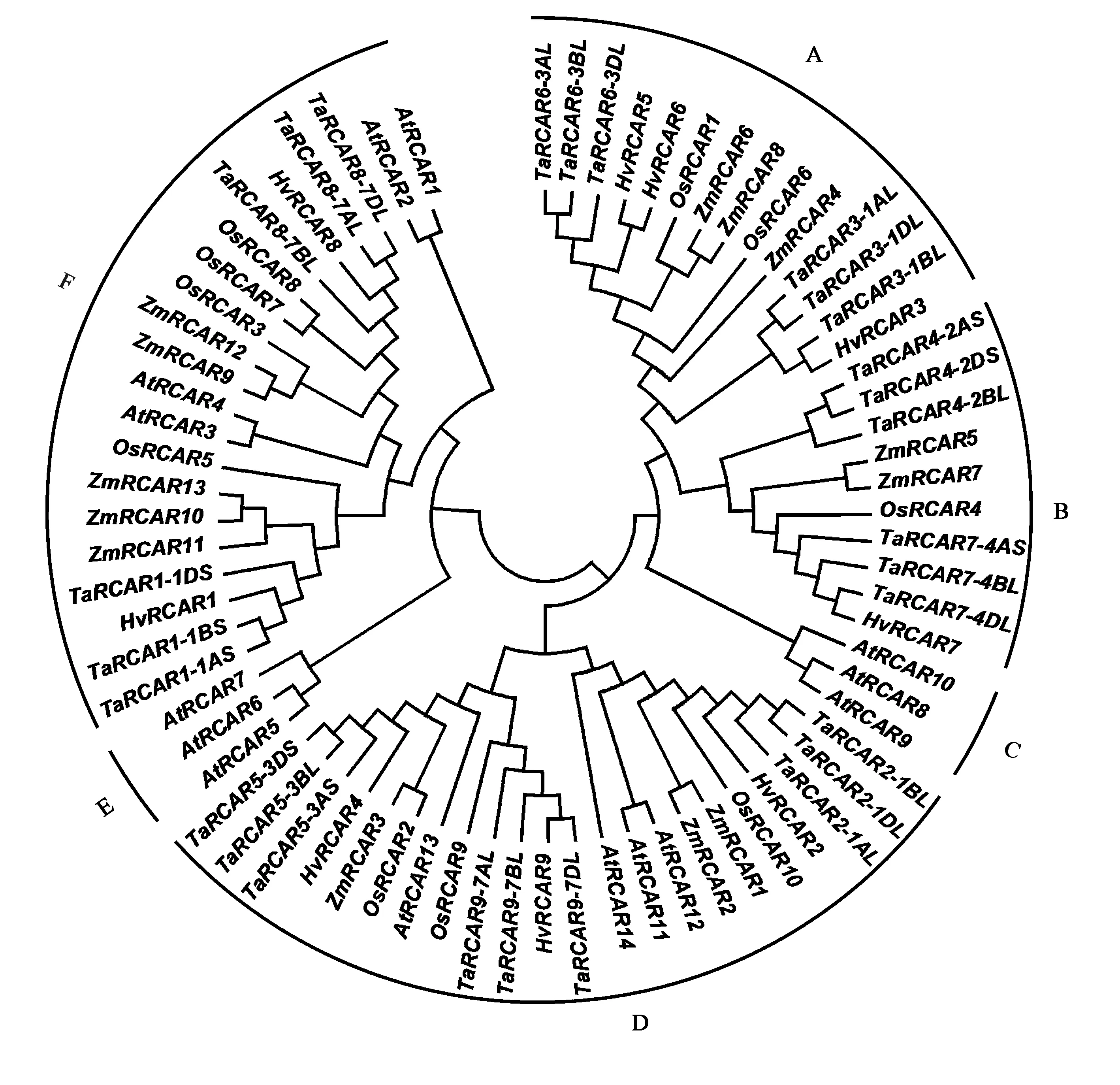
注:At—拟南芥;Os—水稻;Zm—玉米;Hv—大麦;Ta—小麦。Note: At—A. thaliana; Os—O. sativa; Zm—Z. mays; Hv—H. vulgare; Ta—T. aestivum.图1 不同物种RCAR蛋白进化树分析Fig.1 Phylogenetic tree of RCAR proteins in different species

Motif 1: REVTVVSGLPATTSTERLEILDDERHVLSFRVVGGEHRLRNYRSVTTVHE (50 aa); Motif 2: HAPGAGQCTSAVVQRIAAPV AAVWSVVRRFDQPQAYKHFVRSCALVAGDG (50 aa); Motif 3: DGPPGTVVVESYVVDVPDGNTEEDTRMFVDTVVKCNLQSLARVAEK LAAA (50 aa); Motif 4: AEVPGEVARHH (11 aa); Motif 5: MPYPASRPSLQQHARIASGSG (21 aa); Motif 6: GGGLGGGGD RIWRPWDEAAVG (21 aa); Motif 7: MEAHMERALREGVTE (15 aa); Motif 8: MPCIPVSSPSIQHHNHNHHHRVLAGVG VGMGCGAEAVVAAAGTAGMRCRE (50 aa); Motif 9: GWKAAAHAASC (11 aa); Motif 9: SPPPPDEQ (8 aa).图2 TaRCAR基因结构和蛋白质保守基序分析Fig.2 Gene structure and conserved motifs of TaRCAR
2.4 TaRCARs表达模式分析
分析TaRCARs在胚芽鞘、根、茎、叶、节间、旗叶、小穗、雄蕊、雌蕊、颖壳、外稃、芒、籽粒和胚乳组织表达数据并绘制热图(图4)。TaRCARs存在两种表达模式:其中TaRCAR1、TaRCAR2、TaRCAR4和TaRCAR7是组成型表达,TaRCAR3、TaRCAR5、TaRCAR6、TaRCAR8和TaRCAR9为组织特异性表达。TaRCAR1和TaRCAR2在叶、节间和旗叶中的表达量较高,籽粒发育中表达量较低;TaRCAR5和TaRCAR6只在根中表达,TaRCAR8仅在籽粒和胚乳中表达。此外,TaRCARs部分同源群间也存在差异,TaRCAR8-7AL和TaRCAR8-7DL在胚乳中表达,而TaRCAR8-7BL在胚乳中未检测到;TaRCAR9中仅有TaRCAR9-7DL在雌蕊中有表达。TaRCARs表达模式不同,部分同源群间也发生了分化,暗示TaRCARs功能具有一定的多样化,在不同生长发育过程中行使功能。
2.5 TaRCARs的进化速率分析
利用PAML软件计算了每个亚组的进化速率,研究基因的进化机制是否存在差异。整体上看TaRCARs在进化过程中亚组间进化速率差异较大(表2)。GroupC、GroupD和GroupF进化速率较低,其ω值分别为0.162、0.179和0.000 01,亚组进化速率极小暗示组内成员功能相同或相近。GroupF中OsRCAR5(Os05g12260)是水稻中有功能的ABA受体,在种子萌发和幼苗生长时对ABA极为敏感,过表达可增强水稻的抗旱性和耐盐性[14],由此推测TaRCAR1和TaRCAR8在小麦响应干旱和盐胁迫的过程中可能发挥重要作用。GroupA、GroupB和GroupE均出现了快速进化,ω值分别为0.349、0.321和1.280,GroupE是拟南芥特有分支,GroupA和GroupB是禾本科特有分支,进化速率较快。
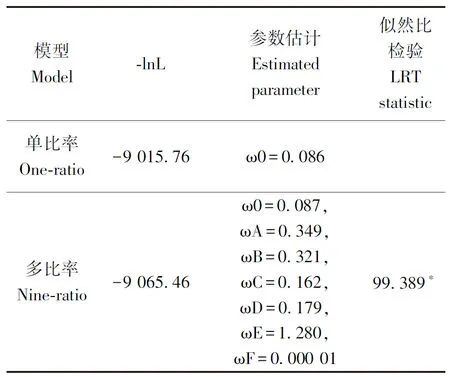
表2 TaRCARs不同亚组的进化速率分析Table 2 Evolutionary rate analysis of TaRCARs
2.6 TaRCARs正选择检验
为了适应新的环境,物种会选择有利的突变保留并稳定遗传给后代。TaRCARs在GroupA进化速率(ωA=0.349)最快,使用branch-site model检测GroupA是否存在正选择位点(表3)。GroupA有3个位点的后验概率P>0.99,说明相关位点经历了正选择。GroupA中OsRCAR1(Os01g61210)的表达在干旱胁迫后显著上调,而ABA处理后显著下调[16];AtRCAR10作为OsRCAR1同源基因,干旱胁迫后表达量降低,过表达能提高拟南芥在种子萌发、幼苗的生长时期对ABA的敏感[25]。因此,GroupA中TaRCARs出现正选择,可能导致基因突变产生新的功能,或者丧失原来的功能。
2.7 TaRCARs干旱和热胁迫下的表达模式
根据TaRCARs的编码序列设计表达引物进行表达特性研究。除TaRCAR8外,成功检测到其余8个成员的表达特性。在干旱胁迫下,TaRCARs具有不同的表达模式(图5),TaRCAR1、TaRCAR3、TaRCAR4、TaRCAR5和TaRCAR6在处理6 h达到最高,随后逐渐降低,趋于正常。而TaRCAR2的表达量先下降,然后恢复到初始水平。TaRCAR7和TaRCAR9的表达几乎不受影响。在热胁迫下,TaRCAR1和TaRCAR2在处理6 h表达量最高,而TaRCAR3、TaRCAR6和TaRCAR9表达量明显增加,而TaRCAR3、TaRCAR5、TaRCAR6和TaRCAR9在6 h基本无变化,12 h时表达量升高,达到最大,表明不同TaRCARs对热胁迫响应的时间存在差异。TaRCAR7和TaRCAR4的热处理后分别在6 h和12 h表现出下调趋势,说明TaRCARs在响应干旱和热胁迫的机制存在差异。
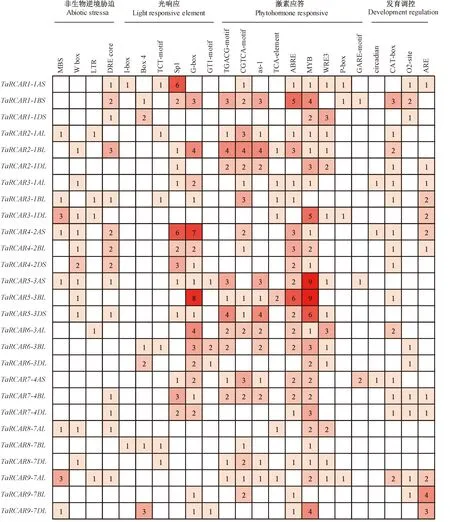
注:数字代表顺式作用元件个数,数目越多,标注的颜色越深。Note: Numbers in the table represent the number of cis-acting elements, the greater the number, the darker the color of the label.图3 TaRCARs顺式作用元件和功能Fig.3 TaRCARs cis-acting elements and functions
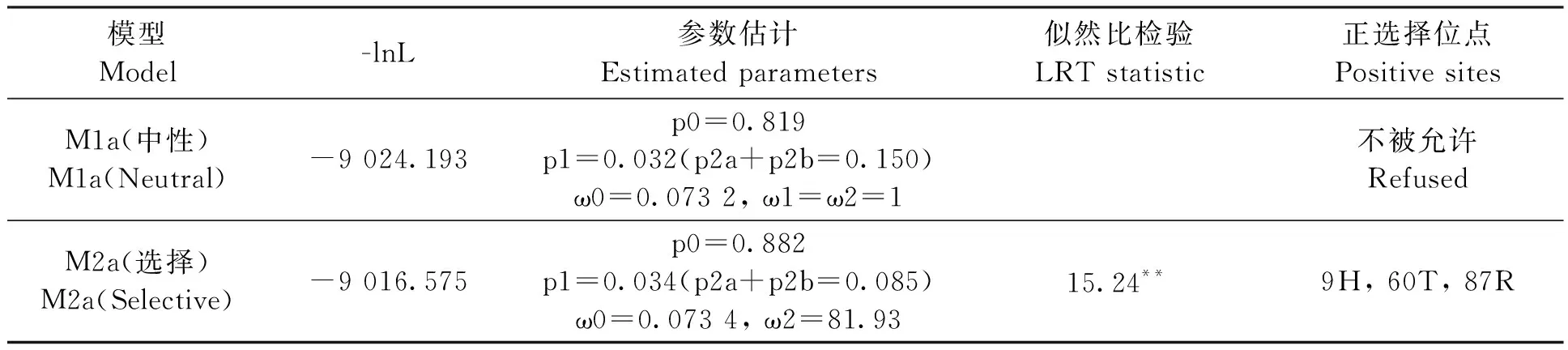
表3 GroupA正选择位点的检测Table 3 Positive selection detection of GroupA

图4 TaRCAR基因表达谱Fig.4 Expression profile of RCAR genes in wheat
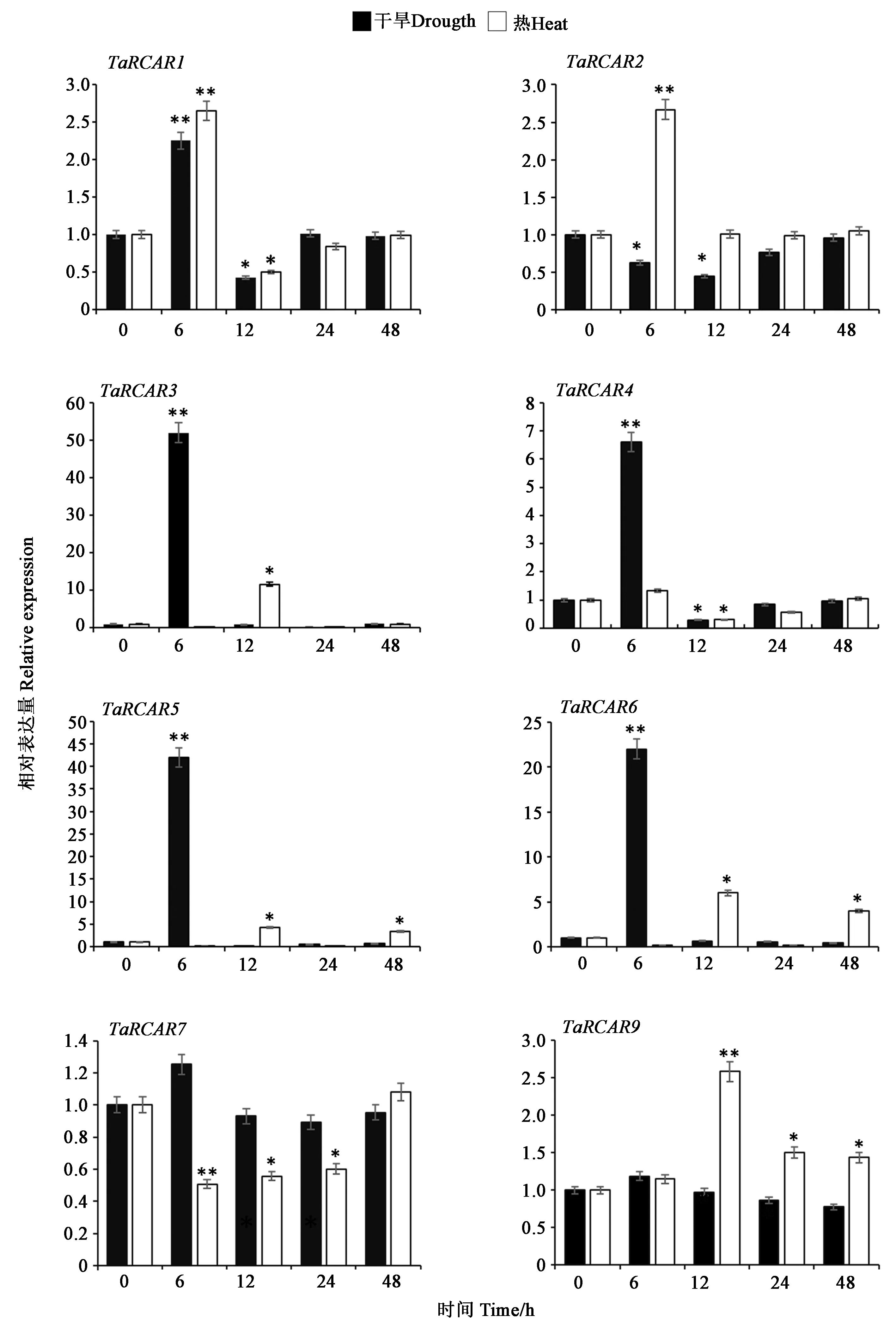
注:t-test分析基因在不同胁迫时间下与对照的差异具有统计学意义(**: P<0.01;*: P<0.05)。Note: t-test for significant difference between CK and samples(**: P<0.01,*: P<0.05).图5 小麦RCARs在干旱胁迫和热胁迫条件下的表达Fig.5 Expression of RCARs under drought stress and heat stress in wheat
3 讨论
TaRCARs在部分同源群间分布不均匀,在小麦第5和6同源群中没有TaRCARs分布,而第1同源群则有9个TaRCARs,第3和7同源群有6个TaRCARs。禾谷类祖先种有5条古染色体,分别为A5、A7、A11、A8和A4,90 MYA (million years ago)时发生过一次全基因组复制事件,导致染色体加倍由5条变为10条,增加了A1、A10、A12、A9和A6[26-28];随后两条染色体发生断裂和融合,从而产生两条新的染色体,分别是由A10和A7组成的A3以及A4和A6组成的A2,导致过渡态的祖先染色体为12条;在50~70 MYA时Panicoideae亚科与另外两个亚科分化,Ehrhartoideae亚科约在46 MYA与Pooideae亚科分化[29]。在小麦形成过程中还发生了一次染色体融合事件,其中A8和A6染色体发生断裂重组,形成7号染色体的祖先。除第3、6同源群的祖先染色体未发生断裂和重组外,其余同源群在进化过程中基本上都发生了重组和融合,这可能是导致TaRCARs在部分同源群间发生偏分布的原因。此外,RCARs参与小麦的适应性的进化,在多倍体化过程中拷贝数变异是重要的进化方式,有些TaRCARs可能发生了功能性的复制和删除。
拟南芥和水稻中RCARs研究较为深入,可以为TaRCARs研究提供参考。物种间同一进化分支的基因互为同源基因或亲缘较近,生物学功能相似。分析发现,拟南芥、水稻、玉米、大麦和小麦的RCAR蛋白进化分析可划分为6个亚组,GroupD所在分支中包括4个AtRCARs、3个OsRCARs、3个HvRCARs、3个ZmRCARs和9个TaRCARs,其中AtRCAR14(AT2G26040)过表达能够提高拟南芥种子的萌发、幼苗形态建立阶段对ABA敏感度,从而增强抗旱性[30];OsRCAR4作为AtRCAR14的同源基因过表达后明显提高水稻的耐旱性[16],推测TaRCAR2、TaRCAR5和TaRCAR9具有相同功能。GroupA所在分支的OsRCAR1在干旱和冷胁迫下显著上调[31],GroupA中的TaRCAR3和TaRCAR6在干旱和热胁迫下表达显著升高,暗示它们参与小麦抵御逆境胁迫。在漫长的进化过程中,结构相似的基因在种内或种间有时也发生功能分化。如CCT基因调控植物开花[32],然而Yang等[33]发现在玉米中无转座子插入ZmCCT为抗病等位基因,同时介导玉米对低氮和高盐的抗性。GroupF分支中OsRCAR5正调控水稻幼苗对ABA的敏感度,可提高成株期抗盐碱胁迫能力[14-15],而OsRCAR3过表达却能提高水稻的耐冷性[16]。可见RCARs在物种间虽具有较高的保守性,在进化过程中也会发生功能分化以适应环境变化。
正选择是物种进化的动力,是物种适应环境的遗传基础。在微生物中,太古菌有一些基因的进化速率加快,而加速进化的基因使太古菌能更好的适应地球降温,证实基因加速进化提高了物种适应环境的能力[34]。在植物中,黄瓜、杨树、大豆和拟南芥的11S球蛋白在进化过程中受到的正选择效应并不一致,在大豆中显著高于其他物种,进一步研究证实大豆中11S球蛋白快速进化促进了大豆合成蛋白的能力[35]。TaRCARs在GroupA出现了快速进化的现象,且TaRCAR3和TaRCAR6受到正选择,可能是小麦适应不同逆境胁迫,保留了较多的有利变异所致。小麦自北纬18~50°,从平原到高海拔地区均有种植,在扩大种植范围的驯化过程中就要求小麦能够抵御更多的逆境胁迫。RCAR基因是ABA信号通路中的重要调控因子,参与植物对逆境的抵御,相关成员必然受到选择,而差异选择为小麦适应性提供了遗传基础。因此,对TaRCARs进行更深入的研究,有助于解析小麦抗逆调控和驯化的分子机制。
——紫 苏

