HBV感染通过上调MALAT1诱导AMPKα活化和巨噬细胞凋亡的功能与机制研究
饶兵
乙型肝炎病毒(chronic hepatitis B virus,HBV)是一种嗜肝型DNA病毒,可导致肝脏纤维化、肝硬化、慢性乙型肝炎、甚至发展成为肝细胞癌。目前,全球感染HBV的患者约有2.4亿人,呈现全球流行疾病,而每年HBV致死人数达到65万[1]。在中国慢性乙型肝炎(chronic hepatitis B,CHB)患者人数达到了2 000万[2]。到目前为止,已明确HBV免疫功能低下是诱发CHB的主要病理基础。慢性HBV感染的慢性肝脏炎症及相关病理表现为多种白细胞浸润,包括活化的巨噬细胞。HBV能够促进巨噬细胞的活化和M2极化[3,4]。巨噬细胞是细胞凋亡的主要清除者,然而多种免疫紊乱都可导致巨噬细胞自身的异常凋亡,已明确HBV感染激活异常免疫反应从而损伤肝组织的同时,导致巨噬细胞成为免疫活性细胞的靶细胞或诱发自身凋亡导致巨噬细胞的进一步耗竭[5,6]。然而,HBV感染和巨噬细胞的凋亡之间的内在机制仍不清楚。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的激活参与调控多种细胞凋亡的促进[7],AMPKα是AMPK的5’端的催化亚基,是哺乳动物细胞中最广泛表达的AMPK亚型之一[8]。研究发现激活AMPK可以抑制氧化低密度脂蛋白低密度脂蛋白(oxidised low-density lipoprotein,OX-LDL)诱导的巨噬细胞增殖,而且1 mmol/L的AMPK激活剂AICAR 可促进巨噬细胞凋亡[9]。但是,到目前为止仍不清楚AMPK信号的激活是否参与HBV感染导致的巨噬细胞凋亡。MALAT1是一段广泛存在于哺乳动物体内的保守长链非编码RNA序列,已被证实在选择性剪接和基因表达等表观遗传调控中发挥重要作用[10]。MALAT1与多种病理过程密切相关,包括癌细胞和非癌细胞的增殖和凋亡等[11]。研究发现HBx在HCC组织可诱导MALAT1的表达[12],而且已发现MALAT1的高表达可能和AMPK的激活密切相关[13]。因此,推测MALAT1高表达和AMPK激活在HBV介导的巨噬凋亡中可能扮演重要角色。本研究旨在探讨MALAT1和AMPK激活在HBV感染后巨噬细胞凋亡的功能和机制,为乙肝疾病治疗探索新的潜在靶点。
1 材料与方法
1.1 材料 收集2015年10月至2016年10月于我院进行体检的HBV-DNA阳性者及HBV-DNA阴性者共130例外周血单核巨噬细胞,分析lncRNA-MALAT1的表达差异。本研究中涉及到的志愿者均签订知情同意书,并经过医院伦理委员会批准。
1.2 细胞培养与巨噬细胞诱导 人单核细胞THP-1细胞系购于中国科学院细胞保藏库(中国,上海),使用RPMI-1640(Abcam,Cambridge,MA)培养基培养,培养基中添加10%胎牛血清(fetal bovine serum,FBS,Gibco)以及1%的链霉素,在温度为37℃含有5% CO2的培养箱中进行培养。细胞浓度达到1.0×106/ml用于巨噬细胞诱导。细胞接种于35 mm培养皿中,于含100 ng/ml佛波酯(PMA)、0.3% BSA的无血清RPMI1640培养液中培养72 h进行诱导。
1.3 巨噬细胞的转染
1.3.1 为进一步证实HBV感染对巨噬细胞中MALAT1水平和细胞功能的影响,在体外使用HBV-X蛋白的真核表达载体pcDNA3.1(+)-HBx(pc-HBx)转染THP-1巨噬细胞。HBV-X蛋白的真核表达载体构建和细胞转染参考杨益大等[14]的方法并使用Lipofectamine 2000(美国,英杰公司)进行。细胞分组:①对照组:未处理的巨噬细胞;②pc-HBx组:稳定转染pc-HBx的巨噬细胞;③pc-HBx-NC组:pc-HBx转染巨噬细胞的阴性对照组。
1.3.2 为研究MALAT1在HBV感染的巨噬细胞中的功能,我们沉默了MALAT1并联合pc-HBx共转染巨噬细胞。使用HBV-X蛋白的真核表达载体pcDNA3.1(+)-HBx(pc-HBx)以及MALAT1小干扰RNA(si-MALAT1)和阴性对照(si-MALAT1-NC)(上海,吉玛)共同转染THP-1巨噬细胞,转染使用Lipofectamine 2000(美国,英杰公司)和生产商说明书中提供的方法。细胞分组:①对照组:未处理诱导后的巨噬细胞;②si-MALAT1-NC组:单独转染si-MALAT1-NC的巨噬细胞;③si-MALAT1组:单独转染si-MALAT1的巨噬细胞;④pc-HBx组:单独转染pc-HBx的巨噬细胞;⑤pc-HBx+si-MALAT1-NC组:共转染pc-HBx和si-MALAT1-NC的巨噬细胞;⑥pc-HBx-NC+si-MALAT1组:共转染pc-HBx和si-MALAT1的巨噬细胞。
1.4 实时定量PCR(RT-qPCR) 对各组细胞进行裂解,TRIzol法抽提细胞总RNA,M-MLV 逆转录试剂盒合成cDNA。cDNA特定RNA产物的产量检测使用SYBR®Green Master Mix,GAPDH作为内参对MALAT1的表达量进行标准化处理。反应体系(20 μl):10 μl SYBR,2.0 ng模板cDNA,正反向引物浓度均为20 μmol/L,体积为0.8 μl,最终使用灭菌蒸馏水加至20 μl。PCR过程:40个循环,94℃,1 min,54℃,1 min;聚合72℃,1 min;延伸 72℃,7 min。相对表达使用公式2-ΔΔCt计算。见表1。
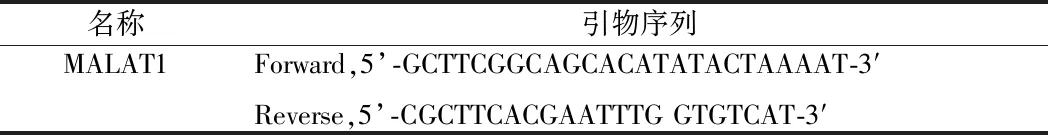
表1 引物序列
1.5 细胞凋亡实验 细胞凋亡率使用细胞坏死ELISA检测试剂盒(Roche Diagnostics,Penzberg,Germany)进行检测。将各组细胞进行离心(4℃,12 000 r/min,10 min),随后弃掉上清液,随后使用200 μl裂解缓冲液裂解30 min。将细胞溶解产物转移入培养板,添加青链霉素并混合Anti-DNA-POD 和Anti-histone-biotin进行2 h的孵育。在405 nm检测其吸光度值,参考波长为490 nm。
1.6 Caspase-3 活性检测 使用caspase-3/CPP32荧光测定试剂盒(Biovision,Mountain View,CA,USA)检测caspase-3的活性。根据试剂盒的说明对细胞进行消化并悬浮,存于50 μl的冷冻细胞裂解缓冲液中孵育10 min。每个样品均添加50 μl的2×反应缓冲液,用1 mmol/L DEVD-AFC底物在37℃孵育2 h。Caspase-3的活性使用含有400 nm感光滤光片和505 nm 的发散滤光片的荧光酶标仪(Gemini XS;Molecular Devices)。使用BCA试剂盒(中国,碧云天)检测蛋白中的浓度。每个样品的蛋白浓度均归一化为Caspase-3的活性。
1.7 Western blot 使用裂解缓冲液裂解细胞并获得总蛋白,使用BCA 蛋白浓度试剂盒(上海,碧云天)评估蛋白浓度。使用SDS-PAGE进行蛋白电泳并且使用硝酸纤维膜进行转膜(Bio-Rad Laboratories,Hercules,CA,USA),上样量为每孔50 μg。5% 脱脂牛奶或者BSA对载有蛋白质的膜进行室温孵育1 h。随后使用一抗(AMPKα,p-AMPKα,cleaved-caspase-3)(美国,Abcam)和β-Actin(圣克鲁斯生物科技公司,美国)在4℃进行过夜孵育。进一步使用二抗(ZSGB-BIO,Beijing,China)室温孵育进行2 h。使用Ecl检测系统(Pierce,Rockford,IL,USA)对蛋白条带进行显色,蛋白的表达水平均使用β-Actin进行归一化处理。

2 结果
2.1 HBV-DNA阳性者外周血单核巨噬细胞中MALAT1的表达增加 为明确HBV是否影响外周血单核巨噬细胞中的MALAT1的表达,使用RT-qPCR方法检测HBV-DNA阳性和阴性患者外周血中MALAT1的表达差异。结果发现HBV-DNA阳性患者外周血单核巨噬细胞中MALAT1升高比例为82.54%(52/63),而HBV-DNA阴性患者外周血单核巨噬细胞中MALAT1升高比例为8.95%(6/67)。MALAT1在HBV-DNA阳性患者外周血单核巨噬细胞中升高,差异有统计学意义(P<0.05)。见表1。

类别MALAT1HBV-1.00±0.05HBV+3.05±0.55∗
注:与HBV-比较,*P<0.05;HBV+:HBV阳性外周血单核细胞,HBV-:HPV阴性外周血单核细胞
2.2 高表达HBV-X蛋白促进MALAT1表达 使用THP-1细胞诱导巨噬细胞,并在巨噬细胞中高表达HBV-X蛋白。与对照组相比,pc-HBx组中HBV-X蛋白水平上调,差异有统计学意义(P<0.05),而与对照组相比,pc-HBx-NC组的HBV-X蛋白水平变化差异无统计学意义(P> 0.05)。细胞中MALAT1的表达差异检测结果发现,与对照组相比,MALAT1在pc-HBx组上调,差异有统计学意义(P<0.05),而与对照组相比,MALAT1的水平在pc-Hbx-NC组的差异无统计学意义(P> 0.05)。MALAT1在HBV感染后巨噬细胞中表达升高。见表2,图1。

组别HBV-X蛋白相对水平MALAT1相对水平对照组 1.00±0.051.00±0.07pc-HBx-NC组1.01±0.021.02±0.06pc-HBx组 6.54±0.55∗4.95±1.12∗
注:与对照组比较,*P<0.05;pc-HBx:HBV-X蛋白的真核表达载体pcDNA3.1(+)-HBx;pc-HBx-NC:pcDNA3.1(+)空载体作为阴性对照
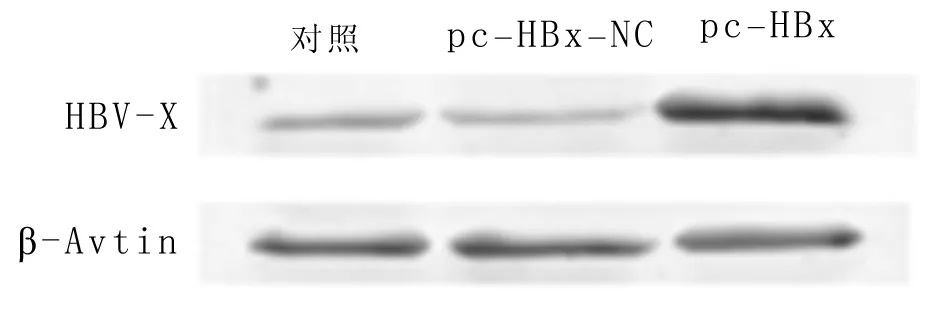
图1 高表达HBV-X蛋白对MALAT1蛋白表达的影响
2.3 高表达HBV-X蛋白促进巨噬细胞凋亡和AMPKα活化 与对照组相比,pc-HBx组中cleaved-caspase-3水平上调,差异有统计学意义(P<0.05),而与对照组相比,pc-HBx-NC组的cleaved-caspase-3蛋白水平变化差异无统计学意义(P>0.05)。细胞凋亡率检测发现,与对照组相比,凋亡率在pc-HBx组上调,差异有统计学意义(P<0.05),与对照组相比,凋亡率在pc-HBx-NC组的差异无统计学意义(P> 0.05)。进一步验证发现,HBV-DNA阳性者的外周单核细胞中cleaved-caspase-3蛋白水平高于HBV-DNA阴性者,差异有统计学意义(P<0.05)。因此,HBV感染后巨噬细胞的凋亡率升高。AMPKα信号通路参与多种细胞凋亡途径,检测AMPKα和p-AMPKα的表达,以评估AMPKα在HBV-X过表达细胞中的活化程度。与对照组比较,AMPKα和p-AMPKα在pc-HBx组中均上调,差异有统计学意义(P<0.05),而与对照组比较,二者的表达水平在pc-HBx-NC组差异无统计学意义(P> 0.05)。进一步验证发现,HBV-DNA阳性者的外周单核细胞中p-AMPKα水平高于HBV-DNA阴性者,差异有统计学意义(P<0.05)。HBV可诱导促进巨噬细胞凋亡和AMPKα活化。见表3、4,图2、3。


组别Cell apoptosis(%)cleaved-caspase-3AMPKαp-AMPKα对照组 61.00±10.05 1.00±0.07 1.00±0.18 1.00±0.25pc-HBx-NC组 60.00±13.00 1.02±0.08 0.99±0.07 0.99±0.15pc-HBx组 78.50±10.10∗ 1.70±0.37∗ 3.85±0.22∗ 5.10±0.55∗
注:与对照组比较,*P<0.05
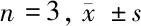

类别cleaved-caspase-3p-AMPKαHBV- 1.00±0.04 1.00±0.08HBV+ 1.60±0.03∗ 1.90±0.11∗
注:与HBV-比较,*P<0.05
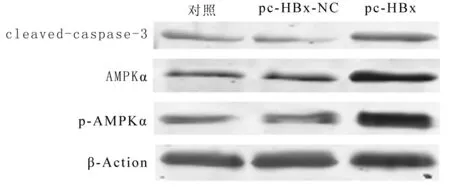
图2 巨噬细胞高表达HBx对AMPKα激活的影响
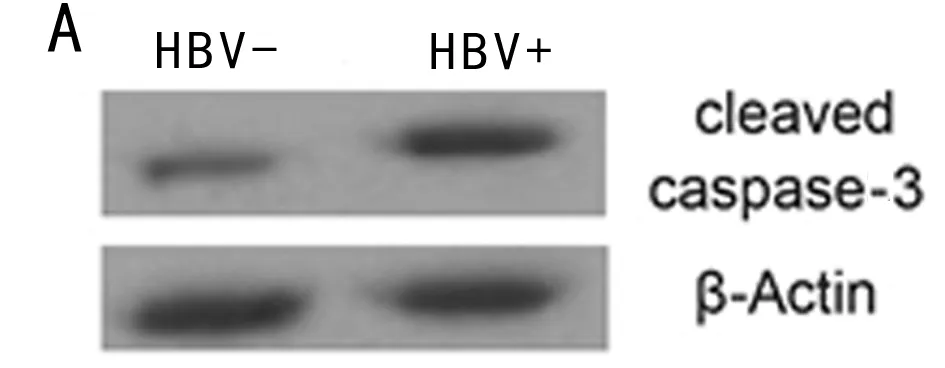
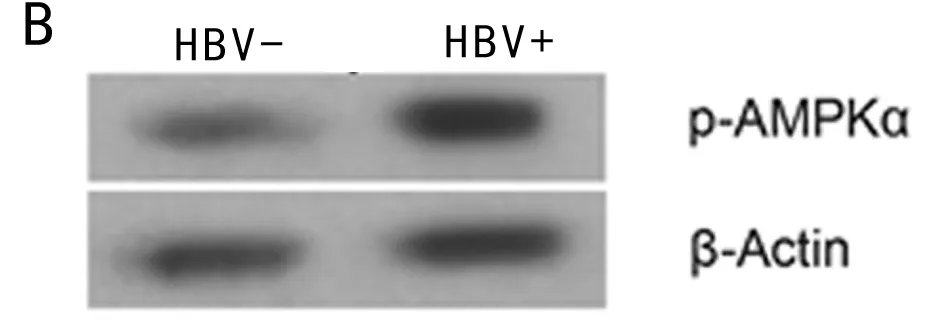
图3 外周血单核细胞中cleaved-caspase-3和p-AMPKα蛋白水平变化
2.4 HBV感染通过上调MALAT1诱导AMPKα活化并促进巨噬细胞凋亡 为探究MALAT1高表达在HBV感染巨噬细胞致凋亡和诱导AMPKα活化中的作用,对巨噬细胞进行HBV-X过表达和si-MALAT1沉默MALAT1共处理。结果发现,分别与对照组比较,单独si-MALAT1组和单独si-MALAT1-NC组中巨噬细胞凋亡率和p-AMPKα的表达水平差异均无统计学意义(P>0.05)。与pc-HBx组相比,pc-HBx+si-MALAT1组中巨噬细胞凋亡率和p-AMPKα的表达水平变化均降低,差异有统计学意义(P<0.05);与pc-HBx组相比,pc-HBx+si-MALAT1-NC组中巨噬细胞凋亡率和p-AMPKα的表达水平差异无统计学意义(P>0.05)。见表5,图4。
3 讨论
本研究在体内和体外探讨乙肝病毒HBV感染对人巨噬细胞的关键作用和机制,明确乙肝病毒HBV可促进巨噬细胞的凋亡及长链非编码RNA MALAT1在巨噬细胞中的表达,而且增加AMPKα的活化。研究发现,MALAT1的上调是导致HBV感染巨噬细胞发生凋亡及AMPKα活化的关键调节因子[11]。
乙肝病毒X蛋白(HBx)由乙肝病毒HBVX基因编码,是一种包含154个氨基酸残基的多功能蛋白[15]。HBx蛋白是HBV病毒复制和扩散所必需,且与乙型肝炎和HCC的发生密切相关。研究发现在HBx介导的HCC组织中MALAT1的表达和HBx蛋白成正比[12]。本研究发现MALAT1高表达出现在HBV-DNA阳性患者外周血单核细胞和HBx过表达的巨噬细胞中。表明MALAT1不仅在HBx相关的HCC中上调[12],而且在HBV感染的早期外周单核巨噬细胞中同样处于高水平。


组别p-AMPKαCell apoptosis(%)对照组 1.00±0.05 66.4± 4.2si-MALAT1-NC组 1.05±0.03 65.5±11.2si-MALAT1组 1.01±0.20 67.1± 5.1pc-HBx+si-MALAT1组 1.35±0.28∗ 58.2± 4.1∗pc-HBx+si-MALAT1-NC组 1.88±0.19 79.8± 5.8pc-HBx组 1.81±0.03# 85.5± 6.5#
注:与对照组比较,*P<0.05;与pc-HBx+si-MALAT1组比较,#P<0.05;pc-HBx:HBV-X蛋白的真核表达载体pcDNA3.1(+)-HBx;pc-HBx-NC:pcDNA3.1(+)空载体作为阴性对照;si-MALAT1:MALAT1小干扰RNA;si-MALAT1:NCMALAT1小干扰RNA的阴性对照

图4巨噬细胞高表达HBx联合沉默MALAT1对p-AMPKα蛋白表达的影响
HBV感染可导致慢性肝炎症状到导致肝损伤,机体免疫应答在此过程中发挥关键作用。HBV感染导致巨噬细胞成为靶细胞,不仅受到免疫活性细胞攻击,而且诱发自身凋亡,导致细胞进一步耗竭,造成持续感染状态[6]。本研究发现,HBV DNA阳性患者的外周血单核巨噬细胞中凋亡标记物cleaved-csaspase-3明显上调,另外HBx高表达的巨噬细胞凋亡率和cleaved-csaspase-3表达均增加。
MALAT1与多种病理过程密切相关,尤其是肿瘤细胞的增殖、凋亡、迁移、侵袭等[16-18]。Sallé-Lefort等[13]在缺氧环境下发现,CaMKK激活的AMPK可诱导MALAT1的启动子反式激活从而导致MALAT1的高表达。本研究发现在HBx高表达刺激下MALAT1被明显过表达,而且AMPK也被激活。因此我们探索了HBx高表达刺激下AMPKα的激活和MALAT1表达水平升高的关系。在HBx高表达和MALAT1沉默联合作用下,AMPKα的激活效应被部分抑制,更重要的是,HBx诱导的巨噬细胞凋亡增加同样被MALAT1沉默所减弱,表明MALAT1参与调节HBx诱导的AMPKα激活和巨噬细胞凋亡,并且暗示MALAT1和AMPK信号之间可能存在相互激活的关系。在多种非肿瘤疾病中,MALAT1的沉默可以保护细胞免受损伤,并减缓细胞的非正常凋亡。人为抑制MALAT1可减少糖尿病大鼠的心肌细胞凋亡[11],此效应在心肌梗死导致的心肌细胞凋亡中同样被发现[19]。研究发现,氧化型低密度脂蛋白(oxLDL)诱导的M2巨噬细胞极化可导致内皮细胞凋亡,沉默MALAT1可以抑制M2巨噬细胞极化,从而减缓内皮细胞的异常凋亡[20]。因此,在HBx诱导下通过促进MALAT1的高表达从而激活AMPKα并大致巨噬细胞凋亡增加。

