温度与NaCl处理对甜高粱种子萌发及幼苗抗氧化酶活性的影响
王志恒, 黄思麒, 邹芳, 杨秀柳, 魏玉清
(北方民族大学生物科学与工程学院, 国家民委生态系统模型及应用重点实验室, 银川 750021)
甜高粱[Sorghumbicolor(L.)Moench]又称糖高粱、甜秆等,具有适应性广、生长速度快、生物产量高等特点,可广泛作为饲料、能源和糖料作物,现已成为盐碱地地区最具有种植潜力的作物之一[1-2]。当前,土壤盐渍化是限制农业发展的重要环境因子,严重威胁作物产量和农村经济发展[3-4]。据全国第二次土壤普查,中国的盐渍地分布广泛,总面积约为3.6×109hm2,其中西北、华北、沿海地区的盐碱地总面积超过3×108hm2,占全国耕地总面积的10%左右,发展耐盐植物在盐碱地的种植成为盐碱地可持续利用技术研发研究重点之一,对于提升我国耕地农业生产能力、开发耕地面积、保障国家粮食安全具有重要意义[5-6]。
种子萌发阶段作为植物生长周期中最重要的阶段之一,是自身最脆弱、对外界环境最敏感的时期,极易受到环境因子的影响,而温度和盐分均是影响种子萌发的主要环境因素[7]。有研究表明,生长在盐碱地区的植物经常遇到温度和盐分两种胁迫[8]。目前,关于盐胁迫对甜高粱种子萌发的影响研究较多,而不同温度条件下盐胁迫对甜高粱种子萌发影响的研究未见报道。那么温度和盐分及其交互作用对甜高粱种子的萌发有何影响,值得研究。本研究以‘辽甜1号’甜高粱为材料,设置5个温度梯度下5个NaCl盐分浓度,通过测定发芽率、种子残留干重、幼芽幼根长度及幼苗抗氧化物酶活性等多个指标,拟探讨不同温度及NaCl浓度胁迫下甜高粱种子萌发和抗氧化酶活性的变化特征,旨在研究温度和盐分及其交互作用对甜高粱种子萌发及幼苗生长的影响,以期为盐碱地甜高粱的种植提供理论依据和技术指导,从而促进我国盐碱地甜高粱的产业化发展。
1 材料与方法
1.1 供试材料
供试种子为甜高粱品种‘辽甜1号’,由辽宁省农业科学院创新中心提供。
1.2 试验设置及方法
萌发温度设置为15/5、20/10、25/15、30/20与35/25 ℃共5个梯度,光周期为12/12 h(光/暗);将NaCl配制为0、50、100、200、300 mmol·L-1盐溶液进行梯度处理,共设置25个处理。
取饱满、色泽大小基本一致的甜高粱种子适量,用10%的次氯酸钠溶液浸泡20 min消毒,用无菌水冲洗7~8次,直至干净无味,用滤纸吸干种子表面水分。将甜高粱种子30粒整齐置于垫有双层滤纸的的培养皿(Φ120 mm)中,每个处理加入10 mL不同浓度的盐溶液,均设置3个重复。试验期间每天更换培养基质,以保证培养环境的恒定。置于特定温度的室内人工智能气候箱(BIC-800,上海博迅实业有限公司)黑暗条件下进行甜高粱种子萌发试验。
1.3 指标检测
试验过程中,每隔24 h观察记录种子萌发情况,以胚根伸出种皮2 mm为萌发标准[8],记录种子萌发个数,统计萌发率。7 d后结束萌发,从各个处理中随机选出15株幼苗,用直尺测量胚芽、胚根长度,用电子分析天平(上海精科天美科学仪器公司)测量幼苗干重、种子残留干重。干重测量前105 ℃烘2 h杀青,80 ℃烘24 h至恒重。按以下公式计算各指标[9-10]。


发芽指数(GI)=∑Gt/t
式中,Gt为t天内发芽的种子数,t为相应的萌发天数。
活力指数=GI×S
式中GI为发芽指数,S为胚根平均长度。
干物质转运率=
超氧化物歧化酶(superoxide dismutase, SOD)活性测定采用氮蓝四唑光还原法[11];过氧化物酶(peroxidase, POD)活性测定采用愈创木酚显色法[12];过氧化氢酶(catalase, CAT)活性测定采用紫外吸收比色法[13];抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性测定参考孙云[14]的方法。
1.4 数据处理
采用 Microsoft Excel 2003进行数据统计处理,SPSS Satatistics 21.0进行双因素方差分析,GraphPad Prism 5.0进行作图。
2 结果与分析
2.1 不同处理对甜高粱种子发芽进程的影响
不同温度不同NaCl处理的甜高粱种子发芽结果见图1,可知温度和NaCl处理均影响甜高粱种子发芽进程。随着温度的升高,甜高粱种子在不同浓度盐胁迫下初始发芽时间均提前,由种子开始处理后的第3 d提前至第1 d,发芽结束时间由第6 d提前至第3 d;随着盐浓度的增加,NaCl处理延后了种子萌发的起始时间,到达发芽高峰期的时间也推迟。在30/20和35/25 ℃条件下,300 mmol·L-1的NaCl处理种子萌发后会出现死苗的现象。由此表明,温度升高可以加快甜高粱种子的发芽速率,使发芽历时缩短,而盐胁迫推迟种子萌发的进程,在高温和高浓度NaCl处理的交互作用下,会严重伤害甜高粱种子的萌发。
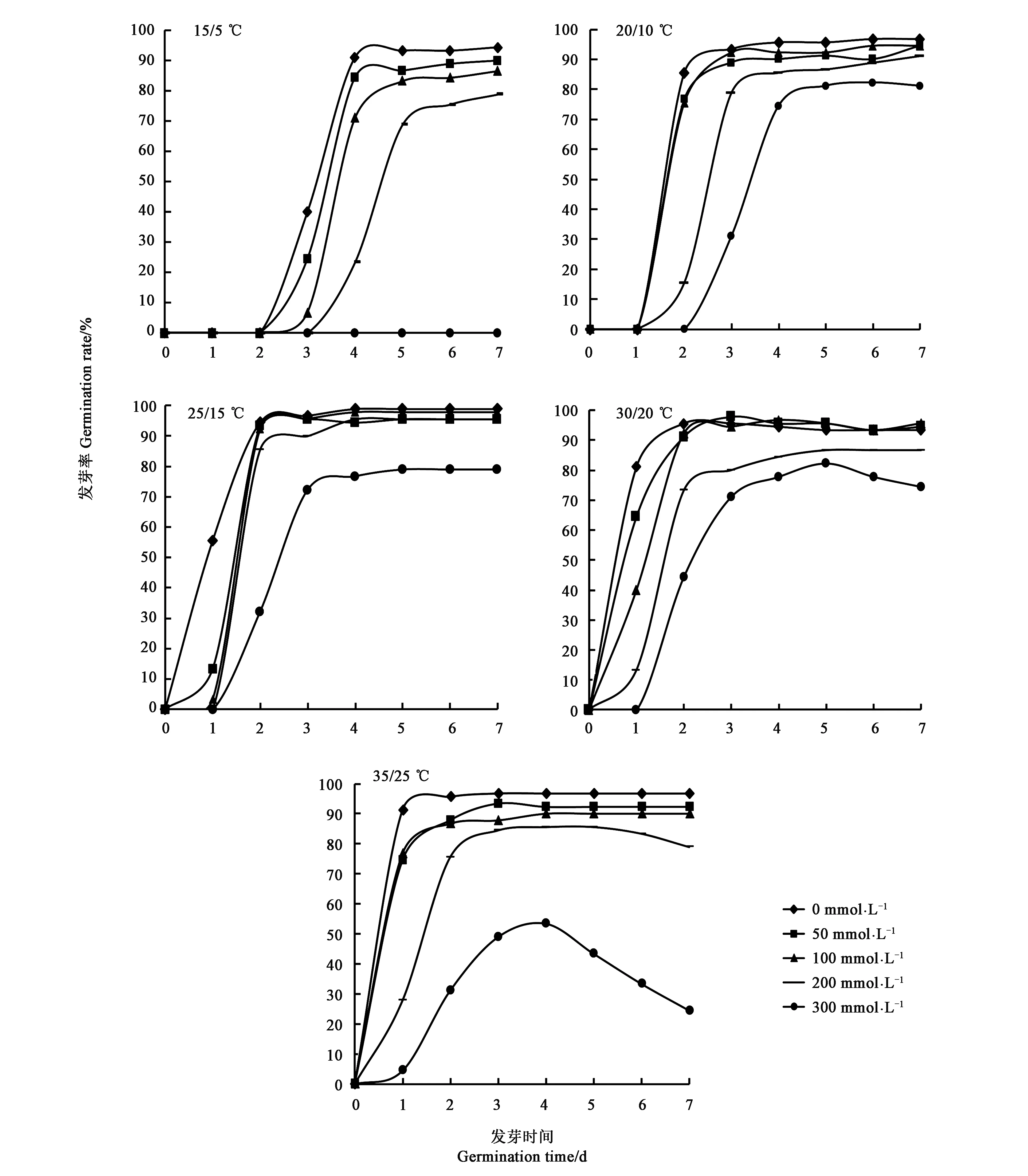
图1 温度与NaCl处理对甜高粱种子发芽进程的影响
2.2 不同处理对甜高粱种子萌发指标的影响
不同温度和不同NaCl处理的甜高粱种子发芽率和发芽势结果见图2,可见,当NaCl浓度相同时,种子发芽率和发芽势在25/15 ℃最高,其次为30/20 ℃,15/5 ℃时发芽率和发芽势最低,虽然有的处理差异不显著;当温度相同时,盐浓度越高,发芽率和发芽势越低,15/5 ℃下,当NaCl浓度超过100 mmol·L-1时,发芽率和发芽势显著低于0 mmol·L-1处理,20/10、25/15、30/20、35/25 ℃条件下,盐浓度超过200 mmol·L-1时,发芽率和发芽势显著低于0 mmol·L-1处理。由图2可知,NaCl处理下,种子的发芽指数在35/25 ℃时最高,种子的活力指数在30/20 ℃时最高,二者均在15/5 ℃条件下最低,且显著低于30/20、35/25 ℃处理;在温度相同的条件下,随着NaCl浓度的增加,种子的发芽指数和活力指数逐渐降低。
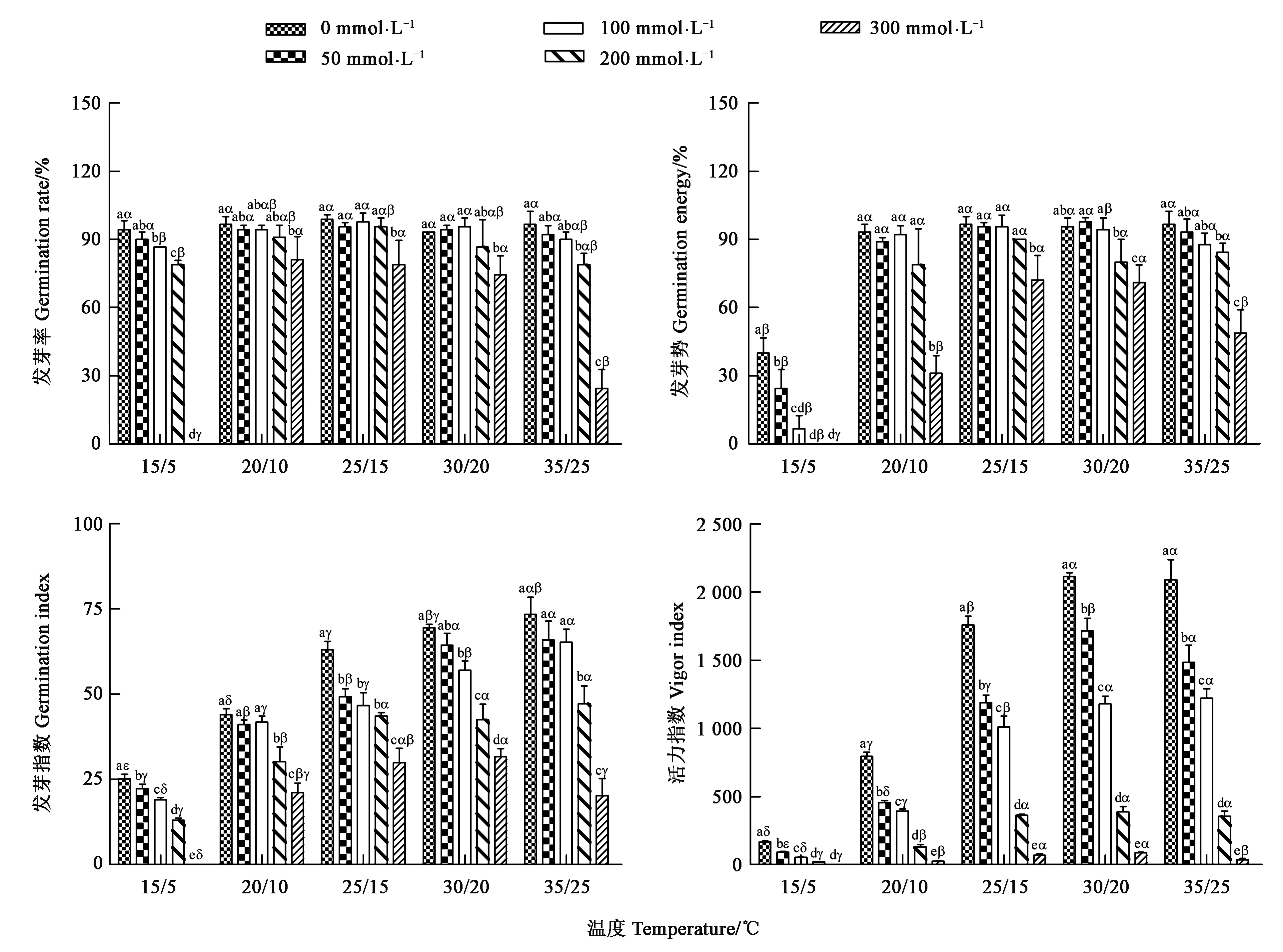
注:不同英文小写字母表示相同温度条件下不同NaCl处理间差异在P<0.05水平具有统计学意义;不同希腊小写字母表示相同NaCl浓度处理下不同温度间差异在P<0.05水平具有统计学意义。
温度(T)、NaCl处理(S)及T×S对甜高粱种子的发芽指标贡献度的双因素方差分析结果(表1)表明,T、S及T×S对甜高粱种子的发芽率、发芽势、发芽指数和活力指数的贡献度不同,从T、S及T×S所占总平方和的百分比(PP)来看,S(53.53%)对发芽率的贡献度较高,T×S(29.82%)次之,T(16.66%)最小;T(75.80%)对发芽势的贡献度较高,S(18.64%)次之,T×S(5.56%)最小;T(54.92%)对发芽指数的贡献度较高,S(39.49%)次之,T×S(5.59%)最小;S(49.33%)对活力指数的贡献度较高,T×S(33.39%)次之,T(16.68%)最小。因此,NaCl处理是影响发芽率和活力指数的主要因子,而温度是影响发芽势和发芽指数的主要因子。
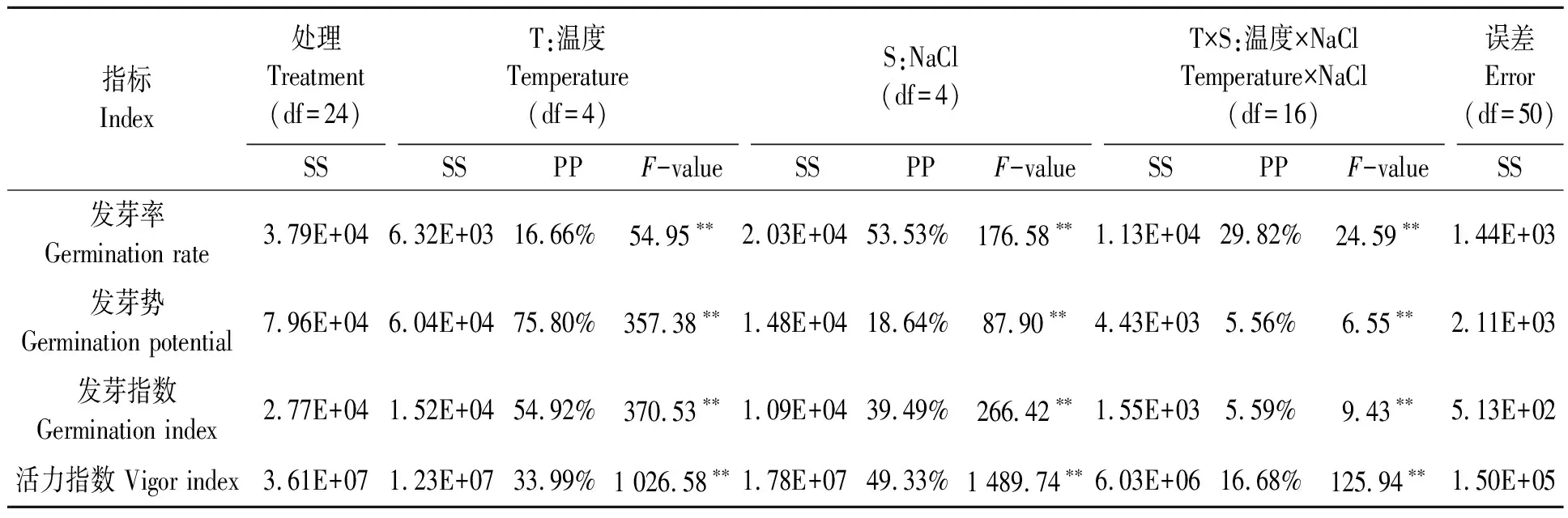
表1 温度与NaCl处理对甜高粱种子萌发指标影响的双因素方差分析
2.3 不同处理对甜高粱种子种苗转化的影响
不同温度和NaCl处理的甜高粱种子干物质转移相关指标结果见图3,当NaCl浓度相同时,芽干重+根干重在25/15 ℃最高,其次为30/20、35/25、20/10 ℃,15/5 ℃时最低;当温度相同时,随着盐浓度升高,芽干重+根干重逐渐减小,当NaCl浓度超过100 mmol·L-1时,其显著低于0 mmol·L-1处理。当NaCl浓度相同时,种子残留干重在30/20、35/25 ℃下最低,15/5 ℃时最高;当温度相同时,随着NaCl浓度升高,种子残留干重逐渐增大,当NaCl浓度超过50 mmol·L-1时,种子残留干重显著高于0 mmol·L-1处理。当NaCl浓度相同时,干物质转运率在25/15 ℃、30/20 ℃、35/25 ℃下最高,其次为20/10 ℃,15/5 ℃时最低;当温度相同时,随着NaCl浓度升高,干物质转运率逐渐降低,且不同浓度的NaCl处理均显著低于0 mmol·L-1处理。当NaCl浓度相同时,总长和芽长在30/20 ℃达到最高,其次为25/15、35/25 ℃;鲜重、幼苗相对含水量和根长在25/15 ℃最高,其次为30/20、35/25 ℃,15/5 ℃时甜高粱早期幼苗的生长情况最差。可见,当温度相同时,随着NaCl浓度升高,鲜重、幼苗相对含水量、总长、芽长及根长逐渐减小,当NaCl浓度超过100 mmol·L-1时,均显著低于0 mmol·L-1处理。
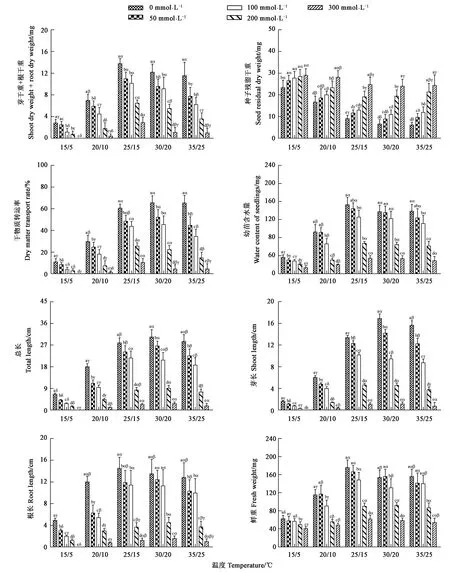
注: 不同英文小写字母表示相同温度条件下不同NaCl处理间差异在P<0.05水平具有统计学意义;不同希腊小写字母表示相同NaCl浓度处理下不同温度间差异在P<0.05水平具有统计学意义。
双因素方差分析(表2)表明,T、S及T×S对甜高粱种子的干物质转移贡献度不同,从T、S及T×S所占总平方和的百分比(PP)来看,S(47.52%)对芽干重+根干重的贡献度较高,T(44.80%)次之,T×S(7.69%)最小;T(48.04%)对种子残留干重的贡献度较高,S(41.79%)次之,T×S(10.17%)最小;S(45.49%)对干物质转运率的贡献度较高,T(43.52%)次之,T×S(10.99%)最小;S(47.52%)对甜高粱早期幼苗生长(鲜重、幼苗含水量、总长、芽长及根长)的贡献度较高,T次之,T×S最小。因此,NaCl是影响芽干重+根干重、干物质转运率、及早期幼苗生长主要因素的主要因子,温度是影响种子残留干重的主要因子。
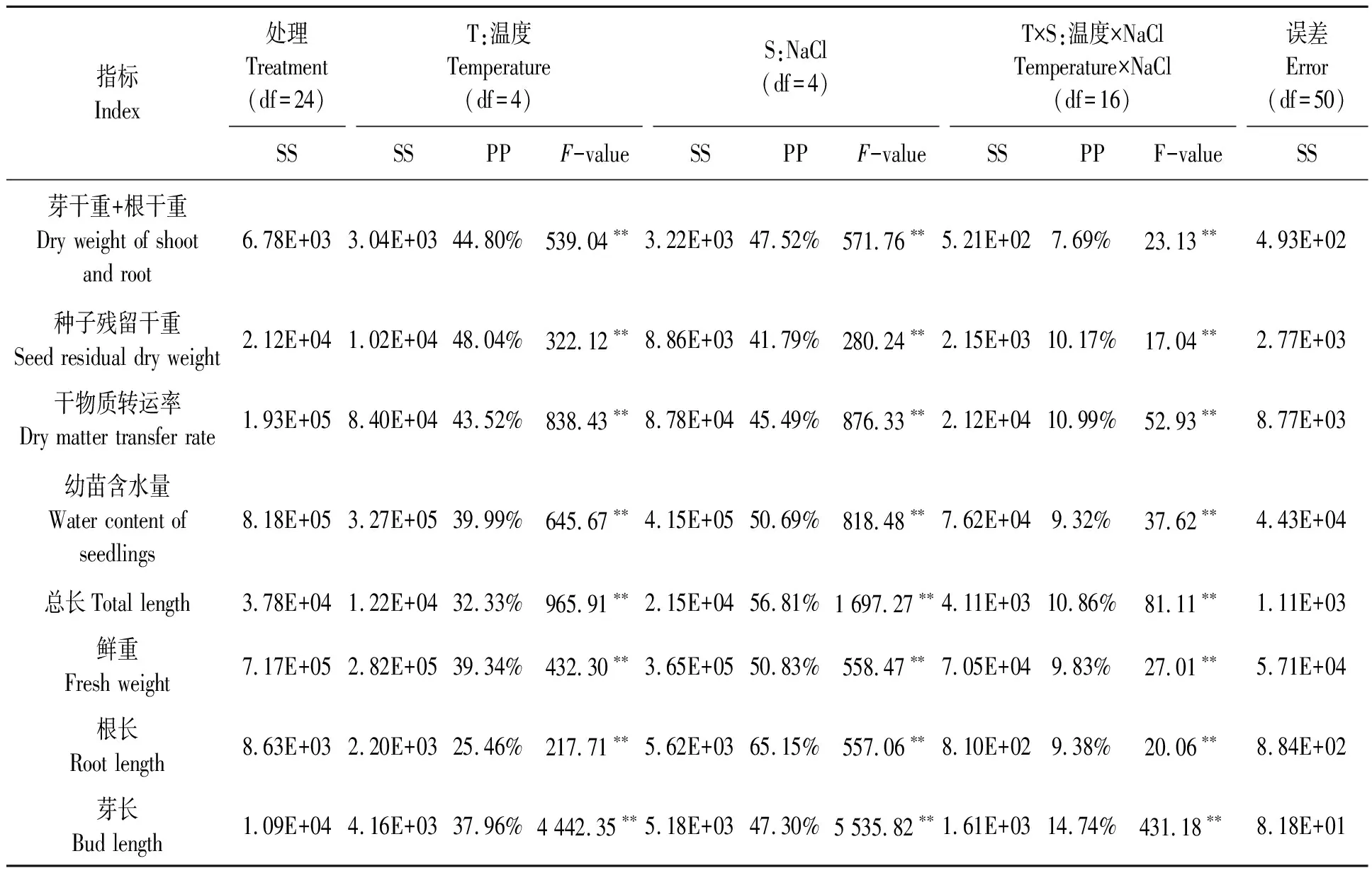
表2 温度与NaCl处理对甜高粱种子种苗转化影响的双因素方差分析
2.4 不同处理对甜高粱早期幼苗叶片抗氧化酶活性的影响
SOD、POD、CAT、APX是植物在逆境胁迫下为抵御外界伤害产生的抗氧化酶类。由图4可知,在15/5和20/10 ℃下,SOD、POD、APX活性均随着NaCl浓度的增加而逐渐减小,25/15、30/20、35/25 ℃时,3种酶活性在NaCl浓度增加的情况下呈现先增大后减小的趋势;APX活性在不同温度条件下均随着NaCl浓度的增加而逐渐减小。在NaCl浓度相同的情况下,温度对于4种酶活性的影响各不相同,在0、200 mmol·L-1时,4种酶活性均随着温度的升高呈现先增大后减小的趋势,50、100 mmol·L-1时,4种酶活性均随着温度的升高而逐渐增大,300 mmol·L-1时,SOD、POD活性均随着温度的升高而逐渐增大,CAT、APX活性均随着温度的升高呈现先增大后减小的趋势。
双因素方差分析(表3)表明,对甜高粱早期幼苗叶片的抗氧化酶活性贡献度不同,从T、S及T×S所占总平方和的百分比(PP)来看,S对SOD、POD、CAT活性的贡献度较高,T次之,T×S最小;T对APX活性的贡献度较高,S次之,T×S最小。因此NaCl处理是影响SOD、POD、CAT活性的主要因子,温度是影响APX活性的主要因子。
3 讨论
种子萌发过程中,温度是调控其萌发的重要生态因子之一,同时也是盐胁迫下种子萌发的重要生态条件[15]。在本研究中,NaCl浓度不超过100 mmol·L-1时,除15/5 ℃外,不同温度对甜高粱种子的发芽率无显著影响,说明甜高粱在低浓度的盐胁迫下能够适应多种变温范围。随着NaCl浓度的增加,甜高粱在高温(25/15~35/25 ℃)条件下具有较高的发芽率和发芽势,15/5 ℃对甜高粱种子的发芽率和发芽势抑制最强,这是因为在种子萌发过程中,种子内部进行着活跃的物质代谢反应,在一定范围内,相对较高的温度对种子萌发具有促进作用,超过某一特定温度范围的过高和过低温度均不利于种子萌发[16]。在300 mmol·L-1浓度的NaCl胁迫下,30/20和35/25 ℃条件对甜高粱已萌发的早期幼苗有致死现象,说明过高的温度、NaCl胁迫及其交互作用会影响甜高粱种子萌发的一系列生理生化过程,进而影响发芽率和发芽势,当环境温度适宜时,则可以减轻一定程度盐胁迫对甜高粱种子萌发的毒害作用,这与小麦[15]和野大麦[17]的研究结果一致。
植物从种子转化到幼苗过程中所需的物质及能量是由种子中贮藏的有机物提供,因此在种子萌发过程中总长、芽长、根长、鲜重、种子残留干重、芽干重+根干重和干物质转移率能体现出植物种苗转化状况,当植物早期幼苗胚芽和胚根生长均衡时,可以表现出更好的生长状况[9]。本研究发现,在同一NaCl浓度下,除种子残留干重外,甜高粱种苗转化过程的总长、芽长、根长、鲜重、芽干重+根干重、干物质转移率和幼苗含水量随着温度的升高呈先增大后减小趋势,种子残留干重则随着温度的升高呈减小趋势;在同一温度下,随着NaCl浓度的增加,甜高粱种苗转化过程除种子残留干重外,其余指标均逐渐减小,种子残留干重则随着NaCl浓度的升高而增大;同时根长、鲜重、芽干重+根干重和幼苗含水量在25/15 ℃条件下最高,总长和芽长在30/20 ℃条件下最高,干物质转运率在25/15和30/20 ℃条件下较高,种子残留干重在30/20和35/25 ℃条件下较低,说明温度、NaCl胁迫及其交互作用对种苗转化的各指标影响不同,这可能是由于种子吸水后,较快地进行代谢活动,种子的水解作用增强,合成作用减弱,种子内部的淀粉和蛋白质水解为可溶性糖和可溶性蛋白等渗透调节物质,当超过种子萌发适宜温度时,高温加剧种子的水解和呼吸作用,导致种子内部的淀粉消耗增加,而温度的升高对于早期幼苗的生长又是一种伤害。因此,在温度与盐胁迫的交互作用下,种子萌发时期种苗转化过程中各指标对于胁迫的响应各有不同[15]。
非生物胁迫下,植物会产生大量活性氧自由基,大量的活性氧会影响蛋白质的合成、破坏膜系统,造成植物细胞严重损坏甚至死亡,SOD、POD、CAT和APX是细胞内清除活性氧的主要保护酶,整个保护酶系统防御能力的变化取决于这几种酶的彼此协调的综合结果[18]。本研究中,甜高粱早期幼苗叶片的抗氧化物酶活性整体上随着温度的升高逐渐增强,在适宜温度下,酶活性随着NaCl浓度的增加呈现先升高后下降趋势,在较低或较高温度下,酶活性随着NaCl浓度的增加呈现降低趋势。这可能是由于当甜高粱种子转化为早期幼苗后,低温可以抑制幼苗的一系列生理生化活动,而高温引起水分蒸发加速,并通过毛细运动增加了盐浓度,在盐胁迫的基础上加剧了对早期幼苗的伤害,而这些酶活性的增强有利于及时清除活性氧自由基,保持平衡,而随着胁迫程度的进一步增大,抗氧化物酶已不能完全清除存在的活性氧自由基,平衡被打破,因此酶活性降低[19]。因此,在温度与盐胁迫交互作用下,胁迫伤害效应叠加,加重甜高粱早期幼苗受损程度,表现为低温和高盐胁迫伤害较大,抗氧化物酶活性降低,而高温和低盐胁迫提高了抗氧化物酶活性,这与类延宝[20]在小麦上的研究结果一致。
综上所述,温度与NaCl处理及其互作均可显著影响甜高粱种子的萌发及早期幼苗的生长,低浓度NaCl处理下,低温是抑制其萌发的主要原因,当NaCl浓度较高时,高温更是加剧了对种子萌发的伤害作用,在30/20 ℃下,大多数指标达到最优状态,表明该温度为盐胁迫下甜高粱种子萌发及早期幼苗生长的最适温度。

