新疆双峰驼纳米抗体、重链抗体和常规抗体的热稳定性比较
坤杜孜阿依·阿布都沙拉木,姜志强,刘娅菲,熊静璠,娜斯拜·阿卜杜瓦哈普,李江伟
(新疆大学生命科学与技术学院/省部共建新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
0 引 言
【研究意义】1993年发现在骆驼科动物中存在天然缺失轻链的重链抗体(Heavy Chain Antibodies, HCAbs)以来[1],但研究者对于HCAbs自身的功能和特性、其在骆驼体液免疫系统中的作用、与疾病的关系等研究较欠缺、鲜有文献报道。研究骆驼HCAbs的功能及性质,对分析骆驼免疫系统的功能,研究更有效的疾病预防和治疗手段,开发和利用这类抗体具有重要意义。【前人研究进展】 骆驼科现存3属6种动物。在所有这些动物中,除具有由2条重链和2条轻链组成的IgG1型常规抗体外,还存在天然缺失轻链和CH1结构域的IgG2和IgG3型重链抗体。在自然界中,缺失轻链的HCAbs目前仅见于骆驼科动物和几种软骨鱼类。当前,大量针对重链抗体的研究主要集中在纳米抗体的功能特性及应用方面。纳米抗体除了具有完全的抗原结合活性外,还具有常规抗体所不具备的诸多优势[2],包括如组织穿透能力强、稳定性极高、免疫原性低、易与蛋白裂隙中的隐蔽表位结合[3]、对酶活性具有抑制作用[4-6]等。【本研究切入点】尽管纳米抗体的研究和应用受到了极大的重视,但对于HCAbs自身的功能和特性、其在骆驼体液免疫系统中的作用、与疾病的关系等研究、鲜有文献报道。当前对骆驼HCAb的物理化学性质的研究,主要集中在对其可变区即纳米抗体的温度稳定性方面,发现纳米抗体普遍具有比常规抗体更高的温度耐受性[2-6],然而其在体内的天然形式,即重链抗体是否也具有与纳米抗体一样的温度稳定性,重链抗体是否比常规抗体温度稳定性更高,尚缺乏研究。研究比较纳米抗体、HCAbs与常规抗体之间在温度稳定性方面的差异。【拟解决的关键问题】 研究HCAbs与常规抗体及纳米抗体之间在稳定性的特点,对采用3种不同抗原免疫的新疆双峰驼,以及免疫血清中的IgG1常规抗体与IgG2和IgG3重链抗体及其对应的纳米抗体,在不同温度处理下的抗原结合活性进行比较,分析其温度稳定性的差异,为研究HCAb的功能特性和骆驼适应极端环境的免疫特点提供参考。
1 材料与方法
1.1 材 料
实验动物:3只健康新疆双峰驼(Camelus bactrianus),年龄均在3.5年,雌性2只,雄性1只,由新疆生产建设兵团第十二师提供。
菌种和质粒:大肠杆菌 DH5α、BL21(DE3)和重组质粒 pET30a-spaA-N,pET30a/Lys-23,pET30a/Spa-G26和pET30a/Ali-A4由本室保存。Lys-23、Ali-A4 和Spa-G26为研究组通过噬菌体展示技术从VHH骆驼免疫文库中筛选获得的分别结合溶菌酶、蒜氨酸酶和丹毒丝菌表面抗原A(spaA)的纳米抗体[7-8]。
主要试剂:溶菌酶(12650-88-3)购自 Sigma-Aldrich公司,Protein A Resin FF(L00464)和Protein G Resin FF(L00664)购自南京金斯瑞公司, HRP conjugated Goat anti-Llama IgG(H&L)购自ImmunoReagents公司,Ni-sephorase 6 FF(17-5318-01)购自GE公司。
1.2 方 法
1.2.1 骆驼免疫
溶菌酶、蒜氨酸酶和spaA 3种抗原分别与弗氏完全佐剂(初免)和不完全佐剂(加强)等体积充分混匀乳化作为免疫原,分别对双峰驼进行颈部皮下注射,免疫剂量为 600 μg/次,每2周加强1次,共进行5次免疫。每次免疫前和终免7 d后,颈静脉采血,分离血清,-20℃保存备用。
1.2.2 血清IgG抗体不同亚型的分离和纯化
按Hamers-Casterman[1]方法,分离骆驼免疫血清中的IgG1、IgG2和IgG3抗体亚型。简述如下:将骆驼免疫血清2 mL以PBS稀释2倍后,加入到 Protein G Resin层析柱中,结合10 min,收集与Protein G未结合的流出液备用,分别以洗脱缓冲液 A(0.15 mol/L NaCl、0.58%乙酸、pH 3.5)和洗脱缓冲液 B(0.1 mol/L 甘氨酸,pH 2.7)先后洗脱获得 IgG1 及 IgG3组分。将收集的 Protein G 未结合的流出液,加入到 Protein A Resin层析柱中,结合10 min,以洗脱缓冲液 C(0.1 mol/L 甘氨酸,pH 2.0)洗脱获得 IgG2组分。洗脱的各组分立即中和至 pH 值7.4,在还原条件下对分离的各个亚型 IgG 抗体进行SDS-PAGE 检测。
1.2.3 纳米抗体的表达与纯化
提取纳米抗体重组质粒,鉴定正确后转化至BL21(DE3)感受态细菌。选取阳性转化子诱导表达蛋白。在0.2 mmol/mL IPTG,16℃,150 r/min的条件下过夜诱导表达。诱导后的菌液进行离心处理,超声后再12 000 r/min离心取上清,使用Ni柱亲和层析纯化重组纳米抗体,15%SDS-PAGE检测纳米抗体蛋白的表达及纯化。
1.2.4 ELISA测定免疫血清不同亚型抗体效价
免疫血清、分离纯化的IgG各亚型抗体以及纳米抗体与抗原的结合采用间接ELISA测定。检测设立3个平行重复,终数据取平均值。在96孔板上分别包被1 μg/mL溶菌酶、蒜氨酸酶和spaA 3种抗原。BSA封闭后,加入系列稀释的免疫血清和纳米抗体,孵育后加入羊抗美洲驼IgG(H&L)-HRP抗体,稀释比例为1∶3 000。加入显色底物TMB,在酶标仪中测定450 nm 吸光值。
1.2.5 免疫血清不同亚型抗体与纳米抗体温度稳定性测定
将纯化的各亚型IgG及纳米抗体分别在25、37、50、60、70、80和90℃水浴孵育0.5 h,平衡到室温,在96孔板上包被1 μg/mL各抗原,加入稀释至5 μg/mL的各亚型IgG及纳米抗体,通过ELISA测定其剩余结合活性大小。二抗分别为羊抗美洲驼IgG(H&L)-HRP抗体和鼠抗His-HRP,加入显色底物TMB,在酶标仪中测定450 nm 吸光值。
采用ELISA测定各抗体在不同温度处理下剩余抗原结合活性,每组设立3个平行重复孔,以室温(25℃)处理后的结合值作为100%结合对照,计算每组重复测定样品的平均吸光度值,计算各抗体的相对剩余结合活性:RT Binding =(OD450heat treated/ OD45025℃treated)×100%。
2 结果与分析
2.1 新疆双峰驼免疫血清效价的测定
采用ELISA测定溶菌酶、蒜氨酸酶和spaA 3种抗原第5次免疫骆驼的血清抗体效价。在最后1次(5次)免疫后,3种抗原均能激发明显的抗体反应,抗体效价均在1∶10 000以上。图1
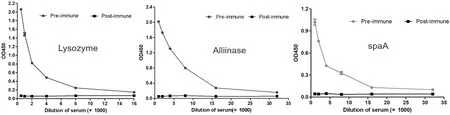
图1 溶菌酶、蒜氨酸酶和spaA第5次免疫双峰驼抗体效价
Fig.1 Camel serum titers of immunization with lysome,alliinase and spaA
2.2 血清IgG抗体不同亚型的分离和纯化
基于骆驼IgG1、IgG2和IgG3与蛋白G和蛋白A的不同结合条件,通过蛋白G+A进行分离。还原条件下 SDS-PAGE显示经蛋白G+A纯化后,先后洗脱获得3种不同分子量的 IgG 抗体,分别为43 KD(重链)的IgG3,50 KD(重链)和25KD(轻链)的IgG1和46 KD(重链)的IgG2,与Hamers-Casterman[1]报道的大小基本相符。图2
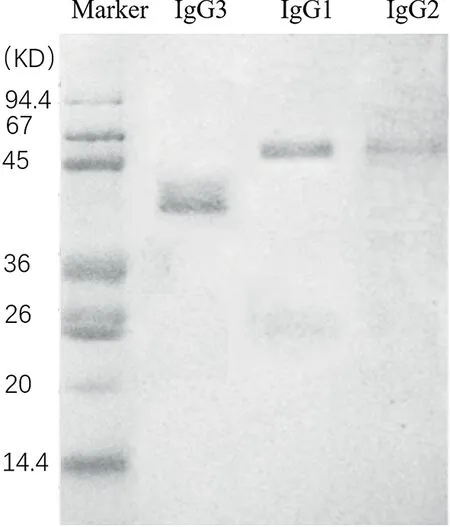
图2 还原条件下 SDS-PAGE 分析 protein G 和protein A 纯化的双峰驼免疫血清中 各IgG亚型
Fig.2 SDS-PAGE analysis of different IgG isotype fractions purified by protein G and protein A chromatography from immune cserum of.bactrianus under reduced condition
2.3 纳米抗体的表达与纯化
保存的pET30a/Lys-23,pET30a/Spa-G26和pET30a/Ali-A4三种质粒转化BL21(DE3)感受态细菌后,挑取阳性转化菌,在0.2 mmol/mL IPTG诱导下,三种表达菌均可以表达重组纳米抗体Lys-23,Spa-G26和Ali-A4。大量诱导表达后,在Ni柱亲和层析中均获得了较高纯度的纳米抗体,3种纳米抗体表观分子量在28Kd(Lys-23和Spa-G26)和23Kd(Ali-A4)附近,与预期大小相符。图3

图3 SDS-PAGE 分析采用Ni离子亲和色谱纯化BL21菌表达的3种纳米抗体Lys-23,Spa-G26和Ali-A4
Fig.3 SDS-PAGE analysis of purified nanobodies of Lys-23 ,Spa-G26 and Ali-A4 by Ni ion affinity chromatography fromE.coliBL21(DE3)
2.4 免疫血清不同亚型抗体和对应纳米抗体温度稳定性的比较
研究表明,3种纳米抗体都表现出较高的温度稳定性,其中纳米抗体Lys-23 和Spa-G26即使在90℃处理下,仍然保留90%的结合活性。而纳米抗体Ali-A4稳定性稍差,90℃处理下,可以保留50%的结合活性。对于3种抗原特异的IgG1常规抗体来说,对温度的敏感性表现出一致性。在60℃温度处理下,抗原结合活性只有50%或更低,而在更高温度下处理,抗原结合活性下降很快。在80℃以上,只有10%的结合活性。对于IgG2和IgG3重链抗体来说,在60℃以上的温度处理下,其抗原结合活性比IgG1常规抗体明显要高,其中,IgG3似乎比IgG2对温度更稳定。但不同的抗原特异的重链抗体,其温度敏感性具有较多差异。在实验中,溶菌酶特异的IgG2和IgG3重链抗体具有更高的稳定性,而蒜氨酸酶结合的IgG2和IgG3重链抗体的稳定性较低。另外,在测定的3个纳米抗体温度稳定性中,2个纳米抗体Lys-23 和Spa-G26在80℃处理下,表现出比室温更高的结合活性,其相对剩余结合活性分别为105%和110%.显示出这2个纳米抗体极高的温度耐受性。图4
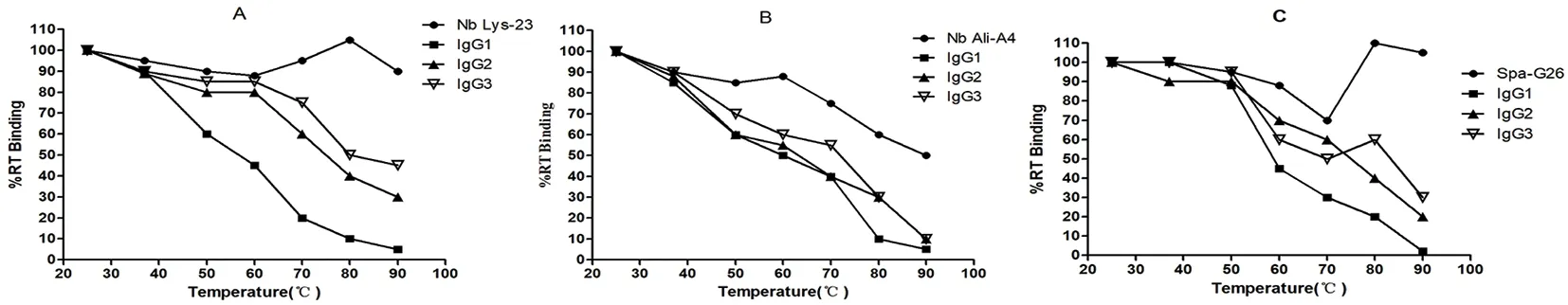
图4 不同亚型抗体和对应纳米抗体温度稳定性的比较
Fig.4 Comparison of thermal stability among nanobodies,conventional antibodies and HCAbs
3 讨 论
通过亲和色谱方法分离和纯化得到双峰驼免疫血清中的IgG1、IgG2和IgG3 3种亚型抗体,采用这些抗体和原核表达纯化得到的相应纳米抗体,首次全面比较了同一抗原结合的重链抗体、常规抗体和纳米抗体在温度稳定性方面的差异。在3种抗体类型中,纳米抗体具有最高的温度稳定性,重链抗体与常规抗体相比具有一定的温度稳定性,而由重链和轻链组成的常规抗体对较高温度的耐受性较差。
经典的IgG抗体由2条相同的重链(H)和2条相同的轻链(L)组成,由H链和L链的可变区(V)共同构成抗体的抗原结合位区。在B细胞的成熟过程中,通过克隆选择和VDJ重排以及体细胞突变和亲和力成熟等机制,形成了高度多样性的抗体库(repertoire)。尽管这个过程在不同脊椎动物有所不同,但最后都组装形成H2L2结构的双价分子,显示出IgG结构在进化中的高度稳定性。HCAbs大约在2 500万年前才在骆驼科出现,属于进化上较新的事件[9]。与常规抗体由12个免疫球蛋白折叠域(immunoglobulin fold domains)组成结构不同,HCAbs只包含6个免疫球蛋白折叠域,而纳米抗体仅有1个免疫球蛋白折叠域。因此,在应对温度等变性条件时,理论上具有较少折叠形式的蛋白片段具有更高的耐受性。本研究取得的试验结果支持该假说。图5
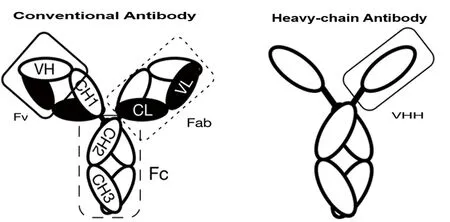
图5 常规抗体和重链抗体结构域比较
Fig.5 Comparison of immunoglobulin fold domainsbetween conventional and heavy-chain antibodies
以往对骆驼抗体稳定方面的研究主要集中在纳米抗体上,很少开展针对HCAbs稳定方面的研究。抗体稳定性除了与免疫球蛋白折叠域数量相关外,还受Fc结构、铰链长度、链间和链内二硫键、可变区CDR序列的影响[10-18].通常情况下,抗体在高于65 ℃温度下就会丧失变性后的可逆性复性作用[12-13],检测的骆驼IgG1符合多数抗体的复性特征。而对于骆驼HCAbs,在检测的溶菌酶和spaA2种抗原特异的IgG2和IgG3重链抗体中,其在65℃温度下的耐受性表现与常规抗体不一样,而与其对应的纳米抗体一致。另外,在试实验中,IgG3具有比IgG2更高的温度稳定性趋势,这可能与2种抗体铰链长短不同有关。IgG3属于短铰链抗体,只有12个氨基酸,而IgG2拥有由36个氨基酸组成的长铰链。因此,从铰链长度来看,IgG3比IgG2在变性条件下更容易复性。纳米抗体温度稳定性的机制主要有二相稳态和疏水内核等学说[19-22]。对于纳米抗体来说,其小分子和单域属性是其耐受温度的主要机制[23],然而并不是所有的纳米抗体都具有很好的温度稳定性。在以往研究的多个纳米抗体中,大约有1/3在高于65 ℃处理下,不具有可逆的复性活性,最近Kunz P等[15]通过对近70个纳米抗体的温度稳定性研究中也发现有相当数量的纳米抗体在65 ℃处理下发生了不可逆的聚集。2个纳米抗体Lys-23 和Spa-G26即使在90℃处理下,仍然保留90%的结合活性,具有极高的温度稳定性。而纳米抗体Ali-A4稳定性稍差,在65℃下,大约可以保留70%的结合活性。这些差异可能与这些纳米抗体中的二硫键有关。Govaert J[18]对二硫键在纳米抗体中的作用进行的研究表明,链内二硫键具有稳定纳米抗体结构并有助于CDR3发挥刚性结构作用。Lys-23 和Spa-G26都具有一对链内二硫键,而Ali-A4不具有链内二硫键。其稳定性符合二硫键在纳米抗体中的作用。
4 结 论
骆驼抗体中的重链抗体、常规抗体和纳米抗体在对高温条件的变性作用下,其可逆性复性作用不尽相同,其中纳米抗体由于小分子和单域属性对温度处理最耐受,重链抗体IgG2和IgG3由于减少的免疫球蛋白折叠域数量,也表现出一定的对高温变性条件的耐受性,而代表常规抗体的IgG1型抗体表现出与其他哺乳动物相似的对高温变性条件的敏感性。了解这些抗体的稳定性特征,可以为理解HCAb的功能特性和骆驼适应极端环境的免疫特点提供线索。另外,在纳米抗体的应用中,稳定性和可溶性都将影响到纳米抗体的工业化生产和在体内的效应。为了延长代谢时间,纳米抗体通常以Fc片段连接的形式在体内作用。

