野大黄散提取物的毒性分析
田其真,蔡丙严,程 汉,郝福星,黄银云
(江苏农牧科技职业学院,江苏 泰州 225300)
野大黄散提取物是将中药野大黄散(野拔子、土大黄、癞蛤蟆草、苎麻根等组成),经水煮、蒸馏、醇沉、减压干燥等工艺加工成的中药复方制剂。野拔子,又名野坝子、野巴子,是云南的一种药食同源植物,其味辛、凉,具有清热解毒、疏风解表、利湿、消食化积的功效[1]。野拔子水、醇提取物对大肠杆菌、沙门氏菌、金黄色葡萄球菌,均具有较强的抑制作用[2]。土大黄为蓼科植物钝叶酸模及羊蹄的根与根茎,其性凉,味辛、苦,具有清热行瘀、杀虫、解毒等功效[3]。土大黄的蒽醌类、黄酮类成分具有抗流感病毒、呼吸道合胞病毒及止咳平喘作用[4-5]。癞蛤蟆草,药名为荔枝草,本品味苦、辛,性凉,归肺、胃、肾经,具有清热解毒、利尿消肿、凉血止血等功效[6]。癞蛤蟆草提取物为黄酮类、萜类、挥发油类等多种类型的化合物,具有止咳平喘、抗炎镇痛、抗病毒、抑菌等多种药理作用[7-8]。苎麻根是荨麻科苎麻属植物苎麻根茎,主要含黄酮类和三萜类化合物,具有清热解毒、止血、止痛、抗病毒、安胎等功效[9-10]。兽医临床上对动物病毒性疾病常使用抗生素防止继发感染,但抗生素过量使用带来的耐药性和药物残留问题日益突出。2018年4月,我国发布《关于开展兽用抗菌药使用减量化行动试点工作的通知》,明确了养殖业抗生素减用和限用的时间表。面对严格规范的兽药管理政策,开发用于提高畜禽免疫力、增强动物抗病能力且低毒、低残留的中药制剂,是畜牧业防制疫病的有效途径[11]。野大黄散提取物中的上述4味中药成分,性味寒凉,具有清热解毒、凉血止血及安胎等功效,符合中兽医对病毒性疾病的治疗原则。方中大部分药物含有黄酮类、蒽醌类等生物大分子成分,具有抗炎、抗病毒、止咳平喘及止血等活性[12-13]。笔者所在课题组前期对野大黄散提取工艺进行了研究,制备了野大黄散提取物。通过观察野大黄散提取物对小鼠的急性毒性和亚慢性毒性作用,评价其用药安全性,旨在为野大黄散提取物的兽医临床用药提供理论依据。
1 材料和方法
1.1 野大黄散提取物
野大黄散提取物是将中药野大黄散(中药野拔子18 g、土大黄14 g、癞蛤蟆草24 g和苎麻根10 g),经水煮、蒸馏、醇沉、减压干燥等工艺制备而成,复方提取物相当于原生药含量为1 g/mL。
1.2 试验动物
健康昆明(KM)小鼠,体质量(20±0.20)g,由扬州大学兽医学院比较医学中心提供,动物生产许可证号:SCXK(苏)2012-0004。饲养在室温20~25 ℃的鼠笼中,自由采食和饮水,观察适应3 d。试验给药前停食12 h,给药后4 h内禁食,但不禁水。
1.3 主要试剂与仪器
天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、肌酐(Cre)、尿素氮(BUN)测定试剂盒,均购自江苏英诺华医疗技术有限公司。小鼠分泌型球蛋白(sIgA)和血清IgG ELISA检测试剂盒,均购自美国R D 公司。CPA电子天平为德国Sartorius公司产品,Exigo eos Vet动物血细胞分析仪为瑞典Exigo公司产品,D280全自动生化分析仪为江苏英诺华医疗技术有限公司产品,Sunrise酶标仪为瑞士Tecan公司产品。
1.4 急性毒性试验
预试验:取小鼠60只,雌雄各半,随机分为A—F,共6组,每组10只,试验前禁食12 h,不限制饮水。A—E组为给药组,分别对应野大黄散提取物1.25、2.50、5.00、10.00、20.00 g/kg 5个剂量组,一次对各剂量组小鼠灌胃给药0.8 mL/只,F组为对照组,灌服等体积生理盐水。连续观察7 d,观察记录小鼠的饮食、行为变化、是否有中毒或死亡症状出现,统计各组死亡及存活数量,采用改良寇氏法计算半数致死量(Median lethal dose,LD50)。
正式试验:取小鼠20只,雌雄各半,随机分为2组,10只/组,试验前禁食12 h,不限制饮水。给药组以野大黄散提取物的最高质量浓度(1 g/mL),一次给药0.8 mL/只,于24 h内灌胃3次,每次间隔6 h,累积灌服的给药总量为120 g/kg,即为最大耐受给药量(Maximal tolerable dose,MTD),对照组灌服等体积的生理盐水。连续观察7 d,并记录小鼠中毒症状及死亡情况。
1.5 亚慢性毒性试验
取小鼠80只,雌雄各半,随机分为4组,每组20只。A—C组为野大黄散提取物给药组,分别以20 g/kg(高剂量)、10 g/kg(中剂量)及2 g/kg(低剂量)一次灌胃给药0.8 mL/只,分别相当于靶动物推荐剂量的100、50、10倍,连续给药35 d,D组为对照组,灌服等体积的生理盐水。试验期间小鼠常规饲养,自由采食,每日观察精神状态、行为反应、粪便性状等,每周称体质量。
1.5.1 样品采集 在第35 天末次给药后,对小鼠禁食不禁水12 h,称取体质量。摘眼球采血,每组采集18只小鼠的血液,其中抗凝血6份用于检测血常规指标,6份血清用于检测生化指标,6份血清用于检测免疫学指标。逐只剖检小鼠,取心脏、肝脏、脾脏、肺脏、肾脏、小肠、睾丸/子宫等称质量,计算脏器指数(脏器指数=脏器湿质量/体质量)。对采集的脏器肉眼观察,并采用福尔马林溶液常规固定,进行病理组织检查。
1.5.2 血常规检测 用全自动血液分析仪检测小鼠抗凝全血中的红细胞数(RBC)、白细胞数(WBC)、淋巴细胞数(LYMPH)、单核细胞数(MONO)和中性粒细胞数(NEUT)。
1.5.3 血生化检测 用全自动血生化分析仪测定血清中天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、肌酐、尿素氮含量。
1.5.4 免疫学检测 参照试剂盒说明书操作,分别检测呼吸道、肠道sIgA和血清中的IgG免疫水平。
1.5.5 病理组织检查 将采集的各脏器用福尔马林溶液常规固定后,送至江苏启动子生物科技有限公司进行石蜡包埋、切片,HE染色,光学显微镜下观察。
1.6 数据处理
试验数据采用平均值±标准差表示,使用SPSS 17.0软件进行统计学分析。
2 结果与分析
2.1 野大黄散提取物的急性毒性试验
由表1可知,与生理盐水对照组比较,野大黄散提取物给药组在预试验期间,小鼠采食、饮水、精神状态、行为活动均未出现明显异常,未发生中毒和死亡现象。分别从5.00、10.00、20.00 g/kg 3个剂量组中随机选取3只小鼠脱臼处死,剖检观察心脏、肝脏、肾脏等脏器,均未见病理变化。小鼠给予野大黄散提取物前后的体质量变化差异不显著(P>0.05)。因此,无法确定野大黄散提取物的半数致死量,表明野大黄散提取物毒性极小。
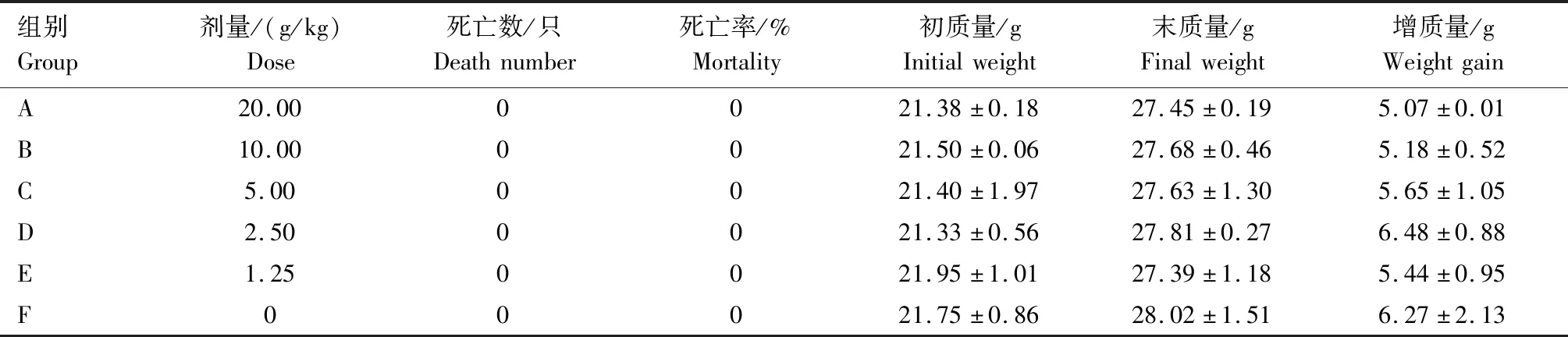
表1 野大黄散提取物的急性毒性试验结果Tab.1 Acute toxicity test results of Yedahuang powder extract
正式试验期间,给药组小鼠每天3次累积灌服120 g/kg的野大黄散提取物,与生理盐水对照组比较,小鼠外观、精神、行为、粪便等均无异常,各组小鼠均无死亡情况,剖检各脏器均无肉眼可见病变。在无法确定半数致死量的情况下,测得MTD>120 g/kg,结果表明,小鼠的最大给药量为120 g/kg,相当于临床用药量0.2 g/kg的600倍,表明野大黄散提取物无毒性作用。
2.2 野大黄散提取物的亚慢性毒性试验
2.2.1 小鼠临床表现 与生理盐水对照组比较,各给药组小鼠采食、饮水、行为活动、粪便等均正常,且口角、眼、鼻等处无分泌物,体质量增加,试验过程中未出现死亡小鼠。
2.2.2 对小鼠体质量的影响 由表2可知,与生理盐水对照组比较,高剂量组与低剂量组在1~35 d体质量差异不显著,中剂量组至第21天后体质量显著上升(P<0.05)。
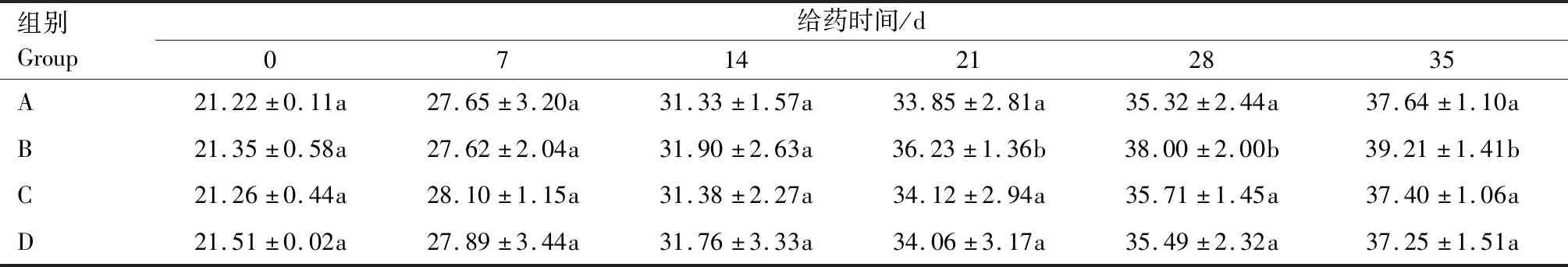
表2 野大黄散提取物对小鼠体质量的影响Tab.2 Effects of Yedahuang powder extract on body weight of mice g
注:同列字母不同表示差异显著(P<0.05),下同。
Note: Different letters in the same column show significant difference (P<0.05), the same below.
2.2.3 对小鼠脏器指数的影响 由表3可知,与生理盐水对照组比较,仅中剂量给药组小鼠脾脏指数显著升高(P<0.05),各组心脏、肝脏、肺脏、肾脏及胸腺指数等差异均不显著。
2.2.4 对小鼠血常规指标的影响 由表4可知,与生理盐水对照组比较,中、低剂量给药组小鼠淋巴细胞数显著升高(P<0.05),高剂量组中性粒细胞数显著升高(P<0.05),其余指标均无显著差异。

表3 野大黄散提取物对小鼠脏器指数的影响Tab.3 Effects of Yedahuang powder extract on organ index of mice
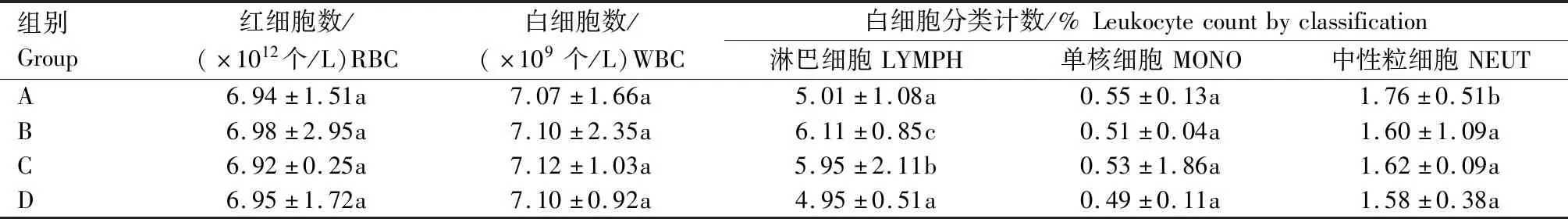
表4 野大黄散提取物对小鼠血常规指标的影响Tab.4 Effects of Yedahuang powder extract on blood routine indexes in mice
2.2.5 对小鼠血清生化指标的影响 由表5可知,与生理盐水对照组比较,各剂量给药组天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、肌酐、尿素氮含量差异不显著。

表5 野大黄散提取物对小鼠血清生化指标的影响Tab.5 Effects of Yedahuang powder extract on serum biochemical indexes in mice
2.2.6 对小鼠免疫学指标的影响 由表6可知, 与生理盐水对照组比较,中剂量组、低剂量组呼吸道与肠道sIgA、血清IgG 差异显著(P<0.05)。
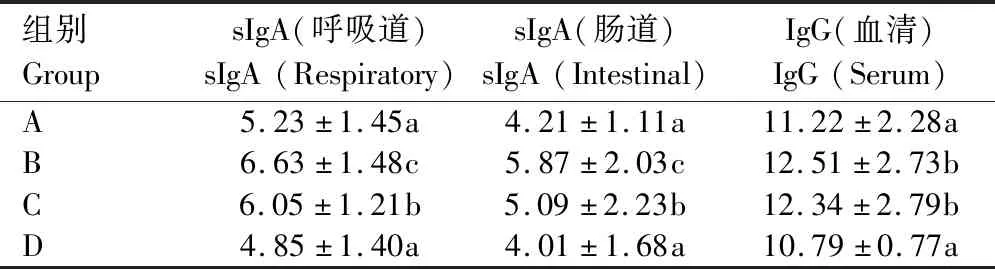
表6 野大黄散提取物对小鼠免疫学指标的影响Tab.6 Effects of Yedahuang powder extract on immunological indexes of mice ng/ml
2.2.7 对小鼠脏器组织的影响 用药第35天时,将各试验组小鼠颈椎脱臼处死,剖检,小鼠各脏器组织均无肉眼可见病变。取各组小鼠的心脏、肝脏、肾脏、脾脏、肺脏、小肠、睾丸/子宫做组织病理切片,400倍光学显微镜下观察,20 g/kg给药组与生理盐水对照组小鼠脏器组织镜检结果见图1。由图1可知,2组小鼠脏器组织结构清晰,未发现颗粒变性、水泡变性和坏死点等变化。结果表明,2组小鼠心脏、肝脏、肾脏、脾脏、肺脏、小肠、睾丸/子宫组织未出现明显的病理变化。
3 结论与讨论
急性毒性试验是新药生物安全评价的重要指标,其结果不仅能确定受试药物中毒作用方式和中毒反应,也可为后续亚慢性毒性试验剂量分组提供参考依据[14]。半数致死量是药物体内急性毒性试验的关键指标,也是对药物急性毒性进行分级的标准[15]。本研究急性毒性试验因受野大黄散提取物剂量和小鼠灌胃给药的影响,无法给予小鼠更大剂量的药物,无法测出其半数致死量。根据世界卫生组织(WTO)有关外源性化学物急性毒性分级标准和《保健食品安全性毒理学评价程序和方法》中所规定的药物急性毒性分级标准,当半数致死量>15 000 mg/kg给药剂量时,视为无毒[16]。本试验中最大剂量组为20 000 mg/kg,因此可认定野大黄散提取物无毒。对无法测出半数致死量的药物,根据中国新兽药研发规范与申报指南的要求,需测定其最大耐受给药剂量[17]。本试验中小鼠最大耐受给药剂量为120 g/kg,相当于靶动物推荐临床用药0.2 g/kg的600倍,试验7 d内均未出现任何毒性反应和死亡现象,且采食、饮水和排便等活动正常,各脏器剖检未见无明显的病理学变化。说明野大黄散提取物对小鼠无急性毒性及致死性损伤,属于实际无毒中药制剂。

A—D分别为高剂量给药组心脏、肝脏、肾脏、脾脏;E—H分别为对照组心脏、肝脏、肾脏、脾脏I—L分别为高剂量给药组肺脏、小肠、睾丸、子宫;M—P分别为对照组肺脏、小肠、睾丸、子宫A—D:Heart,liver,kidney and spleen in the high dose group; E—H:Heart,liver,kidney and spleen in the control groupI—L:Lung,intestine,testis and uterus in the high dose group; M—P:Lung,intestine,testis and uterus in the control group图1 野大黄散提取物高剂量组小鼠各脏器组织病理学变化(400×)Fig.1 Histopathological changes of various organs of mice in high dose group of Yedahuang powder extract(400×)
亚慢性毒性试验是评价药物或毒物亚慢性危害的主要依据,可判断药物对靶器官和受试动物的累积作用,并明确安全的可重复给药剂量值区间[18-21]。为更好地发现药物的亚慢性毒性作用,在亚慢性毒性试验中,小鼠连续以灌胃方式给药35 d,较一般采用的28 d喂养试验多7 d。试验期间野大黄散提取物各剂量组小鼠均未出现死亡及明显的中毒反应,采食、饮水、行为活动均无异常。与生理盐水对照组比较,各剂量给药组小鼠心脏、肝脏、肾脏、脾脏等组织剖检形态完好,组织切片镜检均无显著的病理学变化。脾脏指数与血液中淋巴细胞数均属于免疫学相关指标[22],脏器指数结果表明,中剂量给药组能显著提高脾脏指数。血常规指标检测结果显示,给药组中、低剂量均能提升小鼠淋巴细胞数,表明野大黄散提取物中、低剂量有刺激淋巴细胞增殖作用。高剂量组中性粒细胞数升高,表明小鼠有轻微的炎症反应,可能是长期的灌胃给药刺激所致。药物亚慢性毒性试验中检测靶动物的血生化指标,可作为判定药物对主要脏器是否具有毒性的重要依据[23]。通常天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、尿素氮和肌酐是评价心脏、肝脏、肾脏功能是否正常的重要血生化指标[24-25]。血生化指标检测结果表明,野大黄散提取物各剂量给药组与生理盐水对照组天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、肌酐、尿素氮差异不显著,提示野大黄散提取物对心脏、肝脏、肾脏等脏器无明显的损伤作用。血清免疫学指标检测结果显示,野大黄散提取物对灌胃小鼠的呼吸道、肠道sIgA及血清中IgG水平具有显著的免疫调节作用,但具体调节机制尚需进一步研究。
通过观察灌胃给药后小鼠的临床表现、体质量、脏器指数、组织病理学变化,以及测定血清生化和免疫学等多项指标,综合判定野大黄散提取物的毒性。结果表明,野大黄散提取物无毒副作用,是安全性较高的中药制剂。

