再次及多次心脏瓣膜置换术体外循环插管路径选择策略分析
孔 博,杨 研,孙寒松,杨克明
随着心脏外科手术的广泛开展,在接受初次心脏手术后,需要进行再次甚至多次心脏手术的患者数量逐渐增多。 由于在锯开胸骨和游离心包粘连时,大动脉损伤、心房、心室破裂,室颤等危急情况较第一次手术更容易发生,因此,再次心脏手术开胸和体外循环(extracorporeal circulation, ECC)建立,对于外科医生长期以来都是一个较大挑战,也是造成患者预后不良的重要原因[1]。 基于国情,在全部接受再次及多次心脏外科手术患者中,由各种原因所致的需行心脏瓣膜置换的患者所占比例最大。 再次心脏瓣膜置换,根据瓣膜所在部位,可分为:二尖瓣置换(mitral valve replacement, MVR),主动脉瓣置换(aortic valve replacement, AVR),三尖瓣置换(tricuspid valve replacement, TVR),肺动脉瓣置换(pulmonary artery valve replacement, PVR),联合瓣膜置换(double valve replacement, BVR)以及单心室共同房室瓣置换。 由于不同瓣位病变的病理生理和病理解剖改变迥异,再次或多次手术ECC 建立的较理想途径也会不同。
目前国内、外关于不同瓣位再次瓣膜置换手术,ECC 插管策略选择方面的报道较少。 本文拟通过总结本院2014 年1 月至2019 年7 月,接受再次或多次心脏瓣膜置换术患者ECC 建立的方式,尤其是动、静脉插管的路径选择,归纳出不同瓣位再次瓣膜置换ECC 插管选择的策略,以及选择经外周血管途径建立ECC 的应用指征。
1 资料与方法
1.1 临床资料 全部接受再次或多次心脏瓣膜置换患者共552 例,其中男性247 例,女性305 例,年龄0.8~79(45.5±3.0)岁,体重7.9~102(59.5±10.6)kg。 手术方式为:MVR 231 例,AVR 143 例,TVR 36例,PVR 58 例,BVR 57 例,先天性心脏病单心室共同房室瓣置换3 例,由于合并主动脉置换(Bentall、Wheat、弓部血管替换)手术在再次瓣膜置换手术中比较常见且同时对于ECC 建立有较大影响,笔者将合并主动脉置换手术患者单独列为1 组(AOR 组),共24 例。 合并其他手术,如房间隔缺损修补、室间隔缺损修补、心内膜垫缺损修补、房颤迷宫消融手术、冠状动脉旁路移植(非二次手术)的患者,因对ECC 的建立影响不大,未单独列组。 本研究指的再次或多次瓣膜置换患者,其之前所接受的手术包括但不限于瓣膜置换术。
1.2 术前评估 除心脏超声、心电图、抽血化验等常规检查外,需行全主动脉增强CT 扫描了解:①胸骨与无名静脉、升主动脉、右房、右室前壁,以及双侧胸膜腔的关系;②合并冠状动脉旁路移植手术史患者桥血管的通畅性;③升主动脉钙化及斑块形成情况;④下肢动脉尤其是双侧股动脉是否合并狭窄及斑块形成情况;④对于合并严重肾功能不全或者血流动力不稳定的患者,可仅选择心脏CT 平扫。 手术前的正、侧位胸片检查可以看到胸骨固定物的数量和方法,可以估计前次手术植入的人工瓣膜的类型和尺寸,胸骨与心脏粘连的情况。 对于合并或怀疑冠状动脉粥样硬化性心脏病或50 岁以上患者,常规行冠状动脉造影检查,了解冠状动脉、桥血管通畅情况和人工瓣膜瓣叶的活动幅度。
1.3 ECC 插管技术
1.3.1 再次瓣膜置换手术的ECC 建立方式 动脉插管主要路径包括:升主动脉、股动脉、股动脉+升主动脉。 静脉插管路径主要包括:腔静脉、股静脉、上腔静脉+股静脉、颈内静脉+股静脉。 ECC 建立的插管方式主要存在如下几种组合:①升主动脉-腔静脉途径:经典的正中开胸途径,与一次手术无异;②股动脉-股静脉途径:右(或左)下肢腹股沟附近切口,股动脉-股静脉插管建立ECC,然后再正中开胸完成手术;③股动脉-腔静脉途径:股动脉途径行动脉插管,正中开胸,经腔静脉途径行静脉插管,股动脉插管和正中开胸的先后顺序根据胸骨粘连情况来确定;④股动脉+升主动脉-股静脉+上腔静脉(或颈内静脉):先经股动脉,股静脉建立ECC,开胸后,行升主动脉插管,停止股动脉灌注,根据静脉引流情况和瓣膜置换的瓣位决定是否加用上腔静脉插管引流。 个别患者出于特殊情况,上腔静脉引流方式采用经皮颈内静脉引流。 PVR 患者接受股动脉+升主动脉插管,即先经过股动脉-股静脉插管,建立ECC,正中开胸后,再经升主动脉插管进行动脉顺行灌注并拔除股动脉插管,停止经下肢灌注。
1.3.2 外周血管插管技术 ①颈内静脉插管:麻醉成功后由麻醉医师经颈内静脉置入21 F DLP(美敦力公司)静脉插管;②股动脉插管:通常经右侧股动脉进行。 游离股动脉后,寻找柔软的没有斑块的位置,作为准备插管的部位。 根据术者偏好,可选择18~24 F(国产)或17~22 F(进口)动脉插管。 股动脉切开插管方法:依次阻断股动脉远心端和近心端,中间作一横切口,长度约为血管周长的1/2 ~2/3。动脉插管管口斜面朝下插入股动脉,松开近心端阻断钳,插入股动脉插管,插管进入血管内长度约2~3 cm,到位后旋转180 度,使管口斜面朝上,近心端线绳打结并固定在插管上。 股动脉穿刺插管方法:5-0 或4-0 Prolene 线在股动脉前壁做荷包缝线并套管,在荷包缝线内以16 G 穿刺针穿刺股动脉,送入导丝,17 ~22 F 带内芯动脉插管经导丝穿刺进入股动脉达髂动脉水平,拔出内芯和导丝连接ECC 动脉管路并收紧荷包套管。 ③股静脉插管:游离股静脉并用5-0 或4-0 Prolene 线作荷包缝线,用尖刀在荷包内切一小口,经切口送导丝进入下腔静脉,过膈肌水平;21~28 F 髂静脉-右心房带内芯插管穿导丝,经股静脉切口进入下腔静脉达膈肌水平后,拔出内芯和导丝,继续推进静脉管进右房,直至顶端引流口达上腔静脉;收紧Prolene 荷包线并固定静脉管。
1.3.3 升主动脉-腔静脉插管技术 按照常规的动脉及静脉插管途径,建立ECC。
1.3.4 左心引流管的放置 均通过右上肺静脉或房间隔进行引流。
1.4 统计方法 所有数据使用SPSS 22.0 软件进行统计分析,符合正态分布的计量资料以均数±标准差()表示,多组间比较,采用单因素ANOVA 检验。 不符合正态分布的计量资料用中位数和四分位间距[Q(Q1,Q3)]表示;计数资料以频数(百分比)表示,多组间比较采用χ2检验或Fisher 精确检验。P <0.05 认为差异具有统计学意义。
2 结 果
2.1 各组患者术前资料 PVR 和共同房室瓣置换均为先天性心脏病患者,年龄显著低于其余各组( P<0.05),余患者组间年龄和体重无显著差异。 见表1。
2.2 ECC 各组动、静脉插管路径选择策略 在ECC插管方式选择方面①动脉插管方式:在全部552 例患者中,采用升主动脉插管者共458 例(83.0%);单纯股动脉插管61 例(11.0%);股动脉联合升主动脉插管33 例(6.0%)。 MVR、AVR、TVR、BVR 以及共同房室瓣置换者动脉插管途径均以升主动脉为主,对于合并主动脉置换者,动脉插管方式以股动脉为主。 PVR 组采用股动脉+升主动脉插管、合并主动脉置换组采用股动脉插管的比例均显著高于其余各组( P =0.000)。 ②静脉插管方式:在全部552 例患者中,采用腔静脉插管者共508 例(92.2%);单纯股静脉插管11 例(2.0%);股静脉+上腔静脉插管32例(5.6%);股静脉+颈内静脉插管1 例(0.2%)。MVR、AVR、TVR、BVR、合并主动脉置换以及共同房室瓣置换患者,均以腔静脉插管为主。 PVR 组患者有半数患者采用了股静脉+上腔静脉插管方式,较其余6 组采用该方式患者比例更高( P <0.05)。 见表2。
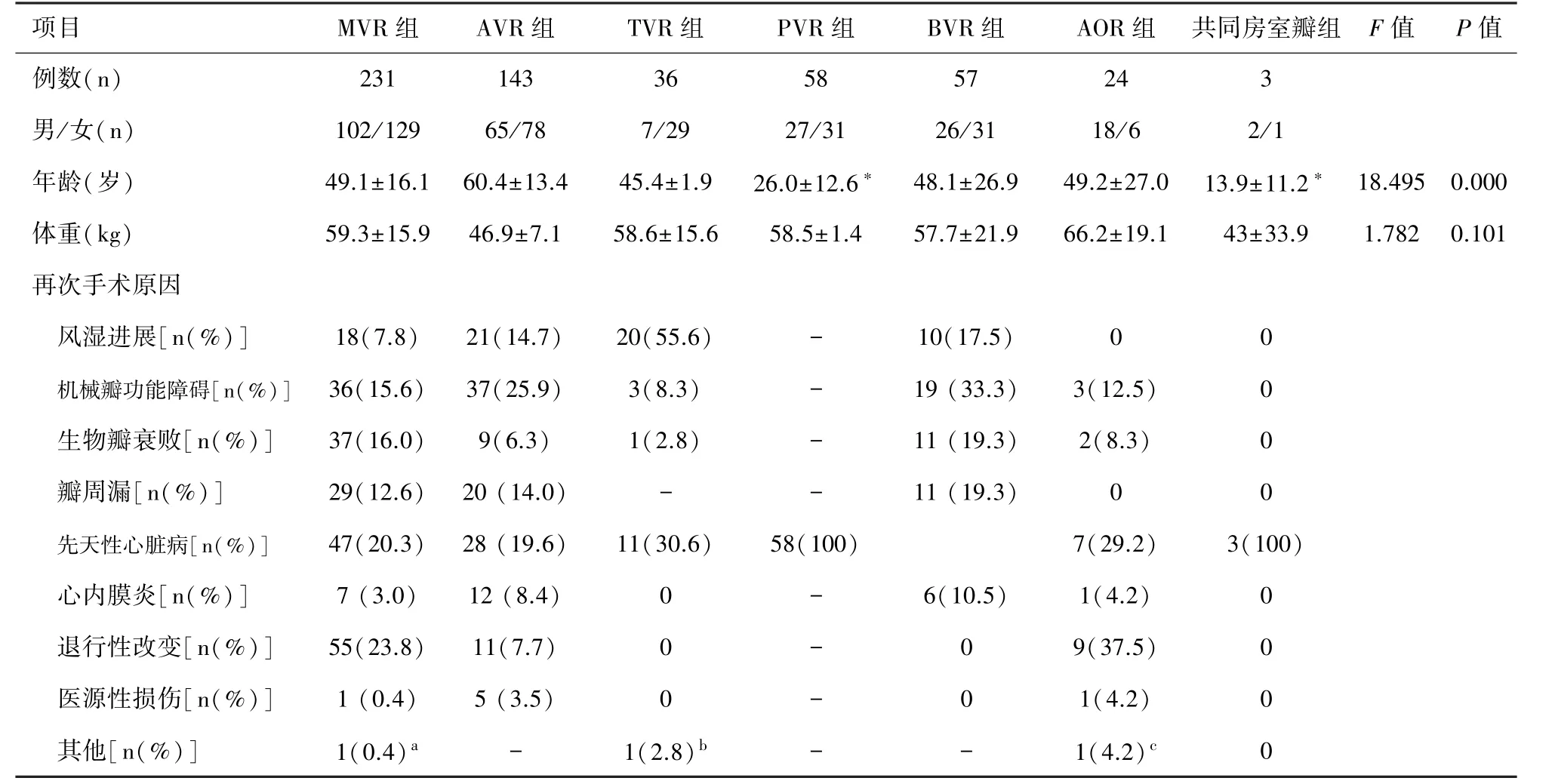
表1 各组患者术前资料
2.3 各组患者术中及术后资料 本组19 例PVR 和1 例TVR 患者因不合并其他心内操作,无需主动脉阻断,在心脏不停跳下完成手术。 各组之间由于手术操作不同,阻断时间和转机时间均存在显著差异( P <0.05)。 BVR 组阻断时间和转机时间最长,TVR组阻断和转机时间最短。 合并主动脉置换组,由于有主动脉夹层等危重情况,ICU 停留时间和术后住院时间要显著长于其他各组( P <0.05)。 全组早期死亡9 例(总死亡率1.6%)。 包括MVR 组5 例(死亡率2.2%),其中左室破裂2 例、消化道出血,多脏器功能衰竭1 例、感染1 例、右室双出口第5 次手术,术后严重低心排1 例;BVR 组3 例(死亡率5.3%),其中脑出血2 例,消化道出血1 例;合并主动脉置换组1 例:该患者为风湿性心脏病,MVR术后,在二次手术行TVR 时,采用股动脉切口,股动脉插管致主动脉逆行夹层,同期行升主动脉置换术,术后循环不能维持,死亡。 见表3。
3 讨 论
随着全球范围再次心脏手术数量的不断增加,术前判断再次手术患者发生心脏大血管损伤的危险性以及减少再次开胸心脏大血管损伤所带来不利影响的手段和措施近些年来受到较多关注[1-5]。 在肝素涂层的股动、静脉管路得以临床应用后,先经股动、静脉转机建立ECC,然后再开胸成为避免和减轻上述损伤的一个重要选项,在一些中心甚至处于主导地位[6]。 本组病例在行再次手术之前,都会评估下肢动脉情况,常规将下肢股动脉部位消毒铺单,以备插管转机使用。 但不同瓣位再次瓣膜替换,在何种情况下先行外周血管ECC 报道较少。
本研究结果显示,对大多数再次MVR、AVR 和BVR 患者均可通过传统的升主动脉-腔静脉途径安全地建立ECC;再次手术行TVR 患者,虽常伴右心房、右心室明显增大,但大多也可以通过谨慎锯开胸和谨慎心包内游离来避免心脏损伤而无需经外周血管ECC。 上述患者中采用股动脉或股动脉+升主动脉插管的属于少数,主要见于:①既往行升主动脉置换手术者,如马凡综合征患者;②开胸时损伤心脏及大血管(无名静脉、右心室、右心房、升主动脉、外管道)或桥血管,紧急经股动脉插管;③急诊手术或合并严重心功能不全,预估无法耐受正中开胸和较长游离过程的患者。
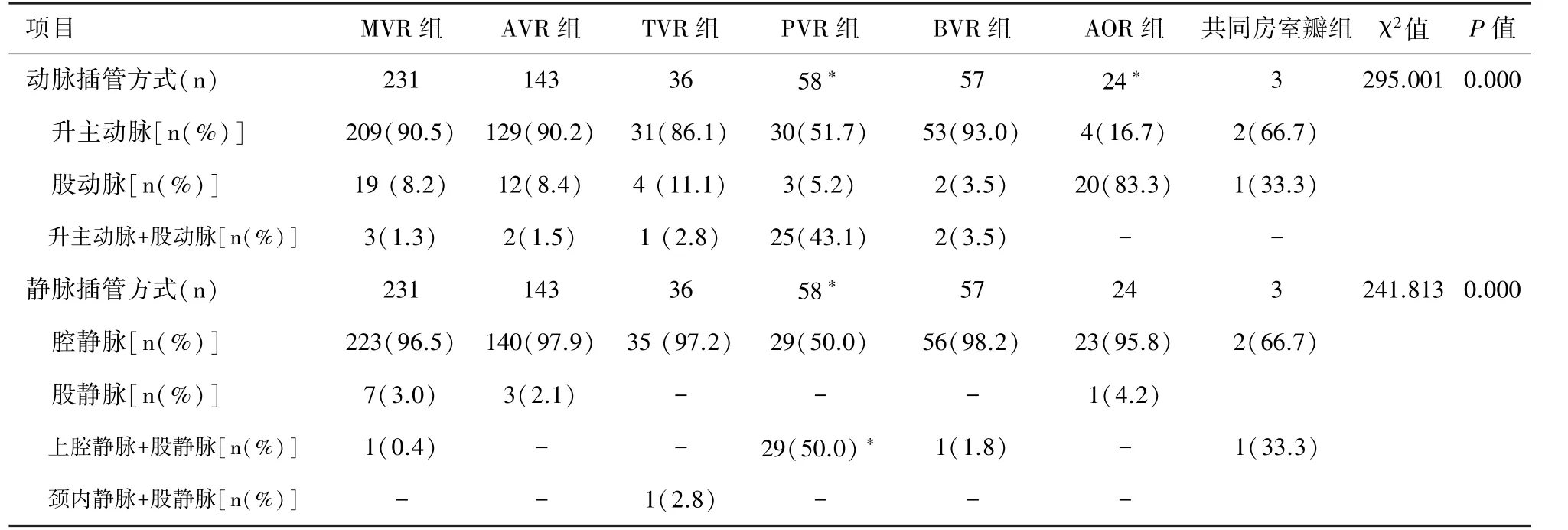
表2 各组ECC 动脉和静脉插管路径
表3 各组术中和术后资料
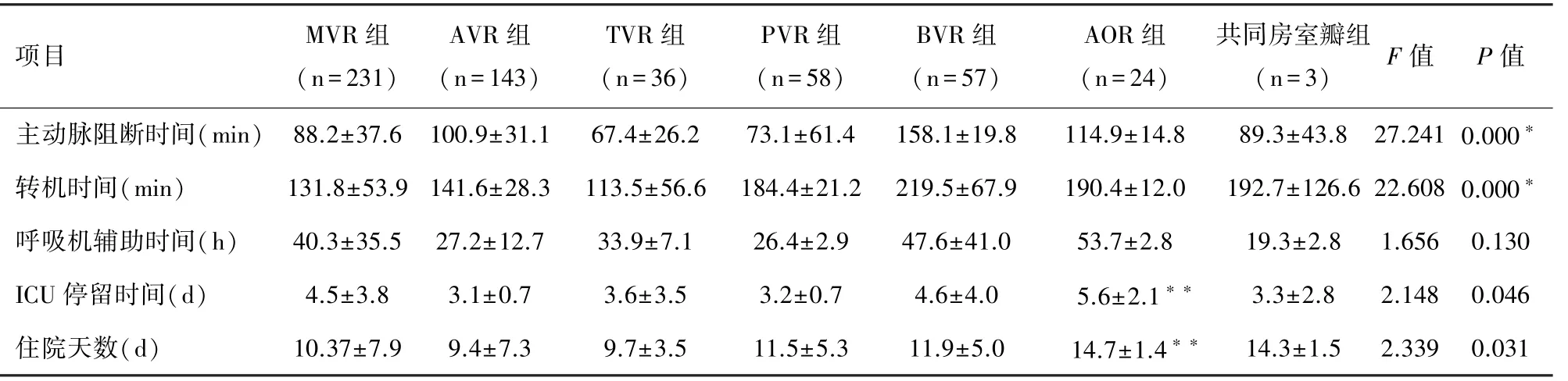
表3 各组术中和术后资料
注:*:由于各组手术方式不同,各组间主动脉阻断和转机时间均有显著差异,但这种比较意义不大;**:表示单因素ANOVA 检验与其他组比较P <0.05,其余各组间比较差异无显著性。
项目 MVR 组(n=231)AVR 组(n =143)TVR 组(n =36)PVR 组(n=58)BVR 组(n =57)AOR 组(n =24)共同房室瓣组(n =3) F 值 P 值主动脉阻断时间(min) 88.2±37.6 100.9±31.1 67.4±26.2 73.1±61.4 158.1±19.8 114.9±14.8 89.3±43.8 27.241 0.000*转机时间(min) 131.8±53.9 141.6±28.3 113.5±56.6 184.4±21.2 219.5±67.9 190.4±12.0 192.7±126.6 22.608 0.000*呼吸机辅助时间(h) 40.3±35.5 27.2±12.7 33.9±7.1 26.4±2.9 47.6±41.0 53.7±2.8 19.3±2.8 1.656 0.130 ICU 停留时间(d) 4.5±3.8 3.1±0.7 3.6±3.5 3.2±0.7 4.6±4.0 5.6±2.1** 3.3±2.8 2.148 0.046住院天数(d) 10.37±7.9 9.4±7.3 9.7±3.5 11.5±5.3 11.9±5.0 14.7±1.4** 14.3±1.5 2.339 0.031
对于合并主动脉置换者,本组病例常规先正中开胸,经股动脉插管,再经腔静脉插管。 如粘连严重,也可先股动脉插管再正中开胸。 股动脉-股静脉途径先建立ECC,不是本组的首选。
相较其他各组,PVR 患者有其自身的特点。 该类患者全部为法洛四联症或肺动脉闭锁矫治术后,因重度肺动脉瓣反流行PVR 术。 先行股动脉-股静脉ECC,再正中开胸比例较高。 上述患者中,43.1%患者采用股动脉+升主动脉单泵双管;50%患者采用上腔静脉+股静脉径路。 先行股动静脉转机主要见于以下情况:①术前CT 检查提示患者升主动脉增粗,前移明显,甚至合并有主动脉窦部扩张,并紧贴胸骨;②前次手术应用了肺动脉外管道且外管道横跨纵隔中线;③右室显著增大,正中开胸很难避免右室损伤。 在心内游离基本完成后,停止股动脉灌注,拔除股动脉插管,改为升主动脉插管灌注。 这样操作,主要是为避免股动脉灌注的诸多弊端,如下肢缺血,脏器灌注不足等,对于心内操作复杂,转机时间长的患者采用这种策略尤为必要。
外周血管途径ECC 时,颈内静脉置管引流上腔静脉,并不是常规选择。 因为对于大多数经股动、静脉径路ECC 者,都是正中开胸遇到意外情况,紧急股动、静脉插管。 预先经颈静脉置管对防范手术风险意义不大。 本组仅1 例患者静脉插管方式选择颈内静脉+股静脉,该患者为第三次手术、急诊TVR,患者合并严重心衰,右心房内血栓形成,为尽早将心脏引空并避免触及右房内血栓而选择经颈内静脉和股静脉建立静脉引流。
对于再次MVR 和TVR,有报道可先经股动、静脉建立ECC,右侧开胸完成手术,并认为此方式较传统的正中开胸径路结果更好[7-8],但这种方式的应用范围受限,同时,增加右侧胸部和股动脉切口明显加大了手术的创伤,本组患者未采用这种方法。
综上所述,对于再次或多次心脏瓣膜置换手术,根据所处瓣位情况,ECC 插管策略有各自特点。 “升主动脉-腔静脉”策略适用于绝大多数MVR、AVR、TVR、BVR 以及共同房室瓣患者;“股动脉+升主动脉-股静脉+上腔静脉”策略在PVR 患者应用较多;“股动脉-腔静脉”策略主要应用于合并主动脉置换的患者。

