椎间盘退变分子机制及相关信号转导通路的研究进展
朱健 邓易 胡栩策 史建刚
椎间盘退变导致的慢性下腰痛在全球范围造成极大的社会经济负担[1-2]。然而引起椎间盘退变的确切机制还未被阐明,目前,包括手术在内的治疗措施都是针对个体的症状缓解和支持治疗,而非直接针对椎间盘退变的治疗[3-4]。椎间盘退变的发病机制非常复杂,由生物力学损伤所导致的细胞凋亡和自噬,促炎性因子的释放,以及基质分解代谢增加等均被认为是其可能的发病机制[5-8]。椎间盘退变被认为与椎间盘衰老密切相关。
1 椎间盘细胞衰老的诱因
激活细胞衰老的分子机制具有起源依赖性[9-10],所以阐明细胞衰老的起源和诱因具有重要意义。与椎间盘细胞衰老和椎间盘退变相关的诱因包括以下几方面。
1.1 端粒变短与DNA损伤
端粒会随着复制而不断变短,这也是第一个被发现与细胞衰老相关的因素。端粒缩短是限制真核细胞复制能力的重要机制,其可通过激活p53-p21-Rb信号转导通路介导衰老。端粒会随着椎间盘衰老的进展而不断变短[11-12],细胞通过激活DNA损伤反应以应对端粒变短。因此,广义上来说,DNA损伤是细胞衰老的内在诱因。研究发现,包含电离辐射和氮芥在内的DNA损伤因子均可增加野生型小鼠髓核中p16阳性细胞的数量。BRCA1、XRCC4和DNA连接酶Ⅳ等DNA修复基因失活也会导致细胞衰老[13-16]。DNA损伤能够激活p53-p21-Rb和p16-Rb信号转导通路,进而诱导细胞衰老[17-18]。考虑到端粒缩短和DNA损伤是重要的与衰老相关的分子机制,我们推测衰老的椎间盘细胞随着年龄增长而积聚于椎间盘中,并最终导致椎间盘退变。然而与我们的猜测不同,许多研究并没有发现椎间盘细胞的衰老与患者年龄相关[12,19-20]。
1.2 氧化应激
椎间盘退变的恶劣微环境特点为营养不良,细胞因子升高,以及氧化应激等[21-22]。这些恶劣因素的刺激导致椎间盘细胞发生应激诱导性早衰。氧化应激是引起细胞衰老的主要因素。髓核细胞是活性氧(ROS)的主要来源之一,椎间盘内的ROS水平随着椎间盘退变的进展而升高。过氧化氢可明显抑制髓核细胞增殖并显著促进H2A.X foci(髓核细胞DNA损伤的标记)的形成,还可增加衰老相关的β-半乳糖苷酶(SA-β-Gal)阳性的椎间盘细胞的数量。此外,过氧化氢可激活衰老的信号转导通路,诱导髓核细胞的细胞周期停滞在G0/G1期[23-24]。这些研究表明,退变的椎间盘微环境中,氧化应激是椎间盘细胞衰老的诱因。
1.3 营养缺乏
营养缺失会导致细胞生物学行为的改变。不同的营养成分对椎间盘细胞的衰老有不同影响。血清成分对调节椎间盘细胞周期至关重要。大量血清来源的生长因子已被证明可以促进椎间盘细胞的增殖,它们包括胰岛素样生长因子(IGF)、成纤维细胞生长因子(FGF)和血小板来源生长因子(PDGF)。IGF-1可抑制氧化应激诱导的椎间盘细胞衰老。然而,这些生长因子对椎间盘细胞的有效性取决于它们通过软骨终板从血管扩散到椎间盘中心的速度。软骨终板的通透性可由于终板钙化或糖尿病引起的微血管病变而降低[25-26],导致营养分子到达椎间盘中心的主要路径被阻断,椎间盘中生长因子的效能降低,加速椎间盘细胞衰老。
1.4 促炎性细胞因子
随着椎间盘退变的进展,退变椎间盘内促炎性细胞因子水平升高。包括肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1α、IL-1β、IL-6、IL-17和各种趋化因子在内的细胞因子被普遍认为是引起椎间盘退变的介质。这些介质使细胞外基质的分解代谢增加,椎间盘的炎症反应增高,导致椎间盘结构和功能的恶化。近年来,一些学者针对细胞因子对椎间盘细胞衰老的影响进行了研究。研究表明,TNF-α可以增加由器官培养的牛椎间盘中SA-β-Gal阳性细胞数量,并诱导细胞外基质从合成代谢转向分解代谢[27]。在用TNF-α和IL-1β处理的大鼠髓核细胞中同样观察到SA-β-Gal阳性细胞数量的显著增加,表明细胞因子在退行性椎间盘中是强大的促进细胞衰老的因素[27-28]。
1.5 异常的机械负荷
异常的机械负荷是引起椎间盘退变的危险因素之一。对大鼠进行前肢截肢处理建立与人类直立姿势相似的大鼠直立姿势模型。研究表明,长时间的直立姿势会导致各个方向的机械负荷异常,进而导致一系列椎间盘退变的改变,包括胶原结构紊乱,纤维环破裂,椎间盘高度降低,以及基质合成代谢减少与分解代谢增加。异常负荷可以使SA-β-Gal阳性细胞数量增加,并上调衰老相关性基因的表达,包括p16、p27、Rb、张力蛋白同源性10号染色体缺失的磷酸酶基因(PTEN)、p27KIP、p19ARF和晚期糖基化终末产物受体(RAGE)等[29]。这表明异常的机械负荷可以促进椎间盘细胞的衰老。机械应力增加了ROS产生,并促进应激诱导性早衰发生[30]。这些结果为椎间盘细胞衰老在椎间盘退变发病机制中的作用提供了进一步的证据。
2 椎间盘细胞衰老相关信号转导通路
对椎间盘细胞衰老相关信号转导通路的探索还处于起步阶段。在此,我们对几个主要且已得到较明确阐述的信号转导通路进行讨论。
2.1 中心信号转导通路
p53-p21-Rb通路和p16-Rb通路是介导椎间盘细胞衰老的中心信号转导通路。
p53-p21-Rb通路在端粒侵蚀及DNA损伤反应诱导的衰老中被激活。抑癌基因p53在生物体内细胞生理中的作用非常广泛。在细胞衰老方面,p53对端粒缩短或DNA损伤作出反应,从而启动不可逆性细胞周期阻滞的第一步。在DNA损伤位点的组蛋白2AX(H2AX)被特异性磷酸化为γ-H2AX。γ-H2AX参与染色质结构改变,募集细胞循环检查点激酶(Chk)-1和DNA修复蛋白[共济失调毛细血管扩张突变蛋白(ATM)和共济失调毛细血管扩张突变基因相关蛋白(ATR)]。ATM可直接磷酸化p53使之激活。ATM和ATR也可通过磷酸化Chk-1和Chk-2间接激活p53[31]。在p53下游,p21抑制细胞周期激素依赖激酶(CDK)2, 而CDK2抑制Rb磷酸化。由于细胞周期从G1期到S期的进展依赖于Rb的过磷酸化,这种去磷酸化Rb无法激活转录因子E2F来促进G1期到S期进展所需基因的表达,最终导致细胞周期阻滞[32]。
与上述通路不同,p16-Rb通路被不同的刺激(尤其是氧化应激)激活,从而导致应激诱导性早衰发生。p16是CDK4和CDK6的抑制剂,当p16被氧化应激激活时抑制CDK4和CDK6,导致Rb去磷酸化和细胞周期停止。研究表明,衰老椎间盘细胞中发现p16表达,且椎间盘组织中p16阳性细胞数量与椎间盘退变的组织学分级呈正相关。
综上所述,椎间盘细胞衰老主要由p53-p21-Rb和p16-Rb途径介导。这些信号转导通路汇聚于Rb,调节椎间盘细胞的细胞周期。在椎间盘退变过程中,DNA损伤和各种刺激均可激活这两条通路,进而使衰老椎间盘细胞的细胞周期阻滞。
2.2 微囊蛋白-1与椎间盘退变
细胞质膜微囊是细胞膜上的内陷小泡。微囊蛋白(Caveolin)-1是质量为21~24 kDa的完整膜蛋白,对微囊的结构和功能至关重要。研究已证实,在退变椎间盘内有Caveolin-1表达,且其表达与p16的表达呈正相关[33],这提示Caveolin-1在髓核细胞应激诱导性早衰中发挥一定作用。同时,Caveolin-1的表达与p53上调有关,提示Caveolin-1在p53依赖的信号转导通路中发挥作用。Caveolin-1和p53可能协同作用诱导椎间盘细胞的复制衰老[34]。不过,对Caveolin-1调控椎间盘细胞衰老中心信号转导通路的确切机制还需要进一步的研究来阐明。
2.3 p38-丝裂原活化蛋白激酶信号转导通路
应激诱导性早衰是由p38-丝裂原活化蛋白激酶(MAPK)信号转导通路介导的,细胞因子和生长因子,氧化应激,原癌基因等多种外部刺激均可激活该通路[35]。在氧化应激下,p38被MAPK激活酶(MKK)3和MKK6激活。随后p16被激活,Rb被去磷酸化,导致细胞周期进程停止。同时,p38-MAPK介导的氧化应激还可激活DNA损伤反应,进而诱导细胞衰老。p38上调烟酰胺腺嘌呤二核苷磷酸(NADPH)氧化酶的表达,从而产生更多导致DNA损伤的过氧化物,随后激活p53-p21-Rb信号转导通路[36]。研究表明,在体内退变的纤维环内p38表达上调,这为p38-MAPK信号转导通路在椎间盘细胞衰老中的作用提供了证明[37]。
2.4 Wnt/β-catenin信号转导通路
研究发现,Wnt/β-catenin信号转导通路的激活物氯化锂可抑制椎间盘细胞增殖,促进椎间盘细胞衰老,这表明Wnt/β-catenin信号可触发椎间盘细胞衰老。Wnt与各种受体结合,与下游的转录效应器共同激活不同的信号转导通路,调节细胞的增殖、分化和凋亡。c-myc蛋白和细胞周期蛋白D1对髓核细胞的细胞周期进程都是必不可少的,而Wnt信号转导通路抑制髓核细胞中c-myc蛋白和细胞周期蛋白D1的表达,从而抑制细胞周期的进行[37]。
2.5 哺乳动物雷帕霉素靶蛋白信号转导通路
衰老的椎间盘细胞虽然不能复制,但却分泌更多的特异性蛋白质,且细胞大小和质量均有所增加,这表明细胞周期阻滞与细胞衰老表型形成并不偶联。哺乳动物雷帕霉素靶蛋白(mTOR)信号转导通路是磷脂酰肌醇3-激酶(PI3K)通路家族的一员,为细胞获得衰老表型所必需。只有当细胞周期阻滞和mTOR信号转导通路激活同时发生才能导致细胞衰老,若mTOR信号转导通路无激活则仅导致细胞静止,而非细胞衰老[38]。
2.6 1型Sirtuin蛋白
p53除了在mRNA水平和蛋白质水平受到调控外,还受到翻译后修饰(如乙酰化和磷酸化)的调控。早幼粒细胞白血病蛋白(PML)通过翻译后的乙酰化激活p53。 1型Sirtuin蛋白(SIRT1)可使 p53去乙酰化,从而延缓PML诱导的细胞衰老。而SIRT1在人髓核细胞中也有表达,其mRNA水平随年龄增长而升高。髓核细胞中的SIRT1也能使p53去乙酰化,从而抑制p53对椎间盘退变的促进作用,即SIRT1可通过抑制p53依赖性退变信号转导通路,在椎间盘退变过程中发挥保护性作用[39]。
图1为椎间盘细胞衰老相关信号转导通路的示意图。
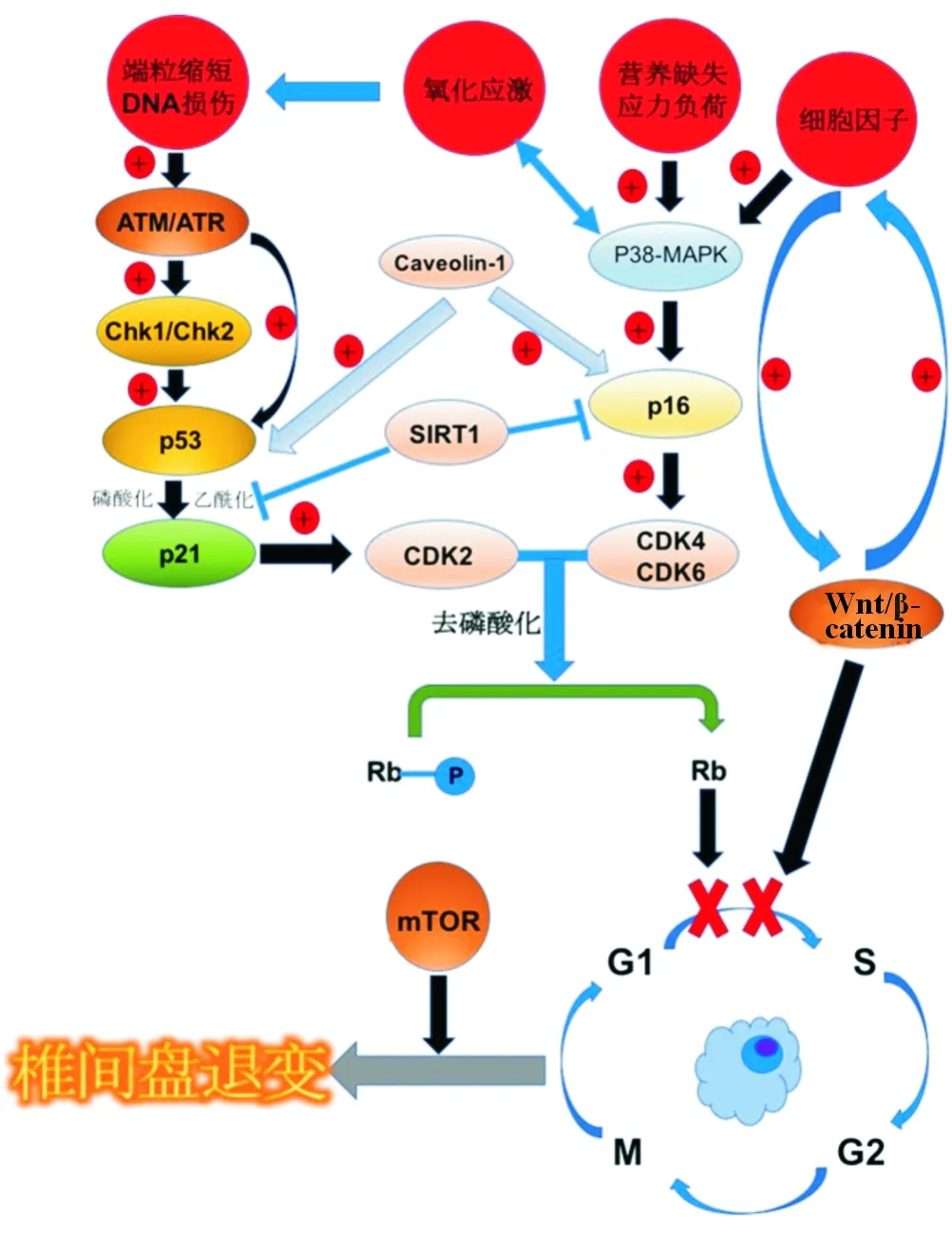
注:+表示促进,×表示抑制, →表示介导
图1椎间盘退变相关信号转导通路示意图 椎间盘退变的分子机制包括细胞周期阻滞和椎间盘细胞衰老。p53-p21-Rb和p16-Rb信号转导通路在细胞周期阻滞中起主要作用。Caveolin-1介导p53和p16的表达,进而促进椎间盘退变,而SIRT1抑制p21和p16的表达进而阻断椎间盘退变。Wnt/β-catenin信号转导通路和相关细胞因子形成正反馈,促进椎间盘退变。此外,mTOR信号转导通路也可促进椎间盘退变
3 小结与展望
综上所述,椎间盘退变是多因素导致的复杂的综合性疾病,涉及肿瘤学、免疫学、分子生物学、细胞生物学等多个领域。椎间盘退变的诱因涉及端粒变短,DNA损伤,氧化应激,营养缺乏,促炎性细胞因子增加,异常机械负荷等。尽管有证据表明介导椎间盘细胞衰老的中心信号转导通路为p53-p21-Rb通路和p16-Rb通路,但是各信号分子的确切作用并未得到完全阐明。椎间盘退变具有一定遗传性,但确切的基因及分子机制尚处于研究阶段。进一步开展椎间盘退变的分子机制及信号转导通路研究对于精准调节椎间盘退变的疾病进程,并最终指导椎间盘疾病的临床治疗具有十分重要的意义。

