锌指蛋白转录因子Di19参与调控大豆干旱响应的研究进展
张古文,沈 立,郑华章,刘 娜,冯志娟,龚亚明,*
(1.浙江省农业科学院 蔬菜研究所,浙江 杭州310021; 2.浙江勿忘农种业股份有限公司,浙江 杭州310020; 3.余姚市农业技术推广服务总站,浙江 余姚315400)
从古至今,干旱始终是人类面临的最主要自然灾害。全世界干旱、半干旱地区约占陆地总面积的34.9%,40%以上的耕地受到干旱影响[1]。据统计,我国旱地面积占总耕地面积的70%以上,干旱、半干旱地区耕地占总耕地面积的43%以上[2]。近年来,全球气候异常趋于常态化,高温、干旱、极寒和洪涝等极端天气时有发生,其中,干旱对粮食生产的威胁最为严重,每年因干旱而造成的损失几乎等于其他所有环境因子的总和,因此干旱已成为影响粮食生产的最主要障碍因素[3]。大豆在豆类作物中对干旱最为敏感,其根系不发达,需水量多,在主产区的东北、黄淮以及南方地区,大豆生产经常会遭遇夏季干旱以及春夏连续干旱等季节性干旱的威胁,水分亏缺已成为制约大豆产量提高和品质提升的最重要环境因子[4-5]。锌指蛋白是含有锌指结构的一类蛋白质,锌指是由一个含有大约30个氨基酸的环和一个与环上的4个半胱氨酸(Cys)或2个Cys和2个组氨酸(His)配位的Zn2+构成,形成的结构像手指状。锌指蛋白是植物中发现的种类最多、调控作用最显著的一类转录因子,在植物干旱响应中发挥重要作用。Di19(Drought induce 19)是一种受干旱诱导的小分子锌指蛋白,最早于2006年在拟南芥中发现,之后的研究表明,它在高等植物中广泛存在,并在植物的抗逆响应中起积极作用[6-9]。本文针对大豆耐旱性机理、锌指蛋白以及其家族成员Di19,对国内外的研究现状进行了综述,对未来大豆耐旱性研究具有指导意义与参考价值。
1 大豆耐旱性研究进展
1.1 大豆耐旱性相关的形态学与生理生化研究
国际上大豆耐旱性研究开始于20世纪70年代,我国大豆耐旱性研究始于20世纪90年代。最初的研究集中于干旱对大豆植株形态结构的影响,包括根、茎、叶、植株、豆荚等。干旱胁迫下,大豆植株根系伸长受阻、叶片萎蔫、生长缓慢、单株荚数下降、籽粒变小、产量降低,但与干旱敏感型品种相比,抗旱性强的品种发根早、主根长、侧根发达且数量多、根毛密度和总长数值大,产量下降幅度小[10-12]。之后,研究集中于生理生化指标的变化。Zhang等[13]研究了干旱胁迫对耐旱性不同的两个大豆品种叶片保护酶活性的影响;Sakamoto等[14]研究了干旱、低温以及盐胁迫对大豆根系保护酶活性的影响;王启明等[15]研究了干旱胁迫对不同大豆品种苗期叶片渗透调节物质含量和细胞膜透性的影响。三者的研究结果一致表明,渗透调节物质(包括游离脯氨酸、游离氨基酸、可溶性糖、甜菜碱等有机溶质与K+、Ca2+等无机离子)的积累,保护酶活性的提高,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等,对提高大豆的耐旱性均具有积极意义。前期研究结果表明,大豆对水分的需求有阶段性差异,苗期需水量最少,开花期急剧上升,结荚期需求量最大,鼓粒期呈降低趋势;遗传学方面,抗旱性是由多基因控制的数量遗传性状,涉及到植株性状的许多方面,实际的育种工作中,对大批后代材料进行生理生化指标检测和形态学鉴定是不现实的。因此,利用分子生物学技术进行抗旱机理研究和抗旱性改良是大豆抗旱育种的必由之路[16-17]。
1.2 大豆耐旱性相关的遗传学研究
近年来,迅速发展的分子遗传学为大豆抗旱性的遗传研究提供了有力的工具,尤其是数量性状基因(QTL)作图法在基因克隆与定位、比较基因组和育种改良等方面的广泛应用,极大地促进了大豆抗旱性的遗传研究。1996年和1998年,Mian等[18-19]先后利用2个作图群体,分别发现4个和6个独立的RFLP标记与水分利用效率相关的QTL连锁,能解释各自性状表型变异的38.0%和53.0%,开启了大豆抗旱性遗传研究的序幕。刘莹[20]利用科丰1号×南农11382-2的衍生RIL群体,检测到13个控制比根重、比总根长、比根体积的QTL位点,并将其分别定位于N6-C2、N8-D1b+W、N11-E和N18-K连锁群上。Du等[21]同样利用科丰1号×南农11382-2的衍生群体对大豆叶片上部和背部腺毛密度QTL进行了定位,共获得15个与叶片水分利用率相关的QTL,有6个位点可以同时用复合区间作图法和多重区间作图法检测到,其中qtuH-2位点的贡献率在两种作图法中分别达31.81%和29.4%,暗示其可能为抗旱性主效位点。李灿东等[22]以红丰11为轮回亲本、Clark为供体亲本构建回交群体进行耐旱性QTL位点筛选,结果表明,利用等位基因卡方测验方法可检测到23个SSR偏分离位点,分别与叶片持水能力、根长、根干质量、产量、生物量具有一致性,结合耐旱性QTL定位,共检测到33个QTL,其中有17个位点可被两种方法同时检测到,如位于E连锁群的Sat_136位点、位于K连锁群的Satt398位点等,这些位点可能是控制大豆耐旱性的重要位点。Abdel-Haleem等[23]利用PI416937×Benning群体对控制叶片萎蔫等级的位点进行了定位,共定位到7个QTL,其中5个来自耐旱亲本PI416937,2个来自不耐旱亲本Benning。邢光南等[24]利用两个重组自交系对影响大豆叶面茸毛密度的QTL进行了分析,结果检测到2个叶面茸毛密度主效QTL与耐旱性显著相关,贡献率分别达到20.7%和21.7%,且两个群体叶片茸毛密度遗传构成中加性QTL贡献率占20.7%~36.2%,表明大豆叶片绒毛密度的遗传涉及多个效应不同的基因。但到目前为止,大豆耐旱性的遗传依旧是一个相对薄弱的研究领域,仍停留在QTL初定位层面,尚无进一步的功能基因挖掘以及基因功能验证方面的报道[25]。
1.3 大豆耐旱性相关的基因组学研究
近年来,随着人们对植物耐旱机理了解的日益深入,大豆耐旱相关基因组学研究的进展也十分迅速,美国、巴西、阿根廷等先进生产国的转基因技术应用日渐成熟和深入,我国也加快了研究步伐。2010年,张大勇等[26]首次从大豆中鉴定出50个水通道蛋白,并发现液泡膜水通道蛋白对干旱胁迫响应敏感,编码的蛋白与锌指蛋白存在互作,参与耐旱性调控。随后,Faria等[27]发现大豆转录因子GmNAC6基因参与内质网胁迫和渗透压胁迫诱导的细胞凋亡过程。Le等[28]利用基因芯片分析的方法,研究了干旱胁迫下大豆盛花期(R2)和鲜荚采摘期(V6)叶片的转录组变化,结果表明,在V6和R2期,分别有612个上调基因和463个下调基因同时被检测到,大多数上调基因编码调节蛋白,如DREB、NAC等转录因子,还有部分基因编码功能蛋白,如胚胎发育晚期丰富蛋白、糖基转移酶等;进一步的分析表明,大部分GmNAC转录因子家族和激素相关基因在干旱胁迫后表达下调,大部分与光合相关基因也在干旱胁迫后下调。Vidal等[29]构建了干旱胁迫下两个抗旱性差异显著大豆品种的抑制性差减文库,并对其上调基因的单核苷酸多态性进行了分析,结果表明,在超过6 000个SNP位点中,有165个位于大豆染色体末端,主要涉及MYB、WRKY等转录因子。Xu等[30]对干旱胁迫下大豆Hsp90蛋白的功能进行了研究,结果从大豆中分离了12个GmHsp90基因,实时定量PCR结果表明,高温、干旱、盐胁迫条件下,所有家族成员的表达量均上调,5个家族成员(GmHsp90A2、GmHsp90A4、GmHsp90B1、GmHsp90C1.1、GmHsp90C2.1)的转基因拟南芥植株的胁迫抗性提高,同时部分转基因植株的脯氨酸含量显著升高,一定程度上表明胁迫抗性的提高与脯氨酸含量的升高有关。Luo等[31]采用微阵列的方法从野生大豆中鉴定出一个胁迫响应转录因子GsWRKY20,实时荧光定量PCR结果表明,其基因表达受脱落酸、盐胁迫、低温胁迫以及干旱胁迫诱导,转基因研究结果表明,转基因拟南芥在种子发芽期以及幼苗生育早期,GsWRKY20基因表达量显著升高,同时转基因植株对脱落酸的敏感性显著降低,表明GsWRKY20基因在拟南芥抗逆性方面发挥积极作用。秦迪等[32]将甜菜碱醛脱氢酶(BADH)基因转入大豆,结果表明,干旱胁迫下转基因植株的发芽指数提高了2.5%~16%,活力指数提高了0.5%~0.6%,脯氨酸含量增加了9.9%~16.5%,POD活性升高了1.2%~10.5%,丙二醛含量减少了0.4%~12%,转基因植株的耐旱性显著提高,BADH基因在大豆耐旱性方面发挥积极作用。目前,国内外大豆转基因技术应用成熟的方向主要集中在抗除草剂和抗虫两个性状,抗旱性研究相对滞后,具有实用价值的分子标记少,如何通过生物工程手段快速有效提高大豆的抗旱性是目前急需解决的关键问题。
2 锌指蛋白转录因子在植物抗逆性中的作用研究进展
转录因子在特定时间与特定基因启动子相结合,启动或调控基因表达,进而在植物生长发育及对逆境的应答响应中起调控作用。自从1987年人们首次从玉米中发现转录因子以来,目前已经分离到了六十多个受干旱诱导的植物转录因子[33-35]。根据结合域的不同,主要分为锌指蛋白家族、bZIP家族、AP2/EREBP家族、WRKY家族、MYB/MYC家族和NAC家族等,其中锌指蛋白是种类最多、调控作用最显著的一类[36-37]。
2.1 锌指蛋白转录因子与植物抗逆性
锌指蛋白家族成员众多,根据结构的差异,主要分为两大类:一类为2个Cys、2个His和1个Zn2+相结合的C2H2型,这类锌指最初发现于TFⅢA因子中,又称为TFⅢA类型锌指或经典锌指;另一类为4个Cys结合1个Zn2+的C2C2型,该类锌指多为类固醇受体如:雌激素受体、糖皮质激素受体等[38]。其中,C2H2型锌指蛋白调控作用最为显著,也是目前研究最多的一类,它们一般由28~30个氨基酸构成,其基本序列为:C-X2-4-C-X3-P-X5-L-X2-H-X3-5-H (其中C为半胱氨酸,X为任意氨基酸,P为苯丙氨酸,L为亮氨酸,H为组氨酸),相邻的锌指模体间的序列一般为保守的CH连接肽 (H/Clink),其空间及基序结构如图1和图2所示[37]。
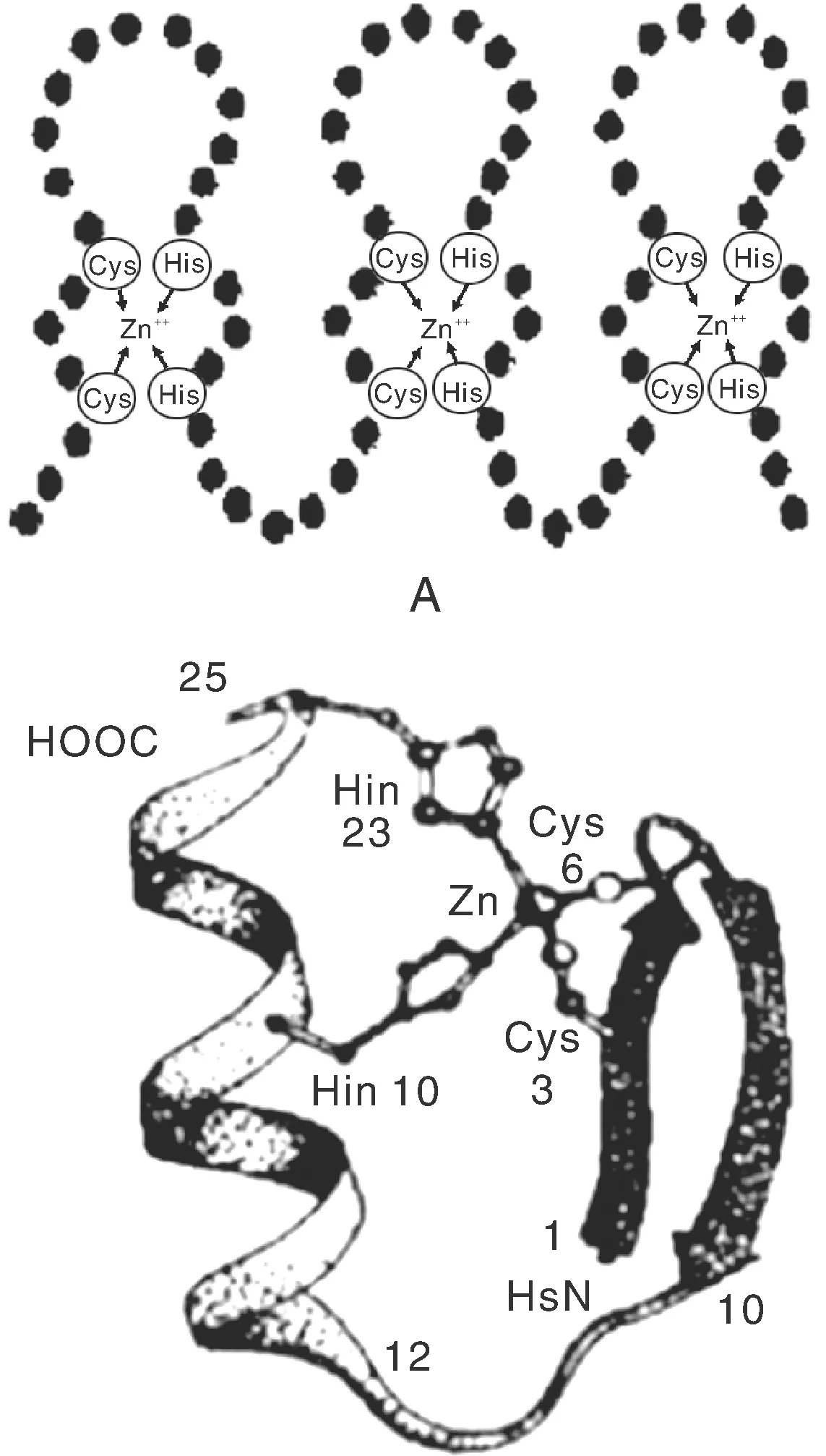
图1 植物C2H2型锌指蛋白空间结构[37]Fig.1 The spatial structure of plant C2H2 type zinc finger protein[37]
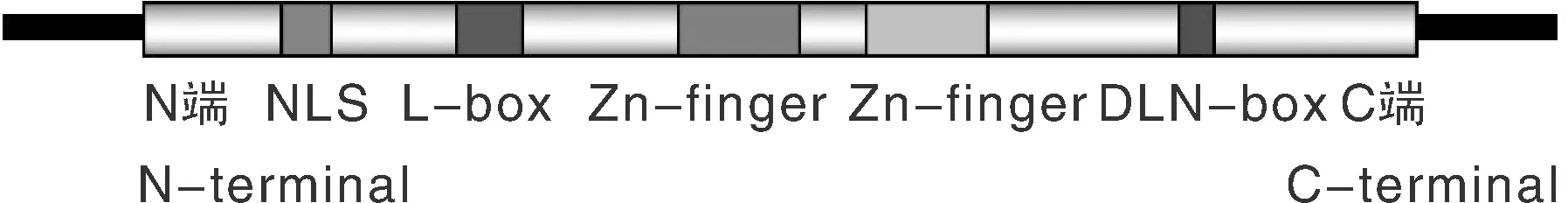
图2 植物C2H2型锌指蛋白基序结构[37]Fig.2 The motif structure of plant C2H2 type zinc finger protein[37]
目前,植物C2H2型锌指蛋白的研究主要集中在拟南芥、矮牵牛、水稻等模式植物中,发现了众多与植物非生物胁迫有关的家族基因。如拟南芥中发现的STZ基因,编码一种双锌指结构的C2H2型锌指蛋白,该基因在烟草中的过量表达显著提高了转基因植株对低温及高盐胁迫的耐受能力;另外,STZ基因还可以作为转录抑制因子增强烟草植株对干旱的耐受性[14]。同样,在矮牵牛中发现的ZPT2-3基因,其编码的蛋白也含有双锌指结构,转基因烟草对干旱的耐受能力也显著提高[39]。另外,水稻中的C2H2型锌指蛋白基因OsDST可以负调控气孔关闭,其缺失突变体也可以增强水稻对干旱胁迫的抗性[40]。
2.2 锌指蛋白转录因子与大豆抗逆性
目前,国内外有关大豆抗逆锌指蛋白的研究还不多,少量的报道也主要集中于低温响应方面。2001年,Kim等[41]首次从大豆中分离到一个受低温诱导的锌指蛋白基因SCOF-1,该基因的表达受低温和ABA特异性诱导,转基因研究证实其过表达可以增强拟南芥和烟草对低温的耐受性。刘萌萌[42]克隆了一个大豆C2H2型锌指蛋白基因GmC2H2,该基因受低温、ABA胁迫诱导,转拟南芥研究表明,转基因植株的对低温的耐受性显著高于对照。白晶等[43]从野生大豆中克隆得到了一个C2H2型锌指蛋白基因GjC2H2-1,结构分析表明该基因具有B-box、L-box、和DLN-box结构域,推测其与2001年Kim等分离的是同一个基因。吴学闯等[44]从大豆干旱处理的cDNA文库中克隆出一个C3HC4型锌指蛋白基因GmRZFP1,该基因受低温、干旱、高盐和ABA等胁迫诱导表达,涉及多种信号传导途径。单曙光等[45]从大豆中克隆得到一个锌指蛋白基因GmC2H2,转入拟南芥后发现,转基因植株耐寒性显著提高。韩丹等[46]从大豆中克隆出一个含有两个锌指蛋白结构域的C2H2型锌指蛋白基因,转入受体‘吉农28’中,转基因植株的耐低温能力显著提高。到目前为止,关于大豆锌指蛋白的研究主要涉及低温抗性方面,随着研究的不断深入,有关其与耐旱性的关系也应当受到重视,为大豆耐旱性改良提供理论基础。
3 Di19家族基因研究进展
Di19是最新发现的一类小分子锌指蛋白,受干旱和高盐诱导,从低等的藻类到高等植物均有发现。它们编码一种小分子锌指蛋白,蛋白序列含有两个C2H2型结构域,属于ZZ型锌指蛋白[47]。这种锌指结构域能够结合RNA,参与蛋白与蛋白间的互相作用或蛋白与DNA间的识别,从而在植物的抗逆响应中起积极作用[48-49]。
3.1 Di19家族基因的分类与功能
目前,Di19家族基因研究最深入的模式植物是拟南芥。研究表明,拟南芥中含有7个Di19同源基因,分别命名为AtDi19-1~AtDi19-7。7个家族成员中,除了Di19-2和Di19-4定位于细胞质以外,其余5个均定位在细胞核[6]。这7个家族成员均能够受各种胁迫诱导,在拟南芥各种组织中广泛表达,在其抗逆响应中发挥多种作用。其中,AtDi19-1和AtDi19-3受干旱胁迫后迅速表达,AtDi19-2和AtDi19-4在盐胁迫下表达量显著增加。7个家族成员中,Di19-1的表达量最高,其T-DNA插入突变体对干旱胁迫敏感,而过表达植株则对干旱具有更高的抗性。经过鉴定,Di19-1主要作为转录因子起作用,它能够结合PR1、PR2和PR5启动子区的TACA(A/G)T元件并激活它们的表达,且这种激活的作用能够被CPKH(一种结合Ca2+的蛋白激酶)所增强[8]。蛋白互作结果表明,Di19-1能够与CPKH激酶互作于细胞核,并能够在体外通过Ca2+依赖的方式被CPK11和CPK3磷酸化[6]。目前,7个家族成员中,有5个己经证明能与CPKH相互作用并被后者磷酸化,磷酸化的位点处于Dilg蛋白的NLS位点附近。同时,Di19-1能够与F-box蛋白AtLKPZ(一种参与泛素介导的蛋白质降解途径的蛋白质)相互作用,但作用的位点尚不明确[50]。相反,有研究表明,Di19-3可能在干旱胁迫中起相反作用,在拟南芥中过表达AtDi19-3增加了植株对渗透胁迫的敏感性,转基因植株脯氨酸的积累少,抗性低;而AtDi19-7则是参与红光和蓝光的信号传导[9,47]。
3.2 Di19家族基因的作用机理
Di19家族基因作用机理方面,目前的研究仅限于与激素的互作层面。最初的研究表明[51],拟南芥Di19家族基因的表达似乎不受激素的影响。但随着研究的深入,2006年,Kariola等[52]发现,拟南芥Di19基因对ABA途径有转录水平的响应。ABI1、RAB18、ERD15以及ABF3等ABA信号调节组分都能在转录水平上被Di19基因诱导,添加外源ABA条件下,上述基因在转基因植株中的表达均比对照强,证明Di19基因可能是ABA信号途径的正向调控因子。棉花中的研究表明,棉花Di19基因GhDi19-1和GhDi19-2转入拟南芥后,转基因植株表现出对盐和ABA的超敏感性;转基因种子的萌发和幼苗的发育均受高盐和ABA抑制,表明该基因可能负向调控ABA信号通路[53]。另外一项研究表明,小麦TaDi19基因转入拟南芥后,转基因植株对盐、ABA和甘露醇的敏感性增强,尤其是根系伸长对盐胁迫的敏感性增强;另外,转基因植株ABA信号通路的ABI1、RAB18、ERDI5和ABF3的表达受到抑制,表明该基因有可能负向调控ABA信号通路[54]。目前,有关Di19家族基因表达与ABA信号途径的互作模式仍尚不明确,需要进一步开展深入研究。
3.3 Di19家族基因的功能
目前,有关Di19家族基因的功能研究主要集中于其对逆境胁迫的响应方面,除了拟南芥等模式作物,其他作物中也有了少量的研究。2009年,李朔[54]首次从小麦中分离了一个TaDi19基因,通过研究发现,其包含C2H2类锌指结构域、“DPLLSF”位点和“FVQDLVL”位点等保守位点,对ABA、PEG、NaCI、Ethophon、6-BA都有响应,可以影响ABA途径上的多种调控元件;另外,小麦TaDi19基因还受低温胁迫诱导,推测小麦Di19基因实际是受缺水诱导,低温胁迫造成的缺水比直接的渗透胁迫来得晚,因此响应得也晚,同样,低温胁迫下叶片中的诱导程度大于根中,也是因为叶片中缺水的程度相比于根中更大些。随后,茹京娜等[55]通过对低温处理的小麦转录组测序,获得一个锌指类转录因子TaDi19A,分析结果表明,该转录因子编码区全长747 bp,含有4个外显子,3个内含子,蛋白靠近N-段包含锌指结构域,C端为Di19结构域,三级结构包含2个α螺旋,具体结构见图3。功能分析表明,TaDi19A基因表达受低温胁迫诱导表达,转入拟南芥后,低温处理下,转基因植株的耐冷性强于野生型拟南芥,基因检测结果表明,低温处理后,CBL1、CBL2 和KIN1 等冷胁迫响应相关基因在转基因植株中的表达量显著高于野生型,表明TaDi19A可能通过调节下游冷胁迫响应相关基因的表达来提高转基因植物的耐冷性。赵娟莹等[56]从大豆中分离了一个Di19家族基因成员GmDi19-5,并研究了其对高温胁迫的响应机制,结果表明,GmDi19-5含有多种与胁迫应答相关的顺式作用元件,在高温胁迫下表达水平显著升高;在大豆地上部和地下部均有分布,其同源基因定位于拟南芥原生质体细胞核中,并且与受高温胁迫诱导的DNA J蛋白互作。张敏[57]从玉米中克隆了一个Di19家族基因成员ZmDi19-5,并对其抗逆功能进行了鉴定,结果表明,ZmDi19-5基因在高盐和高浓度PEG胁迫后上调表达;其在玉米各组织中均有分布,但在茎秆中的表达量最高;定位在细胞膜上,不具有转录激活活性;转化拟南芥后,转基因植株的抗旱耐盐能力显著增强。张新宇等[58]从棉花中克隆了一个C2H2型锌指蛋白基因GhSIZ1,该基因受低温、高盐和干旱胁迫诱导,在棉花各组织中均有表达,但根系表达量最高,亚细胞定位表明其定位在细胞核中,推测其可能是Di19家族成员之一。目前,有关大豆Di19家族基因的研究仅有赵娟莹等[56]的一篇报道,迫切需要进一步深入开展。
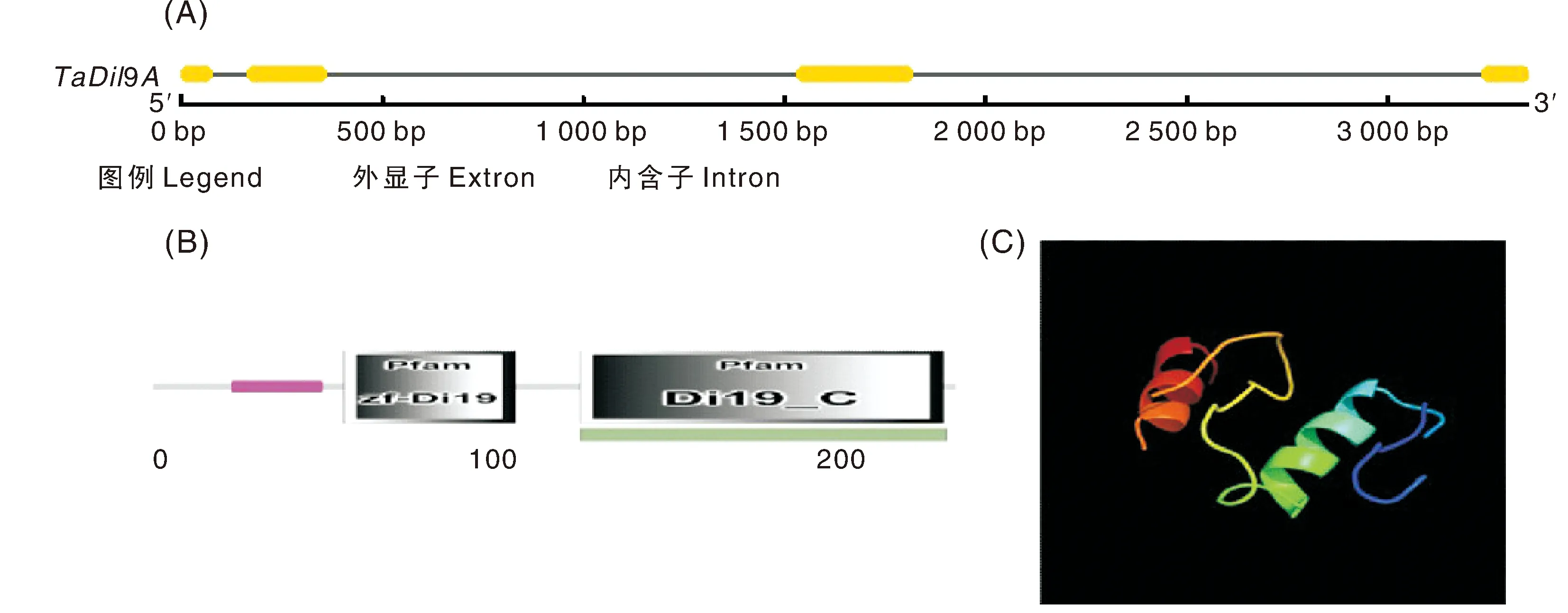
A, TaDi19A基因结构; B,TaDi19A蛋白保守结构; C,TaDi19A蛋白三级结构。A, Gene structure of TaDi19A; B, Conserved domains of TaDi19A protein; C, Tertiary structure of TaDi19A protein.图3 小麦TaDi19A的基因结构和蛋白结构[55]Fig.3 Gene structure, protein structure of wheat TaDi19A gene[55]
4 展望
目前,相对于水稻、玉米等作物,大豆的基因组学研究相对落后,这主要是因为其基因组构成过于复杂[59]。大豆祖先经历了基因组丢失、多倍化、二倍化等一系列复杂的事件才形成了目前的基因组,复制区域和重复序列多、染色体小、遗传变异程度低,使得大豆分子生物学研究相对困难、进展缓慢。今后,需要进一步加强大豆分子生物学研究,深入挖掘Di19基因家族在大豆干旱响应中的功能,从分子水平阐明其参与调控菜用大豆干旱响应的机制,为生产以及遗传上以Di19介导的耐旱途径作为改良靶标提供基因资源和理论依据。

