高效液相色谱法测定香瓜中甜蜜素的残留量
王东旭,郑龙华,徐雅倩,于曼璐,黄 哲,史晓丽,张晓燕,*
1.通化师范学院 (通化 134002)
2.通化海关 (通化 134001)
甜蜜素,其化学名称为环己基氨基磺酸钠,溶于水,是一种人工合成的食品甜味剂,可用于食品生产中[1-]。甜蜜素的甜度是蔗糖的30~40倍[2],由于其价格较低,一些瓜农为改善香瓜口感,提高商品价值,在香瓜种植过程中喷施甜蜜素[3-5]。甜蜜素使用的安全性在国际上一直都存在争议[6]。阿德莱德大学肠胃神经研究实验室高级博士后研究员兼研究报告合著者之一理查德·杨表示,到目前为止的研究显示,甜蜜素等人工增甜剂短期内对人体的影响似乎有限,不过对于糖尿病患者和代谢能力较弱的小孩、孕妇和老人等特殊人群有一定的影响[7-8]。甜蜜素主要影响人体的肝脏和神经系统这些敏感部位,因此很多发达国家,例如美国、日本、加拿大等,都明令禁止食品生产商在食品中添加甜蜜素,从根本上阻止甜蜜素流入市场,对人体产生危害[9]。我国只是对一些加工食品在使用范围上进行了控制,对于香瓜这种即食食品并不在使用范围内,由于监管存在漏洞,许多瓜农又缺乏正确使用甜蜜素的知识,因此瓜农在种植过程中不规范喷施甜蜜素的现象比较严重,导致香瓜中甜蜜素过量残留[10]。香瓜作为人们茶余饭后的一种美食,被大部分人喜爱[11]。如果残留甜蜜素的香瓜在市场上大量销售,可能直接危害到特殊人群的健康,因此制定相关标准,对香瓜中甜蜜素残留进行监管十分必要。
目前我国检测甜蜜素的方法有柱前衍生-液相色谱法、气相色谱法、液相色谱与蒸发光散射检测器联用法、液质联用法、离子色谱法、分光光度法、高效液相色谱法等多种检测方法。李欣,李帮锐,丁力[12]等选用固相萃取-气相色谱法测定白酒中甜蜜素的残留量;肖晶[13]等选用高效液相色谱-质谱法测定酒中甜蜜素的残留量。但是对于香瓜中甜蜜素残留量的研究并不多见。本课题利用甜蜜素在酸性条件下与亚硝酸钠反应,生成环己醇亚硝酸酯的特性,采用高效液相色谱法对香瓜中是否残留甜蜜素进行定性检测,并根据标准曲线进行残留量的定量测定。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 材料和试剂
香瓜,购于通化市明达超市;甲醇,色谱纯,Thermo Fisher Scientific;硫酸,分析纯,天津市致远化学试剂有限公司;正己烷,分析纯,天津市致远化学试剂有限公司;亚硝酸钠,分析纯,天津市致远化学试剂有限公司;氯化钠,分析纯,天津市致远化学试剂有限公司;甜蜜素标准品,250 mg,中国食品药品检定研究院,纯度99.0%,产品编号C11830800,Lot:30426。
1.1.2 仪器
FA1104电子天平,感量0.1 mg,上海恒平有限公司;BT125D 电子天平,感量0.01 mg,上海中庸检验设备有限公司;DHG-9101-3S 型电热恒温鼓风干燥箱,上海三发科学仪器有限公司;LC-20A 高效液相色谱仪,日本岛津有限公司,紫外检测器;KQ2200E型超声波清洗器,昆山市超声仪器有限公司;BDC-218UN 冰箱,海信电器。
1.2 方法
1.2.1 样品溶液的制备
将香瓜去皮去瓤,切碎后放入研钵中研磨成均匀糊状,准确称量5 g(精确至0.001 g)样品于150 mL锥形瓶中,加70 mL 纯化水,超声1 h,冷却至室温,将样品全部转移置100 mL 容量瓶中并用纯化水稀释定容,摇匀,将样品过滤到锥形瓶中,弃去初滤液。精密吸取续滤液20 mL 置于分液漏斗中,将分液漏斗置于冰浴中,加入5 mL 硫酸溶液(100 g/L)和5 mL 亚硝酸钠溶液(50 g/L),摇匀后,在冰浴中放置30 min,并且经常摇动进行衍生化。然后精密加入10 mL 正己烷和5 g氯化钠,混匀后振摇1 min,等气泡消失后,取上清液,用0.45μm的滤膜过滤,作为样品溶液,待测。
1.2.2 标准品溶液的制备
准确称取50 mg 甜蜜素标准品(精确至0.001 g),置于10 mL 容量瓶中,加适量纯化水溶解,然后用纯化水定容至刻度,配制成5.0 mg/mL的甜蜜素标准品溶液。精密量取适量甜蜜素标准品溶液稀释10倍,将稀释10倍后的甜蜜素标准品溶液按1.2.1处理,作为甜蜜素标准品溶液,现用现配。
1.3 色谱条件的选择
1.3.1 流动相的选择
根据查阅参考文献内容,本实验分别设置甲醇∶水(V∶V=70∶30)、甲醇∶水(V∶V=75∶25)和甲醇∶水(V∶V=80∶20)三个比例的流动相进行样品测定,结果分离度和色谱峰形都比较好,基本能有效的排除干扰峰的影响,但是,甲醇∶水(V∶V=80∶20)这个比例的流动相出峰时间最快,所以选用甲醇∶水(V∶V=80∶20)做为流动相。
1.3.2 检测波长的选择
利用紫外分光光度计对衍生反应生成的环己醇亚硝酸酯在200~700 nm 范围内进行波长扫描,在210 nm 和314 nm 处都出现了比较明显的色谱峰,但210 nm 周围产生的杂峰多,分离度较差。在314 nm 处出现的干扰峰较少,基线相对稳定,所以采用314 nm 作为甜蜜素的检测波长。
1.3.3 流速的选择
分别选择0.800 mL/min、1.000 mL/min、1.200 mL/min作为检测时的流速,经检测,流速为0.800 mL/min时,甜蜜素的保留时间较好,并能得到较好的分离,故选用0.800 mL/min作为样品检测的流速。
2 结果与讨论
2.1 定性分析
分别精密吸取甜蜜素标准溶液和样品溶液各10μL注入液相色谱仪,根据甜蜜素标准溶液和样品溶液峰保留时间做定性分析,结果如图1。
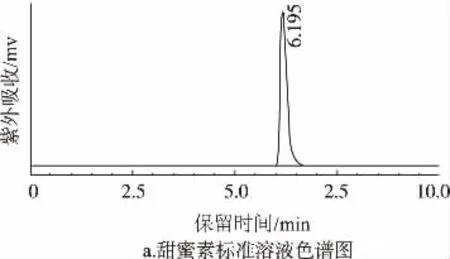
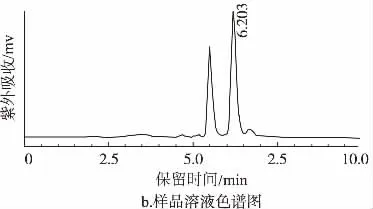
图1 甜蜜素标准品与样品的色谱图
由图1可知,甜蜜素标准品在6.195 min处出现明显的色谱峰,样品在6.203 min处出现明显的色谱峰,根据色谱峰保留时间可以判定此样品中检出甜蜜素残留。
2.2 精密度试验
精密吸取样品溶液10μL 注入色谱仪,进行检测,并且平行进样六次分别检测,得到6组峰面积数据,结果如表1。
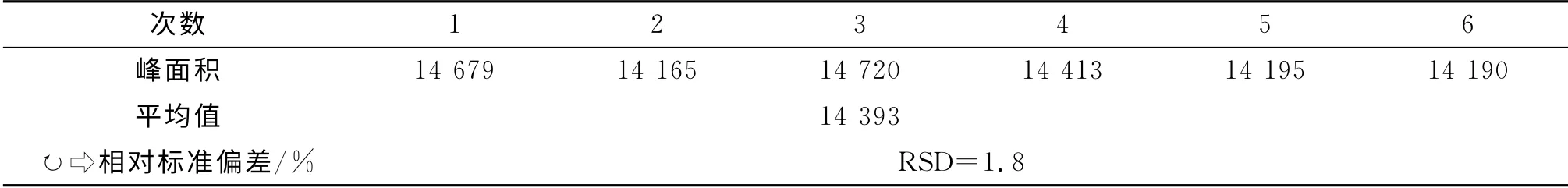
由表1可知,6次进样相对平均标准偏差RSD=1.8%,结果表明本试验方法的精密度较好。
2.3 标准曲线的绘制
将标准品溶液以不同体积梯度2μL、4μL、8μL、16μL、64μL进样分析,以峰面积作为纵坐标y,进样体积为横坐标x,绘制标准曲线,结果如图2。
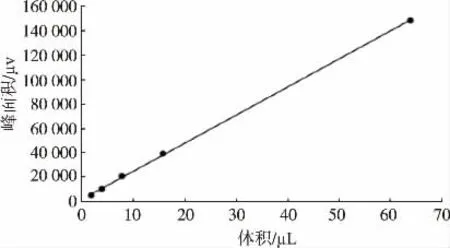
图2 甜蜜素标准曲线图
由图2 可知,获得标准曲线回归方程为y=2 358.9x+1 454.5,相关系数为R2=0.999 8,甜蜜素在2~64μg范围内呈良好的线性关系。
2.4 稳定性试验
将刚提取的样品溶液分别于0h、2 h、4 h、6 h、8 h、10 h、12 h、14 h进行测定,结果如图3。
由图3可知,样品溶液在0~14 h时内,峰形未发生明显变化,紫外吸收在逐渐减小,计算各时间段色谱峰面积相对标准偏差RSD=1.8%,说明主成分相对稳定,其稳定性能够满足测定的要求。
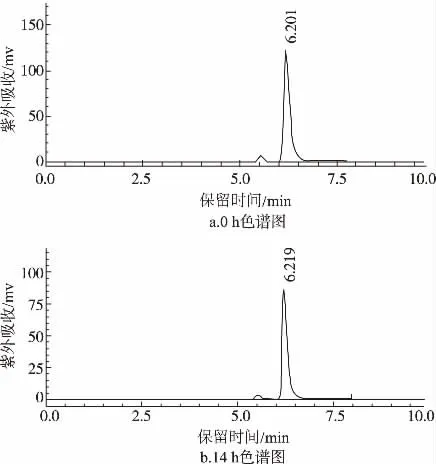
图3 样品稳定性色谱图
2.5 样品中甜蜜素残留量测定
精密吸取样品溶液10μL注入液相色谱仪进行检测,将检测结果代入标准曲线回归方程,计算得出,样品中甜蜜素的残留量为5.48 mg/kg。
2.6 回收试验
将样品分别精密秤取5 g放入1号、2号、3号锥形瓶,再使用微量移液器分别将标准品按照相当于200μg、300μg、400μg的量加入1号、2号、3号瓶中,按照1.2.1方法进行处理。将加标样品溶液进行检测,并带入标准曲线回归方程进行计算,结果如表2。
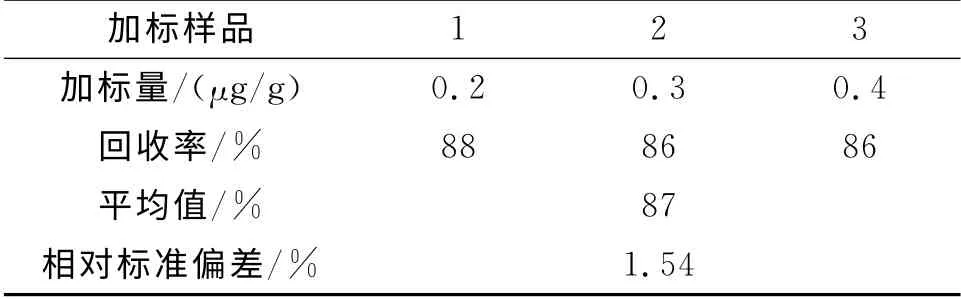
加标样品1 2 3加标量/(μg/g) 0.2 0.3 0.4回收率/% 88 86 86平均值/% 87相对标准偏差/% 1.54
由表2可知,测得回收率分别为1号88%,2号86%,3号86%,平均回收率为87%,相对标准偏差RSD=1.54%。其数值介于我国国家标准GB/T 27404—2008实验室质量控制规范食品理化检测规定的回收率(80%~110%)之间,由此得出本试验方法符合回收率要求,方法可靠。
2.7 检出限测定
将标准品溶液分别稀释制成0.05μg/mL、0.1μg/mL、0.2μg/mL浓度的溶液,精密吸取上述溶液,分别进样进行测定,信噪比达到3时,浓度为0.1μg/mL,基线平稳,因此判定甜蜜素的定量检出限为0.1μg/mL。
3 结论
本课题利用甜蜜素在酸性条件下与亚硝酸钠反应,生成环己醇亚硝酸酯的特性,建立高效液相色谱法进行检测。选用岛津ODSInertsil-C184.6×250 mm色谱柱,柱温30℃,甲醇:水(V∶V=80∶20)作为流动相,检测波长为314 nm,流速0.80 mL/min的条件下测定香瓜中甜蜜素残留量。根据实验定性分析可以确定本课题研究所用香瓜中残留甜蜜素,通过实验得出精密度的相对标准偏差RSD=1.8%,获得标准曲线y=2 358.9x+1 454.5,其相关系数R2=0.999 8,在2~64μg范围内呈良好的线性关系;定量检出限为0.1μg/mL,检出限较低;甜蜜素的平均回收率为87%,达到国家标准关于食品理化检测回收率的规定。
综上所述,本课题建立高效液相色谱测定香瓜中甜蜜素残留量的方法精密度较高、灵敏性和重复性好,操作方法简单快捷。测得本课题研究所用样品中甜蜜素残留量为5.48 mg/kg,未查阅到国家对香瓜中甜蜜素残留量的要求,所以香瓜应属于不得添加甜蜜素的食品,判定为不符合要求。香瓜在东北地区水果消费中占比较大,尤其是在夏季。因此香瓜中甜蜜素的残留问题不容忽视,香瓜的食用安全问题值得相关部门重视。高效液相色谱法在水果中甜蜜素残留的检验中具有实际应用价值,希望能为日后相关人员研究甜蜜素的残留方面提供相应参考。

