头孢哌酮钠舒巴坦钠诱导对铜绿假单胞菌的耐药性影响
梁卓政?冯定云?吴文斌?朱家馨?张天托

【摘要】目的 探討体外高浓度头孢哌酮钠舒巴坦钠(SCF)诱导铜绿假单胞菌后耐药谱的变化。方法 收集4株SCF敏感的临床铜绿假单胞菌以及1株实验室标准株,经过体外3.2倍最低抑菌浓度(MIC)的SCF诱导50代后,得到耐药铜绿假单胞菌。采用微量肉汤稀释法测定SCF、美罗培南等12种抗菌药物对诱导耐药株的MIC,根据2017年临床与实验室标准化所(CLSI)M100-S29的药物敏感性标准对结果进行判定。利用实时定量PCR(RT-qPCR)对铜绿假单胞菌的耐药相关基因的表达进行检测。结果 经过3.2倍 MIC的SCF诱导50代后,铜绿假单胞菌对抗假单胞菌的β-内酰胺类或β-内酰胺酶抑制剂抗菌药物的MIC平均增加14.0倍,对抗假单胞菌的头孢菌素类抗菌药物MIC平均增加9.0~16.0倍,对美罗培南的MIC至少增加4.0倍,但是对亚胺培南的MIC影响很小,对单环-β-内酰胺类抗菌药物MIC平均增加6.0倍,对喹诺酮类和氨基糖苷类抗菌药物的MIC大多保持不变。RT-qPCR结果显示,SCF诱导后外排泵基因mexD表达升高,孔道蛋白OprD表达降低(P均< 0.05)。结论 SCF使用可引起敏感的铜绿假单胞菌耐药性改变,诱导成对多种β-内酰胺类抗菌药物耐药的铜绿假单胞菌,甚至耐碳青霉烯铜绿假单胞菌。外排泵mexD的升高和孔道蛋白OprD的降低是体外SCF诱导铜绿假单胞菌耐药的重要机制。临床使用SCF需要谨慎合理,以减少多重耐药铜绿假单胞菌的产生。
【关键词】铜绿假单胞菌;头孢哌酮钠舒巴坦钠;多重耐药;碳青霉烯
The effect of in vitro-selection by cefoperzone-sulbactam on antibiotics resistance of Pseudomonas aeruginosa Liang Zhuozheng, Feng Dingyun, Wu Wenbin, Zhu Jiaxin, Zhang Tiantuo. Department of Resp- iratory Medicine, the Third Affiliated Hospital, Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Zhang Tiantuo, E-mail: zhtituli@ 163. com
【Abstract】Objective To investigate the variations in the drug susceptibility of Pseudomonas aeruginosa (P. aeruginosa) isolates after the in vitro-selection with high-dose cefoperazone-sulbactam (SCF). Methods Four clinical isolates of SCF-sensitive P. aeruginosa and 1 standard laboratory isolate were collected. The drug-resistant P. aeruginosa isolates were obtained after 50 generations of SCF induction at a concentration of 3.2×MIC. The antimicrobial susceptibility of 12 antibiotics, such as SCF and meropenem, was determined by disk diffusion method, and the results were judged according to the Clinical and Laboratory Standards Institute (CLSI) M100-S29 guideline in 2017. The expression of resistance-related genes in P. aeruginosa was detected by real-time quantitative PCR (RT-qPCR). Results After 50 generations of SCF induction at a concentration of 3.2×MIC, the MIC of P. aeruginosa against anti-pseudomonal β-lactam+β-lactamase inhibitors was increased by 14 times on average. In addition, the MIC to anti-pseudomonal cephalosporins was elevated by 9.0-16.0 times on average. Moreover, the resistance rate to meropenem was increased by at least 4.0 times. However, the MIC to imipenem was not significantly affected. For monobactams, the MIC was increased by 6.0 times on average. The susceptibility to anti-pseudomonal fluoroquinolones and aminoglycoside remained largely unchanged. RT-qPCR showed that the expression of the efflux pump gene mexD was significantly up-regulated, whereas that of the outer membrane porin OprD was considerably down-regulated after SCF induction (both P < 0.05). Conclusions The use of SCF can cause changes in the drug resistance of P. aeruginosa, induce multi-β-lactam antibiotics-resistant and even carbapenem-resistant P. aeruginosa. The increase of efflux pump MexCD-OprJ and the decrease of outer membrane porin OprD are the mechanisms underlying the role of SCF in the selection of P. aeruginosa. In clinical practice, physicians should be cautious about the use of SCF to reduce the occurrence of multidrug-resistant P. aeruginosa.
【Key words】Pseudomonas aeruginosa;Cefoperazone-sulbactam;Multidrug resistance;
Carbapenem
由于抗菌药物的不合理使用,使得多重耐药菌的出现和传播逐渐增加,严重威胁着人们的生命健康[1]。耐药菌尤其是多重耐药菌引起的各种感染已经成为了一个重要的并且急需解决的公共卫生问题。2017年中国细菌耐药性监测显示,非发酵糖革兰阴性菌的分离率达24%,其中铜绿假单胞菌占36%[2]。广州某三甲医院的流行病学研究发现铜绿假单胞菌的检出率高达13%,仅次于鲍曼不动杆菌[3-4]。铜绿假单胞菌可引起各器官系统的急性感染,如肺部感染、血流感染等,还能长期定植在人体器官以及医疗器械表面,如皮肤伤口和尿管的定植,导致感染迁延不愈[5-6]。
头孢哌酮钠舒巴坦钠(SCF)是一种具有抗铜绿假单胞菌活性的三代头孢菌素,其对铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯杆菌和大肠杆菌等革兰阴性杆菌具有良好的抗菌活性。由于抗菌药物的使用增加,铜绿假单胞菌的耐药性正逐渐增加。根据2017年中国抗生素监测网络中心调查显示,铜绿假单胞菌对SCF、亚胺培南和美罗培南的耐药性分别为24.8%、31.5%和26.3%[7]。在过去几十年里,多重耐药铜绿假单胞菌(MDRPA)的检出率呈上升趋势,在大部分地区其分离率达15% ~ 30%[8]。然而,关于SCF的使用是否会引起铜绿假单胞菌的耐药谱增加,目前仍然缺乏实验性研究。因此,本研究旨在通过体外诱导的方法,探讨SCF是否会诱导MDRPA的产生并且初步探讨其耐药的机制。
材料与方法
一、临床菌株收集
从2018年9月至2018年12月中山大学附属第三医院呼吸内科收治的呼吸道感染患者下呼吸道分泌物中收集4株对SCF和美罗培南均敏感的铜绿假单胞菌株,该4株均为氧化酶反应阳性、革兰染色阴性和具有典型的铜绿假单胞菌形态学表现。将4株细菌分为4组(A ~ D组),分别标记为A1、B1、C1和D1。以美国菌种保藏中心(ATCC)27853作为实验标准株,分为S组,标记为S1。
二、体外诱导耐药
将已报道的体外诱导方案经过适当的改良后用于本研究细菌诱导[9]。用24孔板进行连续的抗菌药物诱导,细菌暴露于比最低抑菌浓度(MIC)更高的抗菌药物浓度中,每株诱导菌设置6个复孔,以最大化铜绿假单胞菌的生存率。3.2倍MIC(80%的4倍MIC)的SCF(头孢哌酮钠与舒巴坦鈉之比为2∶1)用于各菌株诱导。铜绿假单胞菌在同一浓度抗菌药物暴露下连续培养50代(约8 d)。
从每株菌的M-H平板中挑取6个单克隆株,接种在1.5 ml LB培养液中37 ℃培养。每份过夜培养的菌液置于10%脱脂牛奶中-80 ℃保存。每株20 μl的菌液转移到1.5 ml新鲜的含有3.2倍MIC SCF的LB液中,每24 h重复1次。一旦完成体外诱导,各菌株必须尽快保存于-80 ℃中。SCF诱导株标记为“s”。
三、药物敏感性检测
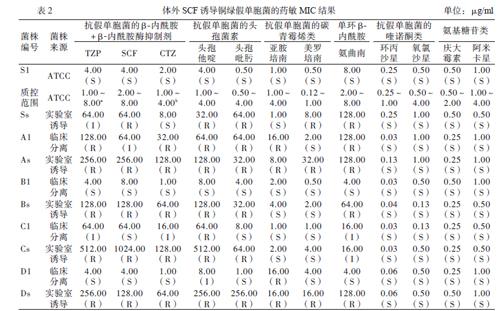
铜绿假单胞菌对常用抗菌药物的敏感性用微量肉汤法进行检测。常用抗菌药物包括哌拉西林钠他唑巴坦钠(TZP,哌拉西林钠与他唑巴坦钠之比为8∶1)、SCF(头孢哌酮与舒巴坦之比为2∶1)、头孢他啶他唑巴坦钠(CTZ,头孢他啶与他唑巴坦钠之比为3∶1)、头孢他啶、头孢吡肟、亚胺培南、美罗培南、氨曲南、环丙沙星、左氧氟沙星、庆大霉素、阿米卡星。采用2017年临床与实验室标准化所(CLSI)M100-S29指南作为评价铜绿假单胞菌的药物敏感性标准。CLSI M100-S29指南上的药物敏感性标准,对结果进行判读。实验室标准株ATCC27853用于抗生素质量控制,其对各种药物的MIC数值应在规定范围内。所有试验独立重复3次。
四、总RNA提取和实时定量PCR(RT-qPCR)
每种菌株挑取单克隆菌落,在M-H平板中于37 ℃培育16 ~ 20 h。将一圈细菌用焦碳酸二乙酯(DEPC)水悬浮,13 000×g 离心3 min,弃上清,在冰上加入2 mg溶菌酶溶液孵育15 min,然后置于37 ℃的水浴中孵育10 min。最终悬浮液用于进行总RNA分离。应用TaKaRa RNAiso Plus提取每种菌株的总RNA,然后使用TaKaRa PrimeScriptTM RT Reagent Kit with gDNA Eraser进行逆转录。使用TaKaRa TB GreenTM Premix Ex TaqTM Ⅱ进行qRT-PCR。 所有引物均由广州睿博兴科生物公司合成,用于检测mexB、mexD、mexF、mexY、OprD的表达,引物序列、产物长度和退火温度见表1。用管家基因rpoD标准化上述mRNA的表达水平。
五、统计学处理
使用GraphPad Prism 7.04进行统计学分析。所有实验均独立重复3次,并取平均值作图表示。采用几何均数对不同组的同一类抗菌药物的耐药差异倍数进行统计分析。耐药基因的表达变化采用表示。对不同基因表达中SCF诱导前和诱导后的菌株用两独立样本t检验。P < 0.05为差异有统计学意义。
结果
一、SCF诱导铜绿假单胞菌耐药谱的变化
体外高浓度SCF诱导50代后,铜绿假单胞菌耐药性发生明显改变。诱导后的铜绿假单胞菌对抗菌药物的MIC增加分别如下:①抗假单胞菌的β-内酰胺+β-内酰胺酶抑制剂类,TZP (2.0 ~ 64.0倍,平均14.0倍),SCF(4.0 ~ 32.0倍,平均14.0倍),CTZ(4.0 ~ 64.0倍,平均14.0倍);②抗假单胞菌的头孢菌素类,头孢他啶(2.0 ~ 32.0倍,平均9.0倍),头孢吡肟(0.5 ~ 256.0倍,平均16.0倍);③抗假单胞菌的碳青霉烯类,亚胺培南(0.5 ~ 2.0倍,平均1.0倍),美罗培南(4.0 ~ 16.0倍,平均5.0倍);④单环β-内酰胺类,氨曲南(1.0 ~ 32.0倍,平均6.0倍);⑤抗假单胞菌的喹诺酮类,环丙沙星(1.0 ~ 4.0倍,平均1.0倍),左氧氟沙星(0.5 ~ 4.0倍,平均1.0倍);⑥氨基糖苷类,庆大霉素(0.5 ~ 2.0倍,平均1.0倍),阿米卡星(0.5 ~ 1.0倍,平均0.7倍),见表2。ATCC27853对所有抗菌药物的敏感性均在质控范围内。
二、SCF诱导铜绿假单胞菌外排泵和孔道蛋白的表达水平变化
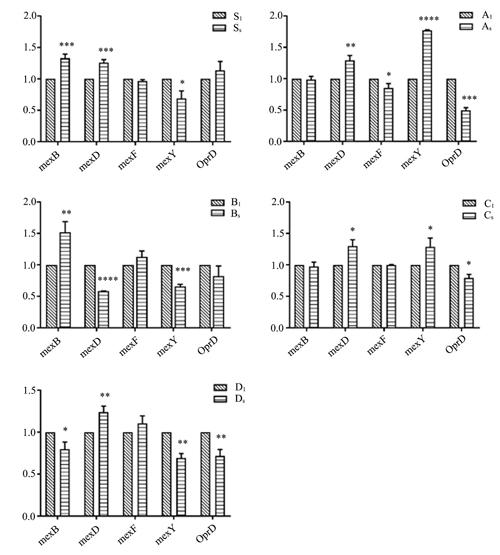
除B组外大部分SCF诱导株中mexD升高,除S组外大部分SCF诱导株中OprD降低,mexB和mexY也存在升高的趋势,5组中有2组mexB升高,2组mexY升高(P均< 0.05),但是mexF的表达没有升高趋势(P > 0.05),见图1。
讨论
SCF是β-内酰胺类+β-内酰胺酶抑制剂的复合抗菌药物,属于第三代头孢菌素,其抗菌机制主要是抑制细菌细胞壁的合成。作为第一代β-内酰胺酶抑制剂,舒巴坦钠灭活多种A类β-内酰胺酶,从而协同增强头孢哌酮钠的抗菌作用,但是对B类、C类以及D类β-内酰胺酶的水解作用比较差[10]。其对β-内酰胺酶的稳定性以及对铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯杆菌和大肠杆菌等革兰阴性杆菌有良好的抗菌活性,SCF可用于治疗革兰阴性杆菌引起的医院获得性肺炎、呼吸机相关肺炎、支气管扩张以及脓毒血症等,因而在临床上得到广泛使用。
由于SCF在治疗上过度使用,使得其耐药性逐渐增加。已有研究表明MDRPA的产生与临床抗铜绿假单胞菌抗菌药物的使用有关,主要包括喹诺酮类和碳青霉烯类抗菌药物[11-12]。Raman等[13]报道临床上使用喹诺酮类和碳青霉烯类抗菌药物可以分别增加3.34倍和12.68倍产生MDRPA的风险(与敏感的铜绿假单胞菌相比)。然而,SCF的使用是否与MDRPA的产生有关尚不明确。
本研究使用体外连续诱导方案评估在SCF诱导压力下铜绿假单胞菌所出现的进化突变。使用3.2倍MIC进行诱导可以降低细菌生长率至20%,同时保证细菌在高浓度抗菌药物暴露下仍可以继续生长,达到更好地模拟临床体内抗菌药物诱导耐药的目的。根据CLSI M100指南的质控标准,ATCC27853对SCF等12种抗菌药物的MIC均在指定范围之内,说明了后续的药物敏感性实验具有可靠性。结果显示,体外给予SCF可诱导出对多种β-内酰胺类抗菌药物高度耐药的铜绿假单胞菌,包括抗假单胞菌的β-内酰胺类+β-内酰胺酶抑制剂(哌拉西林/他唑巴坦、SCF、头孢他啶/他唑巴坦)、抗铜绿假单胞菌的头孢菌素(头孢他啶、头孢吡肟)、抗铜绿假单胞菌的碳青霉烯类(亚胺培南、美罗培南)以及单环β-内酰胺类(氨曲南)。其中对头孢吡肟的MIC平均增加倍数最高,可达16.0倍。对抗假单胞菌的β-内酰胺类或β-内酰胺酶抑制剂类抗菌药物的MIC平均增加14.0倍。按照文獻报道的细菌耐药分类标准,可认为SCF体外诱导可以产生MDRPA[14]。已有研究表明三代头孢菌素或者抗铜绿假单胞菌头孢菌素的使用与耐碳青霉烯铜绿假单胞菌的产生没有关系[15-18]。然而,本研究中SCF确实能诱导耐碳青霉烯铜绿假单胞菌。体外给予高浓度SCF可以升高铜绿假单胞菌对美罗培南的MIC至少4.0倍,而对于亚胺培南的MIC影响却不明显。本研究结果与此前的研究相符,即耐碳青霉烯铜绿假单胞菌的流行与临床使用头孢菌素和碳青霉烯类有关[19-20]。
不同外排泵对不同抗菌药物有不同的转运能力。本研究分析到外排泵mexD和孔道蛋白OprD在SCF诱导耐药中起重要作用。MexCD-OprJ主要转运喹诺酮类、大环内酯类、四环素、氯霉素、头孢菌素(除了头孢他啶)以及美罗培南等抗菌药物[21]。铜绿假单胞菌对碳青霉烯类抗菌药物的耐药性与MexAB-OprM和MexXY-OprM耐药关系最密切,其次是MexEF-OprN,与MexCD-OprJ关联性比较低[22]。已有研究表明孔道蛋白OprD的表达降低或者缺失可以增加铜绿假单胞菌对碳青霉烯类抗菌药物的耐药性[23]。这些研究与本研究的结果相符。MexEF-OprN与SCF诱导所致的耐药无关。至于MexAB-OprM和MexXY-OprM对于SCF所致耐药的影响仍不明确,需要进一步研究。
综上所述,随着三代头孢菌素在革兰阴性杆菌感染疾病中的广泛使用,特别是SCF,革兰阴性杆菌对头孢菌素类抗菌药物的耐药性大大增加。在SCF使用压力下,敏感的铜绿假单胞菌可被诱导成MDRPA,甚至是耐碳青霉烯铜绿假单胞菌。外排泵MexD的升高和孔道蛋白OprD的降低是体外SCF诱导铜绿假单胞菌耐药的重要机制。因此,在临床上,除了尽量减少对碳青霉烯类抗菌药物的使用外,我们同时也要有效控制对三代头孢菌素的依赖,制定更为安全合理的抗菌药物使用方案,从而进一步防止MDRPA或者耐碳青霉烯铜绿假单胞菌的医院内感染暴发。
参 考 文 献
[1] Laxminarayan R, Duse A, Wattal C, Zaidi AK, Wertheim HF, Sumpradit N, Vlieghe E, Hara GL, Gould IM, Goossens H, Greko C, So AD, Bigdeli M, Tomson G, Woodhouse W, Ombaka E, Peralta AQ, Qamar FN, Mir F, Kariuki S, Bhutta ZA, Coates A, Bergstrom R, Wright GD, Brown ED, Cars O. Antibiotic resistance-the need for global solutions. Lancet Infect Dis, 2013, 13(12):1057-1098.
[2] 胡付品,郭燕,朱德妹,汪复,蒋晓飞,徐英春,张小江,张朝霞,季萍,谢轶,康梅,王传清,王爱敏,徐元宏,沈继录,孙自镛,陈中举,倪语星,孙景勇,褚云卓,田素飞,胡志东,李金,俞云松,林洁,单斌,杜艳,郭素芳,魏莲花,邹凤梅,张泓,王春,胡云建,艾效曼,卓超,苏丹虹,汪瑞忠,房华,俞碧霞,赵勇,龚萍,郭大文,赵金英,刘文恩,李艳明,金炎,邵春红,温开镇,张贻荣,徐雪松,鄢超,喻华,黄湘宁,王山梅,楚亚菲,张利侠,马娟,周树平,周艳,朱镭,孟晋华,董芳,郑红艳,沈瀚,周万青,贾伟,李刚,吴劲松,卢月梅. 2017年CHINET中国细菌耐药性监测. 中国感染与化疗杂志,2018,18(3):241-251.
[3] 张婧,郎欣月,毛莹雪,陈婷婷, 杨淑君, 赵卫. ICU内获得性感染细菌谱及耐药分布. 新医学, 2018, 49(5):359-363.
[4] 魏绪霞,陆平兰,黎利娟,安玉玲,吕海金,易小猛,刘剑戎,熊亮,周密,易慧敏. 外科ICU院内感染的病原菌及其耐药性分析. 新医学, 2014, 45(11):718-723.
[5] Chai YH, Xu JF. How does Pseudomonas aeruginosa affect the progression of bronchiectasis? Clin Microbiol Infect, 2019, S1198-743X(19)30399-4. doi: 10.1016/j.cmi.2019.07.010. [Epub ahead of print]
[6] Pujji OJS, Nakarmi KK, Shrestha B, Rai SM, Jeffery SLA. The bacteriological profile of burn wound infections at a tertiary burns center in nepal. J Burn Care Res, 2019,40(6):838-845.
[7] Yin D, Wu S, Yang Y, Shi Q, Dong D, Zhu D, Hu F. China antimicrobial surveillance network (CHINET) study group. results from the China antimicrobial surveillance network (CHINET) in 2017of the in vitro activities of ceftazidime-avibactam and ceftolozane-tazobactam against clinical isolates of enterobacteriaceae and pseudomonas aeruginosa. Antimicrob Agents Chemother, 2019, 63(4):e02431-18.
[8] Horcajada JP, Montero M, Oliver A, Sorlí L, Luque S, Gómez-Zorrilla S, Benito N, Grau S. Epidemiology and treatment of multidrug-resistant and extensively drug-resistant pseudomonas aeruginosa Infections. Clin Microbiol Rev, 2019, 32(4):e00031-19.
[9] Melnyk AH, McCloskey N, Hinz AJ, Dettman J, Kassen R. Evolution of cost-free resistance under fluctuating drug selection in pseudomonas aeruginosa. mSphere, 2017, 2(4):e00158-17.
[10] Tehrani KHME, Martin NI. β-lactam/β-lactamase inhibitor combinations: an update. Medchemcomm, 2018, 9(9):1439-1456.
[11] Bassetti M, Righi E, Vena A, Graziano E, Russo A, Peghin M. Risk stratification and treatment of ICU-acquired pneumonia caused by multidrug- resistant/extensively drug-resistant/pandrug-resistant bacteria. Curr Opin Crit Care, 2018, 24(5):385-393.
[12] Montero M, Sala M, Riu M, Belvis F, Salvado M, Grau S, Horcajada JP, Alvarez-Lerma F, Terradas R, Orozco-Levi M, Castells X, Knobel H. Risk factors for multidrug-resistant Pseudomonas aeruginosa acquisition. Impact of antibiotic use in a double case-control study. Eur J Clin Microbiol Infect Dis, 2010, 29(3):335-339.
[13] Raman G, Avendano EE, Chan J, Merchant S, Puzniak L. Risk factors for hospitalized patients with resistant or multidrug-resistant Pseudomonas aeruginosa infections: a systematic review and meta-analysis. Antimicrob Resist Infect Control, 2018, 7:79.
[14] 徐雅萍,霍瑞,閆中强,索继江,董喆,邢玉斌,林建,陈春平,杜明梅, 刘运喜. MDR,XDR,PDR 细菌:国际专家关于获得性耐药暂行定义的提案. 中华医院感染学杂志,2017,27(1):231-240.
[15] Coppry M, Jeanne-Leroyer C, Noize P, Dumartin C, Boyer A, Bertrand X, Dubois V, Rogues AM. Antibiotics associated with acquisition of carbapenem-resistant Pseudomonas aeruginosa in ICUs: a multicentre nested case-case-control study. J Antimicrob Chemother, 2019, 74(2):503-510.
[16] Yang P, Chen Y, Jiang S, Shen P, Lu X, Xiao Y. Association between antibiotic consumption and the rate of carbapenem-resistant Gram-negative bacteria from China based on 153 tertiary hospitals data in 2014. Antimicrob Resist Infect Control, 2018, 7:137.
[17] Raman G, Avendano EE, Chan J, Merchant S, Puzniak L. Risk factors for hospitalized patients with resistant or multidrug-resistant Pseudomonas aeruginosa infections: a systematic review and meta-analysis. Antimicrob Resist Infect Control, 2018, 7:79.
[18] Tuon FF, Gortz LW, Rocha JL. Risk factors for pan-resistant Pseudomonas aeruginosa bacteremia and the adequacy of anti-biotic therapy, Braz J Infect Dis, 2012, 16(4):351-356.
[19] Lee CH, Su TY, Ye JJ, Hsu PC, Kuo AJ, Chia JH, Lee MH. Risk factors and clinical significance of bacteremia caused by Pseudomonas aeruginosa resistant only to carbapenems. J Microbiol Immunol Infect, 2017, 50(5):677-683.
[20] Wushouer H, Zhang ZX, Wang JH, Ji P, Zhu QF, Aishan R, Shi LW. Trends and relationship between antimicrobial resistance and antibiotic use in Xinjiang Uyghur Autonomous Region, China: based on a 3 year surveillance data, 2014-2016. J Infect Public Health, 2018, 11(3):339-346.
[21] Masuda N, Sakagawa E, Ohya S, Gotoh N, Tsujimoto H, Nishino T. Substrate specificities of MexAB-OprM, MexCD-OprJ, and MexXY-oprM efflux pumps in Pseudomonas aeruginosa. Antimicrob Agents Chemother, 2000, 44(12):3322-3327.
[22] Cavalcanti FL, Mirones CR, Paucar ER, Montes L?, Leal-Balbino TC, Morais MM, Martínez-Martínez L, Ocampo-Sosa AA. Mutational and acquired carbapenem resistance mechanisms in multidrug resistant Pseudomonas aeruginosa clinical isolates from Recife, Brazil. Mem Inst Oswaldo Cruz, 2015, 110(8):1003-1009.
[23] Kim CH, Kang HY, Kim BR, Jeon H, Lee YC, Lee SH, Lee JC. Mutational inactivation of OprD in carbapenem-resistant Pseudomonas aeruginosa isolates from Korean hospitals. J Microbiol, 2016, 54(1):44-49.
(收稿日期:2019-11-20)
(本文編辑:林燕薇)

