益生菌对新型冠状病毒感染肺炎患者免疫功能的影响
张小彬,王晓麒,冯 涛,雷萌萌,丁 伊,丁贤涛,杨晓军
新型冠状病毒(SARS-CoV-2)在2019 年12 月开始迅速传播,新型冠状病毒感染肺炎(COVID-19)已经被世界卫生组织列为国际关注的突发公共卫生事件,对全球公共健康和经济造成巨大威胁。冠状病毒通过病毒刺突蛋白附着在其特定的细胞受体上,SARS-CoV-2 病毒的受体是血管紧张素转化酶2(ACE2),一种锌金属蛋白酶,它主要通过与肺泡上皮细胞ACE2 受体结合而导致肺部感染。但最近有报道在感染患者的粪便中发现了SARS-Cov-2 RNA,肠上皮细胞(尤其是小肠)也表达ACE2 受体[1]。因此,肠道也是SARS-CoV-2 攻击的靶器官,针对肠道的保护性治疗也是必不可少。益生菌是临床工作中常用于调节肠道菌群的辅助药品,研究发现益生菌制剂能改善老年肺炎患者肺功能、肠道菌群和细胞免疫功能,减轻机体的炎症反应,使用安全性较高[2]。本研究旨在探讨COVID-19 患者早期免疫功能改变,及双歧杆菌乳杆菌三联活菌片辅助治疗7 d 对患者免疫功能的影响。
1 资料与方法
1.1 一般资料:收集宁夏地区2020 年1 月24 日—2020 年2 月29 日确诊的COVID-19 住院患者50例为研究对象。根据病情严重程度分为轻型(10例)、普通型(32 例)和重型+危重型(8 例)。其中,轻型男4 例,女6 例,平均年龄(38.60±14.48)岁;普通型男16 例,女16 例,平均年龄(44.16±13.65)岁;重型+危重型男5 例,女3 例,平均年龄(47.75±8.48)岁。3 组患者性别、年龄比较差异均无统计学意义(P<0.05),表明3 组间一般基线资料均衡可比。本研究获得患者和(或)直系亲属的同意,通过宁夏医科大学总医院伦理委员会批准。
1.2 纳入标准:所有研究对象确诊和临床分型均符合新型冠状病毒感染的肺炎诊疗方案(试行第五版)[3];住院时间≥7 d。
1.3 排除标准:既往存在血液、风湿免疫系统病史;存在恶行肿瘤并近3 个月行放、化疗者;长期服用免疫抑制剂、糖皮质激素等影响免疫系统药物;入院前1 周服用影响血细胞数量药物;肠内营养禁忌;对双歧杆菌乳杆菌三联活菌片成分过敏者。
1.4 治疗方法:所有研究对象均按照新型冠状病毒感染的肺炎诊疗方案(试行第五版)规范治疗,同时入院第1 天开始均给予双歧杆菌乳杆菌三联活菌片(内蒙古双奇药业股份有限公司;规格0.5 g/片;国药准字:S19980004)2.0 g/次,3 次/d,用温开水冲服。
1.5 观察指标:收集所有患者入院时外周血行白细胞计数(WBC)、淋巴细胞比例(LR)、补体C3 和C4、T 淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平测定,比较入院时3 组患者上述免疫指标变化。对比所有研究对象双歧杆菌乳杆菌三联活菌片治疗前(第1 天)与治疗后(第7 天)WBC、LR 水平。此外,从所有研究对象中筛选出入院第7 天检测外周血补体C3、C4 和T 淋巴细胞亚群水平的COVID-19 患者24 例,比较第1 天与双歧杆菌乳杆菌三联活菌片治疗第7 天外周血C3、C4、T 淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平。
1.6 统计学方法:采用SPSS 25.0 软件对数据进行分析,所有数据均进行正态性检验及方差齐性检验,正态分布及方差齐的计量资料以±s 表示,组间比较采用t 检验及方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者入院时各免疫指标水平比较:与轻型COVID-19 患者相比,普通型、重型+危重型患者WBC水平均降低(P<0.05);与轻型、普通型患者相比较,重型+危重型患者LR 降低(P<0.05);3 组间C3、C4、CD3+、CD4+、CD8+、CD4+/CD8+水平比较差异均无统计学意义(P>0.05),见表1。
表1 3 组患者入院时外周血各免疫指标水平比较(±s)
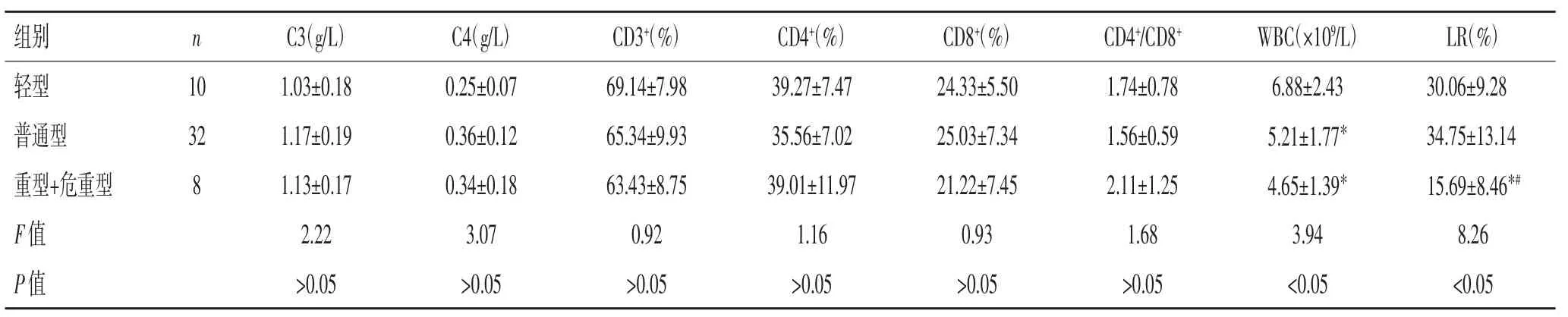
表1 3 组患者入院时外周血各免疫指标水平比较(±s)
注:*与轻型相比,P<0.05;#与普通型比较,P<0.05。
2.2 3 组患者外周血WBC、LR 水平比较:患者入院第1 天与双歧杆菌乳杆菌三联活菌片辅助治疗第7天外周血WBC、LR 水平比较,差异均无统计学意义(P>0.05),见表2。
表2 3 组患者外周血WBC、LR 水平比较(±s)

表2 3 组患者外周血WBC、LR 水平比较(±s)
2.3 3 组患者外周血补体C3、C4 和T 淋巴细胞亚群水平比较:从中筛选出入院第7 天检测外周血补体C3、C4 和T 淋巴细胞亚群水平的COVID-19 患者24 例,入院第1 天与双歧杆菌乳杆菌三联活菌片辅助治疗第7 天患者外周血补体C3、C4 和T 淋巴细胞亚群水平比较,差异均无统计学意义(P>0.05),见表3。
表3 3 组患者外周血补体C3、C4 和T 淋巴细胞亚群水平比较(±s)
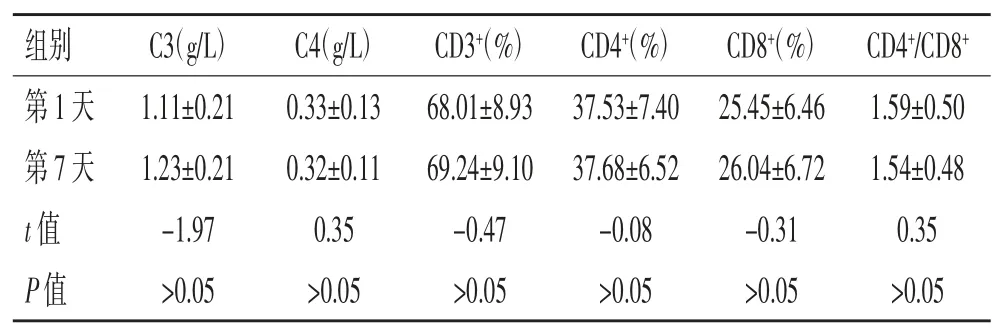
表3 3 组患者外周血补体C3、C4 和T 淋巴细胞亚群水平比较(±s)
3 讨论
SARS-CoV-2 可导致严重急性呼吸系统疾病。COVID-19 的临床表现多种多样,从预后良好的轻症(如发热、流鼻涕、乏力和干咳等)到以急性呼吸窘迫综合征和多器官功能障碍综合征为特征的重症肺炎,甚至出现脓毒性休克。从免疫病理学的角度来看,SARS-CoV-2 可诱导多种辅助T 淋巴细胞1(Th1)和炎性细胞因子、趋化因子,炎症性免疫反应可导致疾病严重程度和死亡率增加[4]。所以,早期评估COVID-19 患者免疫功能具有重要的临床意义。
补体系统在宿主对病毒、细菌和真菌感染的快速固有免疫反应中发挥重要作用[5]。促炎细胞因子(如IL-1、IL-6、TNF-α、干扰素-γ 等)能够刺激补体基因转录和表达,炎症状态、感染、组织损伤急性期时,可导致补体产生增多,血清补体水平升高。补体系统产生的促炎分子C3a 和C5a 可触发炎性细胞浸润,导致肺损伤[5]。近期报告了1 例因COVID-19肺炎导致严重ARDS 的患者临床救治过程,对该患者使用补体C3 抑制剂AMY-101 安全并成功地进行了治疗,提示针对C3 的干预可能对COVID-19患者补体介导的炎症损伤提供了更广泛的控制[6]。此外,对病毒感染的有效免疫反应也取决于细胞毒性T细胞的激活,而细胞毒性T 细胞可以通过杀死感染病毒的细胞来清除感染,增加COVID-19 患者T 细胞的数量和功能对于成功恢复至关重要[7]。Sun 等[8]研究发现,重症COVID-19 患者外周血CD4+、CD8+T淋巴细胞明显减少,且CD8+T 淋巴细胞计数为疾病严重程度的独立预测因子,这与本研究结果不一致。本研究发现轻型、普通型、重型和危重型患者之间外周血T 淋巴细胞亚群、补体C3 和C4 水平差异均无统计学意义,考虑主要原因是各组纳入的病例数较少所致,特别是重型和危重型患者,
本研究中重型和危重型患者占比为16%,但是Sun 等[8]研究中其比例为30%,病例数相差较大,故仍须扩大样本量进一步证实研究结果。另外,虽然所有重型和危重型患者均为入院时收集血样,但是少部分危重病例由外院转入,可能不是确诊COVID-19后早期血样,导致外周血免疫指标不能反映早期的真实水平。
本研究证实,与轻型COVID-19 患者相比,普通型、重型和危重型患者WBC 水平均降低;与轻型、普通型患者相比较,重型和危重型患者LR 降低,差异均有统计学意义。WBC 水平下降与病毒直接侵入造血细胞或骨髓基质细胞感染引起的细胞凋亡和造血抑制加重有关,这与SARS(Severe acute respiratory syndrome)病毒感染后血液系统的表现类似[9]。COVID-19 最严重的并发症是脓毒症样炎症、凝血功能障碍和呼吸、心血管并发症[10]。先天免疫系统可立即产生炎症反应来应对损伤或感染,以限制感染,并帮助适应性免疫系统在感染后7~10 d 内对病毒产生持久的宿主保护性抗体和T 细胞反应[10]。然而,当炎症在达到其目的后没有被调节或解决时,就变成了过度炎症或慢性炎症,并导致适应性免疫反应抑制、组织损伤或器官衰竭,这种失调的炎症引发“细胞因子风暴”,细胞因子风暴进一步导致淋巴细胞减少,阻止适应性免疫系统产生抗病毒抗体[10],这也是COVID-19 患者早期外周血LR 水平降低的主要原因。
在新型冠状病毒感染的肺炎诊疗方案中建议可以使用肠道微生态调节剂,以维持肠道微生态平衡,也可预防患者继发细菌感染[3]。既往研究证实,益生菌辅助治疗方案可降低危重患者呼吸机相关性肺炎的发生率,改善患者的营养状况,提高肠内营养的耐受性,减少ICU 住院日、机械通气时间及抗生素的使用[11-12]。此外,两项荟萃分析显示,益生菌在降低病毒源性呼吸道感染的发生率和持续时间方面具有一定的效果[13-14]。目前,益生菌是否使COVID-19 患者免疫功能获益的临床研究缺乏。遗憾的是,本研究发现双歧杆菌乳杆菌三联活菌片辅助治疗7 d 不能改善患者免疫状态。但是,此次研究中存在样本量少,益生菌服用时间较短的不足,同时部分重症和危重患者因病情严重给予短期的糖皮质激素治疗,糖皮质激素可抑制患者的免疫功能,导致病毒负载增加,机体对病毒的正常清除作用受到影响[15]。以上干扰因素导致本研究结果可能存在偏差,故仍须排除本研究不足,进一步评估益生菌对COVID-19 患者免疫功能的益处。

