促神经再生因子复合剂N6 在谷氨酸介导体外培养脊髓神经元凋亡中的作用
孙振彬,赵廷宝
1. 菏泽市牡丹人民医院骨科,菏泽 274000
2.山东省肿瘤医院骨科,济南 250117
1969 年,Olney[1]提出谷氨酸可使幼鼠视网膜和下丘脑神经元变性,并认为谷氨酸具有神经兴奋性毒性。中枢神经系统中谷氨酸水平增高不但可导致神经细胞死亡,同时也可介导神经细胞凋亡[2-3]。促神经再生因子复合剂N6 是赵廷宝教授结合实验研究和临床工作经验研发的一种促神经再生的药物复合制剂,主要包括神经节苷脂(单唾液酸四己糖神经节苷脂钠)、甲泼尼龙(甲泼尼龙琥珀酸钠)和神经营养因子等[4]。动物实验证明促神经再生因子复合剂N6 对脊髓损伤后神经细胞的凋亡具有明显的抑制作用[5-6],但其能否在谷氨酸诱导的脊髓神经元损伤中发挥保护作用目前尚不清楚。本研究采用体外纯化培养的大鼠脊髓神经元建立谷氨酸损伤模型,观察促神经再生因子复合剂N6 对谷氨酸所致神经元凋亡的作用。
1 材料和方法
1.1 主要材料
妊娠13 d 的Wistar 大鼠,由军事医学科学院动物实验中心提供(动物生产许可证号:SCXK-军2007-004);促神经再生因子复合剂N6 由山东省肿瘤医院骨科赵廷宝教授提供;Neurobasal 培养基、高糖DMEM 培养基、胰蛋白酶、胎牛血清、马血清、N2、B27 购自美国Gibco 公司;多聚赖氨酸、谷氨酰胺、谷氨酸、Hoechst33342 购自美国Sigma 公司;特异性兔抗大鼠MAP-2 购自德国Milipore 公司;FITC 标记山羊抗兔IgG 购自北京中杉金桥生物技术有限公司;TUNEL 试剂盒购自美国Promega 公司;CCK-8 试剂盒购自日本Dojindo 公司。CO2培养箱为日本SANYO 公司产品;Olympus BX50 荧光倒置显微镜为日本Olympus公司产品。
1.2 细胞分离、培养和鉴定
1.2.1 细胞分离及培养
参照文献[7]的操作方法,断颈处死孕鼠,用75%乙醇消毒腹部皮肤,剖腹取出胎鼠。将胎鼠置于超净台中,在解剖镜下快速取出脊髓,除去硬膜,置于解剖液中(葡萄糖3.0 g/L,蔗糖7.5 g/L,HEPES 2.35 g/L,NaCl 8.0 g/L,KCl 0.4 g/L,Na2HPO40.095 g,KH2PO40.03 g/L,pH 调至7.25,过滤后4℃储存)。将脊髓剪成约1 mm3的小块,加适量0.125%胰蛋白酶,置于培养箱中,37℃消化25 min,加入含血清的接种液(79% DMEM,10%马血清,10%胎牛血清,1%谷氨酰胺)终止消化,洗涤2 次。再次加入接种液,用Pasteur吸管轻轻吹打4 ~ 6次,静置片刻,取细胞悬液,重复上述步骤3次。混合细胞悬液,计数,调整细胞密度为5×105/mL,一部分以每皿接种2 mL接种于涂有多聚赖氨酸的35 mm培养皿中,一部分以每孔100 μL接种于涂有多聚赖氨酸的96 孔板中,置37℃、5% CO2培养箱中培养,6 h后全换液为无血清培养基(96% Neurobasal,1% N2,2% B27,1%谷氨酰胺),以后每3 d半量换液1次。
1.2.2 神经元细胞的鉴定
细胞培养至第5 天时进行鉴定。神经元细胞具有标志性的微管相关蛋白2(MAP-2),培养的神经元细胞可通过兔抗鼠MAP-2 多克隆抗体间接免疫荧光染色鉴定。染色方法:分别加入一抗(兔抗鼠MAP-2 抗体)和二抗(FITC 标记的山羊抗兔IgG)孵育神经元细胞,用Hoechst33342复染细胞核。阴性对照用PBS代替一抗。荧光显微镜下观察并拍照,随机选取5个视野,计数阳性细胞占所有细胞的比例。
1.3 实验分组
将脊髓神经元分为3 组:对照组、谷氨酸损伤组和谷氨酸损伤+N6 处理组。谷氨酸损伤模型的建立参照文献[8],细胞培养至第5 天时取出培养皿,吸出培养基并保留,加入50 μmol/L 的谷氨酸溶液(将谷氨酸溶解于1×PBS 中配制成谷氨酸母液,浓度为10 mmol/L,过滤后使用。用时取适量母液加入DMEM 培养基中,终浓度为50 μmol/L,DMEM 提前4 h 置于培养箱中孵育,以平衡温度及pH 值,避免其对细胞的影响),在37℃下作用10 min;吸去谷氨酸溶液,用DMEM 洗涤1 次,加入原来的培养基,置于培养箱中继续培养。对照组以DMEM 代替谷氨酸溶液,其他同谷氨酸组。谷氨酸损伤+N6 处理组于谷氨酸暴露2 h 前在培养基中加入N6,终浓度为10 μL/mL,谷氨酸暴露后继续用原来含有N6 的培养基培养,18 h 后进行各项指标的检测。每组设4个平行皿,结果取平均值。
1.4 TUNEL法检测凋亡细胞
细胞处理完成后取出培养皿,弃去培养基,加入4%多聚甲醛(溶解于1×PBS 中,pH 7.4),4℃放置25 min,用PBS 浸洗2 次、每次5 min;加入0.2% TritonX-100 室温通透5 min,用PBS 浸洗2 次、每次5 min;加入适量平衡液,室温放置10 min,弃去平衡液;加入适量rTdT酶缓冲液(平衡缓冲液45 μL+核苷混合物5 μL + rTdT 酶1 μL),37℃避光孵育60 min,2×SSC 缓冲液浸泡15 min,PBS 浸洗3 次、每次5 min;最后用Hoechst 复染细胞核,Moviol 封片剂封片。阴性对照用PBS代替rTdT酶,其他相同。在荧光显微镜下观察并拍照,随机取10 个高倍视野,由未参与实验并熟悉本实验原理的人员进行计数和统计。
1.5 CCK-8法检测细胞活力
于谷氨酸暴露18 h 后,取出96 孔板,各实验孔内均换成新鲜的无血清培养基,每组设4个平行孔,并设4个未种植细胞的孔作为本底,每孔加入10 μL CCK-8 溶液,将96 孔板放入培养箱继续培养2 h,用酶标仪测定450 nm处的光密度值,用各组光密度值减去相应的本底作为细胞活力结果。
1.6 统计学处理
采用SPSS 16.0 软件对数据进行统计学分析,计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验;以P < 0.05 为差异有统计学意义。
2 结 果
2.1 原代纯化培养脊髓神经元的生长情况及纯度鉴定
相差显微镜下观察可见,细胞接种15 ~ 30 min开始贴壁,4 h 时活细胞几乎全部贴壁,细胞呈圆形或椭圆形,可见到明显的光晕,部分细胞开始有突起生长(图1a);48 h 时,细胞胞体明显增大,突起数增多、伸长(图1b);第4 天时,神经元突起明显增多并交织成网,细胞以双极、三极多见,偶见单极型,光晕更加明显,有明显的立体感,高倍视野下可见细胞胞核(图1c);第5 天时,采用MAP-2 免疫荧光标记神经元,结果95%的细胞呈阳性,证明神经元的纯度较高,实验结果稳定可靠(图1d、e)。

图1 原代纯化培养脊髓神经元的生长情况及纯度鉴定Fig. 1 Growth and purity identification of primary purified cultured spinal cord neurons
2.2 各组神经元细胞形态变化
对照组神经元细胞形态无明显变化(图2a)。谷氨酸损伤组大部分神经元细胞胞体变圆、肿胀、失去原有形态,部分细胞崩解,突起淡化、减少、甚至消失,细胞内出现颗粒样改变,胞核固缩并偏离于细胞边缘(图2b)。谷氨酸损伤+N6 处理组发生上述改变的细胞明显减少(图2c)。
2.3 各组神经元细胞凋亡情况和细胞活力的改变
TUNEL 检测结果显示,对照组凋亡细胞较少见(图3a),凋亡细胞比例为(6.80±2.70)%;谷氨酸损伤组凋亡细胞明显增多(图3b),凋亡细胞比例为(44.20±5.39)%,与对照组相比差异有统计学意义(P < 0.05);谷氨酸损伤+N6 处理组凋亡细胞较谷氨酸损伤组明显减少(图3c),凋亡细胞比例为(22.30±2.90)%,与谷氨酸损伤组相比差异有统计学意义(P < 0.05)。
CCK-8 检测结果显示,谷氨酸损伤组细胞活力(光密度值 0.29±0.07)明显低于对照组(光密度值0.61±0.01),差异有统计学意义(P < 0.05);谷氨酸损伤+N6 处理组细胞活力(光密度值0.47±0.04)较谷氨酸损伤组明显增高,差异有统计学意义(P < 0.05)。

图2 各组神经元细胞形态的变化Fig. 2 Morphological changes of neurons in each group
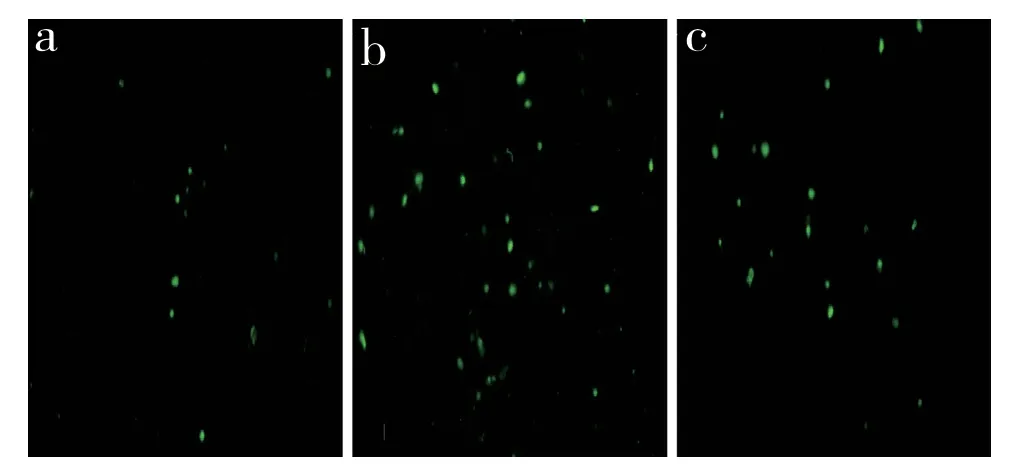
图3 TUNEL 法标记凋亡细胞(凋亡细胞呈绿色荧光)Fig. 3 TUNEL method indicated apoptotic cells(apoptotic cells show green fluorescence)
3 讨 论
生理水平的谷氨酸是中枢神经系统重要的兴奋性神经递质,它主要存在于神经末梢谷氨酸囊泡中,在细胞去极化时释放到突触间隙,作用于突触后膜的谷氨酸受体,完成兴奋性的传递及其他生理作用。病理状态下,过量的谷氨酸在脑和脊髓缺血缺氧性损伤、阿尔茨海默病、亨廷顿病、脊髓侧索硬化症等多种神经系统疾病中表现出神经毒性作用[9-10]。谷氨酸离子型NMDA受体在兴奋性损伤过程中起重要作用,NMDA受体在脑和脊髓组织中均广泛存在[11-12],病理情况下突触间隙谷氨酸大量增加,过度激活NMDA 受体,Ca2+大量内流并在细胞内蓄积,激活蛋白酶、磷脂酶及一氧化氮合酶等,通过这些酶的直接作用或其毒性产物(自由基、一氧化氮等)导致线粒体损伤、神经纤维蛋白分解、膜磷脂破坏,最终引起细胞死亡或凋亡[2]。谷氨酸还可通过AMPA受体亚基GluR2引起脊髓神经元细胞的凋亡[3]。本研究应用体外纯化培养的脊髓神经元细胞发现,在培养过程中加入外源性谷氨酸,不仅可引起脊髓神经元细胞的肿胀、代谢障碍,还可诱导细胞的迟发性凋亡,与既往报道[2,13]结果一致。
有研究证明,促神经再生因子复合剂N6对脊髓损伤后神经细胞的凋亡具有明显的抑制作用[5-6],并能够明显降低脊髓损伤后脂质过氧化物的表达[14-15]。此外,促神经再生因子复合剂N6 还能增加损伤脊髓GRP78 的表达,减少CHOP 的表达,降低内质网应激水平,从而保护受损脊髓[16]。动物实验已证明促神经再生因子复合剂N6 具有生物安全性,初步显示了临床应用的可能[17]。
本研究采用TUNEL法检测了脊髓神经元细胞凋亡情况,并采用CCK-8法检测细胞活力的变化,发现谷氨酸可介导体外培养的脊髓神经元细胞凋亡,而促神经再生因子复合剂N6具有抑制谷氨酸介导的神经元凋亡的作用。本研究进一步为促神经再生因子复合剂N6用于治疗脊髓损伤提供了实验依据。急性脊髓损伤后血清蛋白质组学研究发现多种蛋白组织发生了变化[18],N6 在体内作用时影响了哪些蛋白质的表达、具体机制如何,仍有待进一步研究。
致谢:本实验得到了军事医学科学院三所一室刘少君教授的大力支持,在此表示感谢!
(注:本文所有实验数据、图片及结果分析均来自于作者的硕士毕业论文[19]。)

