基于液相色谱-高分辨质谱技术和多重质量亏损过滤技术的大鼠血浆中大黄素代谢产物鉴定△
程慧玲,陈佳云a,朱春艳,韩璐营,努尔斯曼古丽·阿布都艾尼,付东鹏,吴彩胜*
1.厦门大学 药学院,福建 厦门 361002;2.佳木斯大学 药学院,黑龙江 佳木斯 154007
大黄素(1,3,8-三羟基-6-甲基蒽醌,emodin)是一种天然的蒽醌类化合物,存在于多种中药中,如掌叶大黄RheumpalmatumL.、虎杖PolygonumcuspidatumSieb.et Zucc.和何首乌PolygonimultiflorumThunb.。现代研究表明,大黄素具有抗炎、抗癌、抗菌、利尿、保护神经系统、免疫抑制等多种药理活性,可用于治疗关节炎、胰腺炎、阿尔茨海默病、动脉粥样硬化、慢性阻塞性肺病等疾病[1-5]。但是大黄素也存在一些不良反应,会造成脂质过氧化、DNA氧化和蛋白质损伤[6],在高浓度或长期服用时,可能会导致肝、肾、生殖损伤[7]。
近年来,大黄素在细胞和分子水平的生物学效应研究取得了较大进展,在临床上有广泛应用,可与其他药物配伍使用,常用来增加化学药物治疗的敏感性[8]。但其体内研究相对较少,特别是针对其血浆暴露物质的研究少有开展,主要是肝微粒体或者尿、胆汁样品中的检测。Xu等[9]利用超高压液相色谱-飞行时间质谱,在鼠肝微粒体孵育体系中找到大黄素Ⅰ相代谢物14个。Wu等[10]借助液相色谱联合三重四级杆质谱,在口服大黄素的大鼠尿液和胆汁中共找到35个代谢物,并推断葡萄糖醛酸结合是大黄素主要的代谢途径。一般认为,药物发挥作用,主要是入体的化学物质,也就是血浆中的暴露物质。为了更好地揭示大黄素的药效作用物质基础,探究其潜在的药物-药物相互作用,本研究运用高效液相色谱-高分辨质谱法(HPLC-HRMS)采集大黄素入体成分的质谱数据集;采用高分辨提取离子色谱法(HR-EIC)提取大黄素可预知代谢产物;采用改进的多重质量亏损过滤法(MMDF)识别大黄素的不可预知代谢物;识别和鉴定口服大黄素后大鼠血浆中的暴露成分,为后续大黄素的开发利用提供参考。
1 材料
1.1 实验动物
雄性Wistar大鼠3只,清洁级,体质量180~220 g,购自上海斯莱克实验动物有限公司,生产许可证编号:SCXK(沪)2017-0005,适应性喂养1周后进行实验。
1.2 试药
大黄素(批号:HE152868RG1,纯度>95%,宝鸡辰光生物有限公司);色谱纯甲醇、乙腈及美国化学学会标准(ACS)级甲酸均购自Thermo Fisher Scientific公司;分析纯氯化钠(广州市金华大化学试剂有限公司);超纯水由Milli-Q型净水系统自行制备。
1.3 仪器
Q Exactive型液质联用仪、Metworks 1.3.0.200软件、Xcalibur 3.0.63.3化学工作站数据处理系统(Thermo Fisher Scientific公司);D3024R型离心机[大龙兴创实验仪器(北京)有限公司]。
2 方法
2.1 大黄素溶液配制
准确称取大黄素50.00 mg,加入0.9% NaCl溶液10 mL,超声助溶5 min,即得质量浓度为5 mg·mL-1的大黄素溶液。
2.2 给药与取样
雄性Wistar大鼠3只,给药前禁食24 h,自由饮水,眼眶取血收集空白血样。大鼠以50 mg·kg-1的剂量灌胃给予大黄素溶液,给药后分别于0.5、1.5、3.0、6.0、9.0、12.0、24.0 h取血[11],置于含有1%肝素钠的离心管中,以4500 r·min-1、4 ℃离心10 min(离心半径8.5 cm),取上清液,-20℃冰箱保存。
2.3 样品前处理
分别取各时间点血浆样品150 μL(每只大鼠取50 μL)置于离心管中,加入3倍量的甲醇-乙腈(1∶1),涡旋30 s混合均匀,以4000 r·min-1、4 ℃离心10 min(离心半径8.5 cm),取上清液至离心管中,37 ℃氮吹。在吹干的样品中加入70%甲醇100 μL复溶,超声处理5 min,涡旋混匀,以12 000 r·min-1、4 ℃离心10 min(离心半径8.5 cm),取上清液待分析。
2.4 分析条件
2.4.1色谱条件 色谱柱为ACQUITY UPLC CSH C18(50 mm×2.1 mm,1.7 μm);流动相为0.3%甲酸(A)-乙腈(B),梯度洗脱(0~1 min,5%~20%B;1~2 min,20%~40%B;2~5 min,40%~60%B;5~8 min,60%~80%B;8.0~9.2 min,80%~95%B;9.2~10.0 min,95%B;10.0~10.1 min,95%~5%B;10.1~15.0 min,5%B);流速为0.3 mL·min-1;柱温为35 ℃;进样量为3 μL;检测波长为270 nm。
2.4.2质谱条件 电喷雾离子源(ESI),负离子检测模式;喷雾电压:3.8 kV;毛细管温度:260 ℃;鞘气(N2)流速为40 arb;辅助气(N2)流速为10 arb;扫尾气(N2)流速为2 arb;套管透镜(Tube Lens)电压为120 V;扫描质量数为m/z100~1000;采用Full MS-ddMS2方式进行扫描。
2.5 数据处理
在Thermo Xcalibur 3.0.63.3化学工作站数据处理系统中,利用高分辨提取离子流(HREIC),对检测样品中可预测的代谢产物进行识别鉴定。采用Metworks 1.3.0.200软件对一级高分辨质谱数据进行处理,基于质量亏损数,设置不同的过滤模板:1)以母药为模板化合物,质量亏损为±0.05;2)以母药为模板化合物,质量亏损为±0.09;3)以母药和4个暴露量较高的可预测代谢物为模板化合物,设定相对窄的范围,质量数为±100,质量亏损过滤范围为±0.025,从而识别出大黄素血浆样品中的不可预测代谢产物;4)文献调研,补充代谢物;5)结合质谱碎片数据及裂解规律,推断出代谢产物的可能结构式,过程见图1。

图1 代谢物鉴定流程
3 结果
3.1 HREIC分析结果
利用HREIC分析所采集的高分辨一级数据,结合Metworks 1.3.0.200所提供的可预测代谢途径,找到10个代谢物,主要为大黄素或其同分异构体经磺化、葡萄糖醛酸化或羟基化得来的。记录大黄素及10个代谢物在不同时间点的峰面积,制作体内经时变化热图(见图2)。通过对比,发现代谢物在12 h血浆中的暴露量相对较高,因此选取12 h血浆样品图谱进行MMDF处理。通过比较其暴露强度和准分子离子峰信息,确定了代谢物M9、M11、M15、M18和大黄素作为MMDF操作的模板,其高分辨准分子离子峰分别为[M-H]-m/z461.073,445.077,285.040,349.002,269.044。

图2 大黄素和10个代谢产物的体内经时变化热图
3.2 MMDF分析结果
传统质量亏损过滤技术(MDF)主要采用母药(或者母药的核心结构单位)作为模板化合物。若使用±0.05作为过滤范围(见图3A),有可能丢失一些结构变化较大的代谢产物。而将过滤范围扩大至±0.09时(见图3B),则产生大量干扰峰,由于内源性物质的含量高,因此代谢物的丰度降低,影响代谢产物的分析。
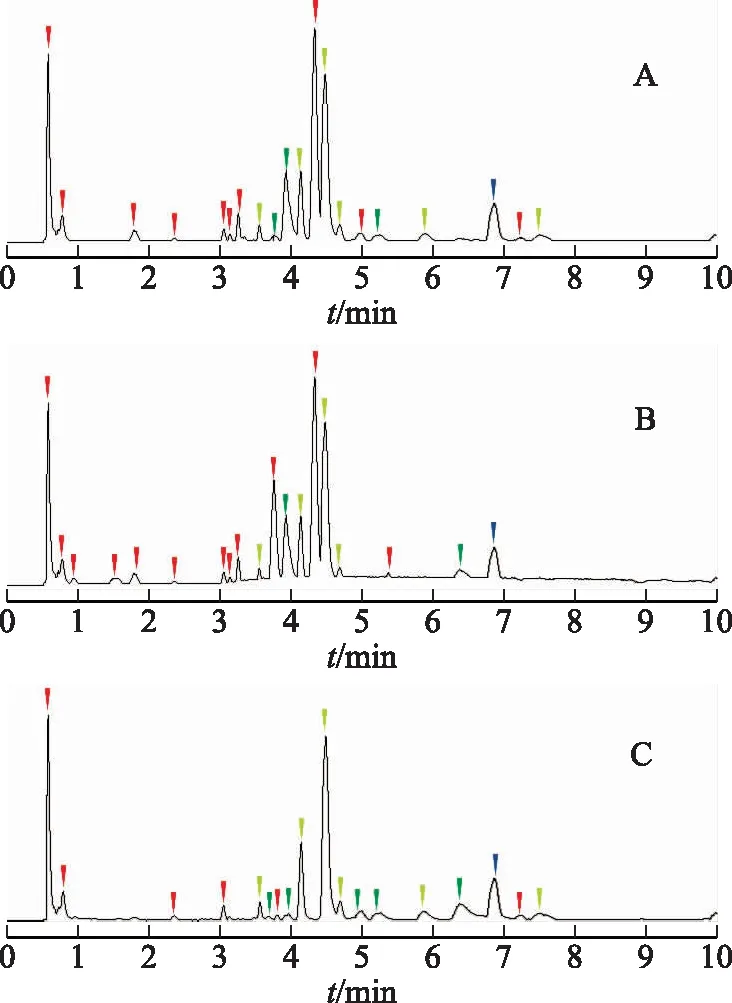
注:A.采用母药作为过滤模板,±0.05作为过滤范围;B.采用母药作为过滤模板,±0.09作为过滤范围;C.采用母药及4个代谢物作为过滤模板,窄范围过滤(质量数范围:±100,质量亏损过滤范围:±0.025);蓝色峰为大黄素;绿色峰为MMDF处理后新挖掘的代谢产物;红色峰为假阳性峰;黄色峰为MMDF处理前已找到的代谢产物。图3 不同过滤参数搜寻代谢物的效果对比
本研究采用改进的MMDF技术,通过增加体内高暴露量的4个不同相对分子质量代谢物作为模板化合物,使用±0.025进行窄范围过滤(见图3C)。结果表明,该策略不仅大大减少了假阳性结果,而且能够发掘出更多的代谢产物,具有更好的实际运用价值。
3.3 代谢物结构鉴定
根据二级质谱图,结合MMDF处理前后得出的一级数据以及文献调研数据,共从大鼠血浆样本中鉴定了18个代谢物(见图4),其中有12个首次在血浆样品中发现,有3个(M4、M13和M16)未在其他文献中报道[10,12-14]。同时,MMDF处理方式也存在一定的局限性,如M1、M3无法找到,需通过文献调研进行补充。母药大黄素和代谢产物的质谱数据和结构鉴定结果见表1。通过DAS(3.0版)软件计算大黄素和各代谢产物的曲线下面积(AUC),分析体内暴露量(见图5),M9(大黄素+Glu A)为体内暴露量最高的代谢物,M6(大黄素+Glu A+SO3)、M7(大黄素+Glu A)、M16[大黄酸(异构体)+O+SO3]、M11(大黄素+O+Glu A)和M15(大黄素+SO3)次之,可推测大黄素进入体内后主要代谢途径为葡萄糖醛酸结合、磺酸化等结合反应,也有部分进行羟基化等氧化还原反应(见图6)。

注:绿色表示MMDF处理后找到的代谢物;红色表示MMDF处理前找到的代谢物;蓝色表示文献调研找到的化合物。图4 大黄素和代谢产物的HREIC图

注:AUC为各时间点峰面积×h。图5 大黄素和代谢产物的体内暴露量

图6 大黄素的体内代谢途径

表1 大黄素及其代谢产物的质谱数据和结构鉴定结果
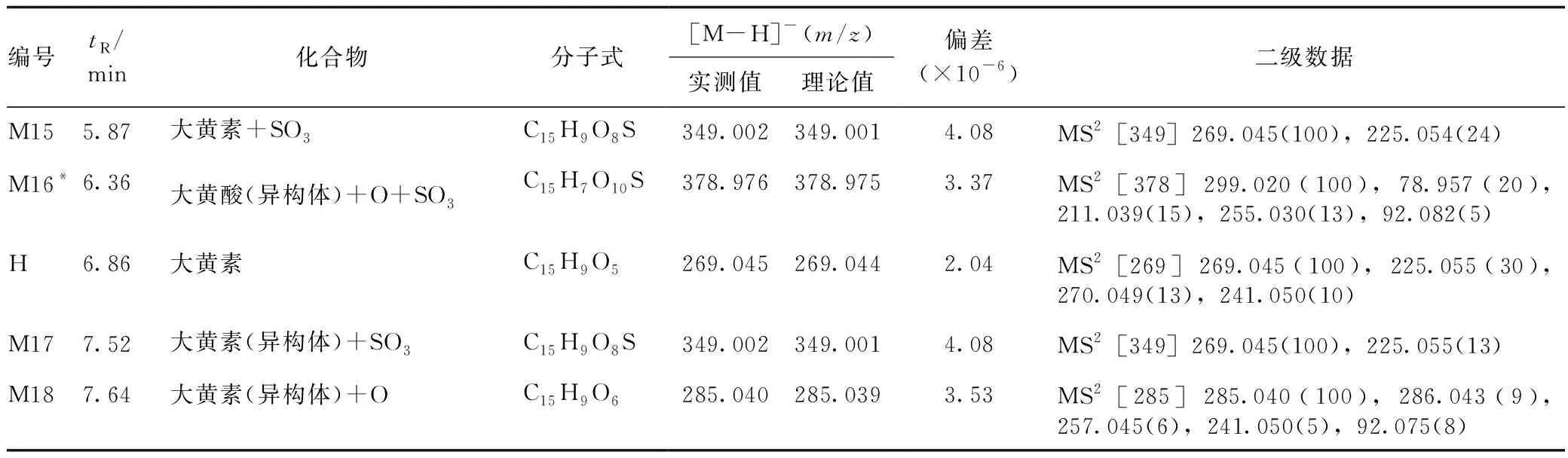
续表1
4 讨论
目前,随着各种串联高分辨质谱的发展,使用一个简单、普适的采集方法自动获得生物样品中药物入体成分的质谱数据集已经成为成熟的通用检测方法。但由于仪器自动采集的质谱数据中包含大量无效的质谱数据,如何在后处理中高效而全面地识别出药物入体成分的相关信息,已成为运用串联高分辨质谱进行药物吸收、分布、代谢、排泄(ADME)研究的首要关键问题[15]。在过去的十余年间,各种质谱数据集挖掘技术被先后开发出来,以满足体内代谢产物识别和鉴定的需要,包括HREIC、MDF、中性丢失过滤(NLF)和产物离子过滤(PIF)等。HREIC可有效检测可预测代谢物。MDF能根据代谢物质量亏损的情况及核心结构的相似性来搜寻未知代谢物[16]。MMDF在MDF的基础上增加了更多的过滤模板,可对任何代谢物的类似结构进行搜索,使分析结果更具全面性[17]。但模板化合物的增多势必会增加无效数据的量,因此需要缩小质量范围及亏损范围来有效减少干扰峰的产生,使分析效率大大提升。
已有研究表明,细胞色素P450 1A2、2C19和3A4介导大黄素氧化[18],UDP-葡萄糖醛酸转移酶2B7(UGT2B7)介导大黄素葡萄糖醛酸化。UGT2B7和多药耐药蛋白2(MRP2)的偶联导致大黄素生物利用度低下[19],产生毒代动力学性别差异[20]。可见大黄素的药效和毒性与其代谢转化存在密切关系。本研究利用HPLC-HRMS采集数据,通过HREIC、MMDF分析及文献调研全面识别和鉴定了大黄素的血浆暴露代谢产物,共发现18个体内代谢物,其中3个为首次发现。研究表明,大黄素主要代谢途径为葡萄糖醛酸化、磺化、羟基化等,确定大黄素的主要代谢位点,可为后续大黄素的深度研究开发提供参考。本研究所建立的高分辨质谱分析方法方便快捷,适用于药物代谢产物的分析研究,可为药物体内分析提供技术保障。

