介质阻挡放电协同Bi2WO6/天然赤铁矿降解乙酸乙酯
毛书磊, 李云霞, 张秋月, 徐良龙, 朱承驻*
1.合肥工业大学资源与环境工程学院, 安徽 合肥 230009 2.合肥工业大学大气环境与污染控制研究所, 安徽 合肥 230009
EA(ethyl acetate,乙酸乙酯)是一种典型的VOCs(挥发性有机物),广泛应用于油漆、涂料、合成橡胶等生产过程中. 工业生产中EA易挥发进入空气,对大气环境和人体健康造成危害[1]. 因此,研究如何高效、快速地处理EA具有重要的现实意义.
近年来,DBD(介质阻挡放电)等离子体技术因其处理废气效率高、反应速率快、成本低而引起广泛关注[2],其可以在常温常压下降解有机废气,与传统的生物法、吸附法与燃烧法等相比具有一定的优势[3-5]. ZHANG等[6]采用DBD处理苯乙烯发现,在电压为10.8 kV、ρ(苯乙烯)为3.6 mgL下,苯乙烯去除率可高达99.6%. 但DBD技术也存在一些不足之处,如能效低及产生的副产物浓度较高等[7]. 研究[8]发现,DBD技术与催化剂联用能有效提高污染物去除率,同时可以降低能耗、减少副产物的产生. WANG等[9]采用DBD协同CeO2MnO2催化降解甲苯发现,在相同条件下,催化剂的置入最高可将甲苯去除率和CO2选择性分别提高30%和55%. 与催化燃烧法相比,DBD协同催化剂技术具有工艺简单、能量利用率高和运行费用低等优点[10],而相较于光催化法,DBD协同催化剂技术反应速率更快、废气去除率更高[11].
Bi2WO6作为一种新型半导体催化剂,稳定性高且无污染,其禁带宽度仅为2.7 eV[12],可被等离子体放电激活产生电子-空穴对[13]. 但由于Bi2WO6的光生电子复合率较高导致其催化性能不够理想,研究发现采用金属氧化物对Bi2WO6进行表面修饰,能够有效提高其催化效率[14]. 赤铁矿在自然界中分布广且价格便宜,具有较大比表面积和良好吸附性,其主要成分为α-Fe2O3,能有效催化分解等离子体放电过程中产生的O3,生成氧化性更强的O·,促进有机废气的降解[15]. 以赤铁矿作为载体,既可利用其优良的表面特性,又发挥了其催化作用,可弥补催化剂载体仅起到负载作用而缺乏催化活性的不足.
因此,该研究以廉价易得的NH(natural hematite,天然赤铁矿)为载体,制备了Bi2WO6NH复合催化剂,采用DBD协同催化剂降解EA,考察催化剂的置入对EA去除率、能量产率及副产物的影响,并进一步分析了降解机理,以期为低温等离子体降解VOCs在工业上的应用提供理论基础和技术支持.
1 材料与方法
1.1 催化剂的制备
将2.43 g硝酸铋加入去离子水中80 ℃搅拌溶解得到溶液A,取2.92 g溶解于氨水的EDTA溶液加入溶液A中得到溶液B. 取0.64 g钨酸铵于去离子水中加热搅拌溶解,将溶液B缓慢滴入钨酸铵溶液中,80 ℃下搅拌得到溶液C. 取6.98 g NH粉末于去离子水中搅拌3 h得到溶液D. 将溶液C与溶液D混合搅拌2 h后置于烘箱中烘干,450 ℃下煅烧4 h,制得Bi2WO6与NH质量比为1∶4的Bi2WO6NH复合催化剂.
1.2 催化剂的表征
1.3 试验装置
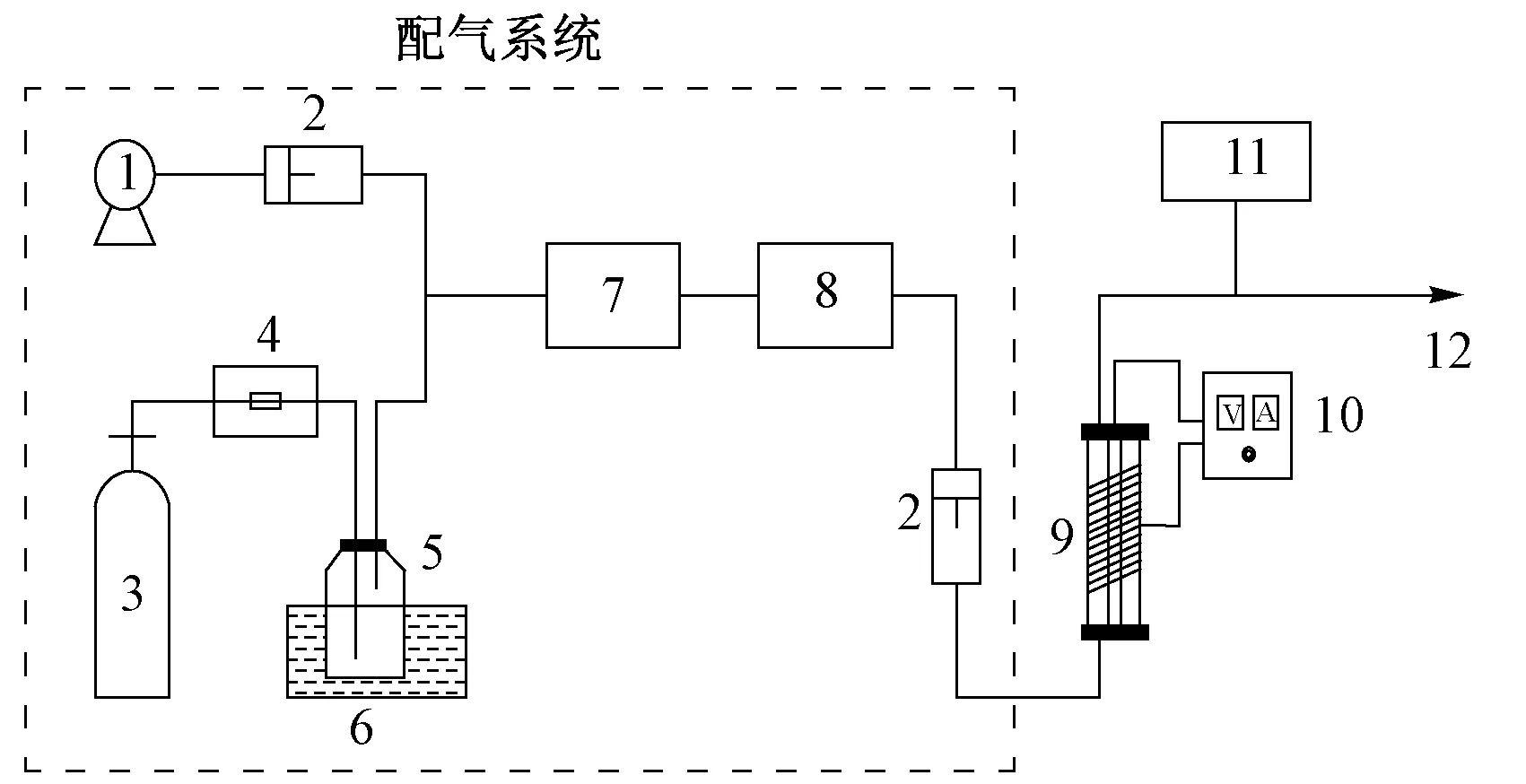
注: 1—气泵;2—转子流量计;3—压缩空气; 4—质量流量计;5—装有液体EA的孟氏洗瓶; 6—装有冰水的烧杯;7—混合瓶;8—缓冲瓶; 9—DBD反应器;10—电源;11—采样口;12—排气口.图1 试验装置Fig.1 Schematic diagram of the experimental system
由图1可见,试验装置主要由配气系统、自制DBD反应器和电源三部分组成. DBD反应器采用外径35 mm、厚2 mm、长246 mm的石英管为外介质层,以宽为8 mm的铜箔间隔2.5 mm缠绕外石英管12圈作为外电极. 内介质层为外径9 mm、厚度1 mm、长250 mm的石英管,内衬直径6 mm紫铜棒作为内电极. 电源为上海振兴仪器厂生产的高压交流电源,其外施电压范围为0~25 kV、频率为5~20 kHz可调.
将装有液体EA的孟氏洗瓶冰水浴,压缩空气流经孟氏洗瓶后将EA饱和蒸汽带出并与另一路空气混合,配制成一定浓度的含EA模拟废气,进入DBD反应器进行反应. 将2.5 g粒径为20~40目(1目=1.5 μm)的催化剂使用石英棉固定置于余辉区(DBD反应器尾部). 所有试验均在常温常压下进行.
1.4 分析方法
利用GC(气相色谱,TRACE 1300,美国赛默飞公司)测定反应前后的ρ(EA);反应后的气相产物采用FT-IR(傅里叶变换红外光谱仪,Vertex 70,德国布鲁克公司)及GC-MS(气相色谱质谱联用仪,7890-5975C,美国安捷伦公司)分析;ρ(O3)用碘量法测定. 气体采集均在DBD反应器运行15 min达到稳定状态后进行,重复测量3次,其降解效果采用EA去除率(η)、能量产率(EY)及矿化率(M)进行评价:
η=(Cin-Cout)Cin×100%
(1)
EY=1 000CinηQP
(2)
M=(CCO244)(4Cinη88)×100%
(3)
式中:Cin、Cout分别为进、出口ρ(EA),mgL;Q为气体流量,m3h;P为输入功率,W;CCO2为反应生成的ρ(CO2),mgL.

图3 催化剂的SEM图Fig.3 SEM images of catalysts
2 结果与讨论
2.1 催化剂的表征结果
2.1.1XRD表征
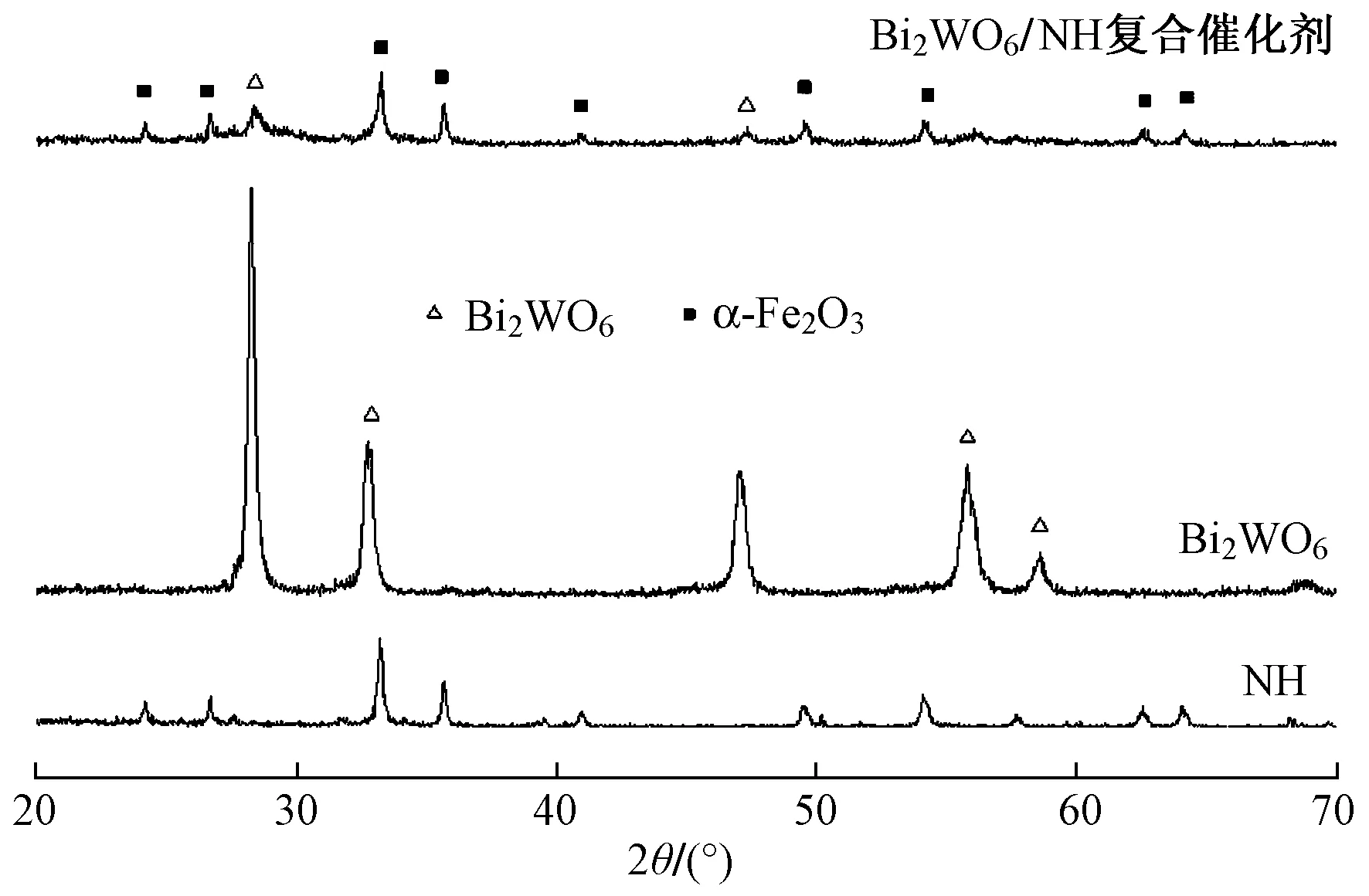
图2 催化剂的XRD分析Fig.2 XRD analysis of catalysts
由图2可见,Bi2WO6峰型尖锐,强度较大,说明其结晶度好,各衍射峰位置(28.3°、32.8°、47.0°、55.6°、58.4°)与JCPDF NO.39-0256标准卡片完全吻合,表明其为纯钨铋矿结构[16]. NH和Bi2WO6NH复合催化剂在2θ为24.2°、26.7°、33.2°、35.7°、41.0°、49.6°、54.1°、62.5°和64.1°处均存在明显衍射峰,与α-Fe2O3标准卡片(JCPDF No.1-1053)吻合,表明NH的主要成分为α-Fe2O3,且Bi2WO6的引入并没有改变NH的晶相结构. Bi2WO6NH复合催化剂中,Bi2WO6衍射峰强度较弱,表明其高度分散于NH表面[17].
2.1.2BET表征
由表1可见,Bi2WO6NH复合催化剂的比表面积和总孔容均大于纯Bi2WO6和NH,表明活性组分Bi2WO6的引入为催化剂提供了更多的活性位点,有助于提高催化剂的催化活性[18].
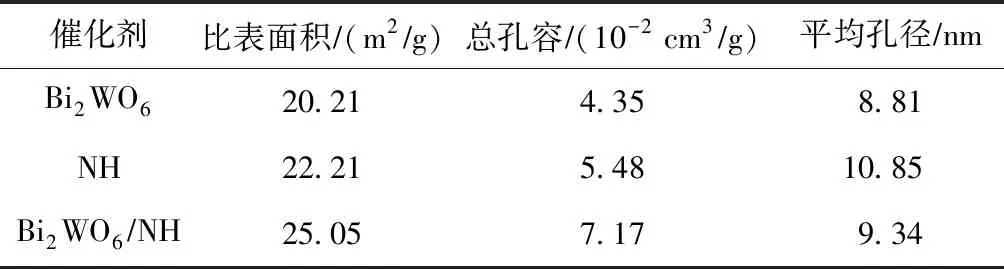
表1 不同催化剂的比表面积、总孔容及平均孔径值
2.1.3SEM表征
由图3可见,NH以片状结构存在,Bi2WO6由小型不规则层状结构组成,Bi2WO6NH复合催化剂中Bi2WO6均匀地分散在NH表面. 在450 ℃煅烧条件下,一方面Bi2WO6在高温过程中发生重结晶作用,形成了大量的微介孔[19];另一方面,原本赤铁矿堆叠的大孔道被负载的Bi2WO6颗粒填充,形成了更多的细小孔道,导致复合催化剂总孔容增加较大,与表1结果一致.
2.2 不同工艺参数对EA降解效果的影响
2.2.1输入功率的影响
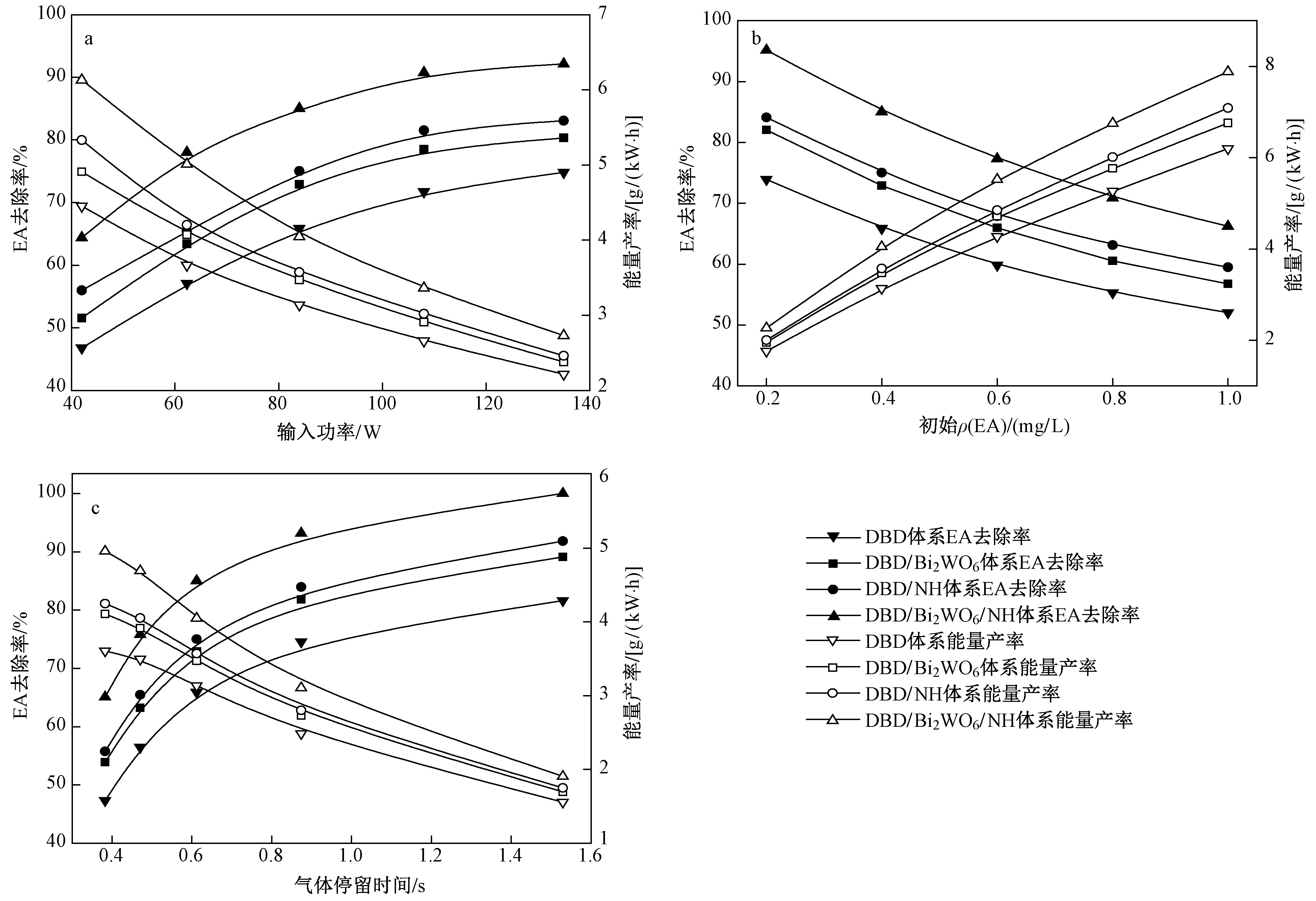
图4 不同输入功率、初始ρ(EA)与气体停留时间对EA去除率和能量产率的影响Fig.4 Effect of input power, initial ρ(EA) and gas residence time on the removal efficiency and energy yield
在流量为1.0 m3h、初始ρ(EA)为0.4 mgL下,探究输入功率对EA去除率和能量产率的影响〔见图4(a)〕. 由图4(a)可见,各体系中EA去除率均随输入功率的增加而升高,但能量产率反而降低,与JIANG等[20]采用DBD降解甲苯的研究结果相一致. 输入功率的升高会导致更多高能电子及活性物质的生成,从而促进EA的降解[21]. 但同时输入的能量会有部分以热量的形式散失,当输入功率增加时,以热量形式损失的能量也会增大,从而使能量产率降低. 此外,催化剂的置入显著提高了EA去除率和能量产率,其中以Bi2WO6NH复合催化剂效果最优. 随着输入功率从42 W升至135 W,DBDBi2WO6NH体系中EA去除率由64.40%增至92.15%,能量产率由6.13 g(kW·h)降至2.73 g(kW·h). 催化剂在DBD体系中可能存在三方面的主要作用:①Bi2WO6被等离子体放电激活产生电子-空穴对[13],其直接或间接参与EA的降解;②在α-Fe2O3的催化作用下,O3分解产生强氧化性的O·,促进EA的降解[15];③α-Fe2O3掺入Bi2WO6,有效抑制了电子与空穴的结合,提高其催化效率[18].
2.2.2初始ρ(EA)的影响
2.2.3气体停留时间的影响
在输入功率为84 W、初始ρ(EA)为0.4 mgL下,探究气体停留时间对EA去除率和能量产率的影响〔见图4(c)〕. 由图4(c)可见,随着停留时间从0.38 s延至1.53 s,DBDBi2WO6NH体系中EA去除
率由65.07%升至100%,但其能量产率却从4.96 g(kW·h)降至1.90 g(kW·h). 这与ZHU等[23]采用DBD降解乙硫醇的研究结果相一致. 延长气体停留时间会增加EA分子与高能电子及活性物质的碰撞概率,导致去除率的增加. 但同时会减少单位时间内处理废气的量,降低能量产率[24]. 因此,在实际工业应用中,应综合考虑去解率及能量产率以选择最佳气体停留时间.
2.3 输入功率和催化剂对ρ(O3)及矿化率的影响
工业上用等离子体去除VOCs过程中往往伴随着O3的产生,而O3会对大气环境和人体健康造成危害. 探究在初始ρ(EA)为0.4 mgL、流量为1.0 m3h条件下,输入功率和催化剂对尾气中ρ(O3)的影响〔见图5(a)〕. 随着电源输入功率的升高,各体系内ρ(O3)先增后降,且在输入功率约为84 W时达到最大值,与Subrahmanyam等[25]研究一致. 原因是随着输入功率的增高,高能电子数量增加,其与O2碰撞概率增大,促进了O3的生成[26]. 当功率大于84 W时,过量的高能电子、O·与O3反应生成O2,导致ρ(O3)的降低[26-27]. 同时,随着功率从42 W增至135 W,DBD反应器中温度从57 ℃升至192 ℃〔见图5(a)〕,而温度的升高会导致O3半衰期的减小,一定程度上加速O3的分解[28].催化剂分解O3的能力表现为Bi2WO6NH复合催化剂>NH>Bi2WO6. 在输入功率为84 W时,DBDBi2WO6NH体系中ρ(O3)相较于DBD体系降低了74.47%. α-Fe2O3可催化分解吸附在催化剂表面上的O3并产生O·[15]:
O3+α-Fe2O3→O·+O2
(4)
此外,O3在Bi2WO6的催化作用下分解并产生氧化性更强的·OH[12-13,29]:
Bi2WO6+hvactive species→h++e-
(5)
h++H2O→·OH+H+
(6)
O3+e-→O3-
(7)
H++O3·-→HO3·
例(3):“Do you,” said I, “do you always work up the deduction after this fashion in your own case, sir?”
(8)
HO3·→O2+·OH
(9)
式中,hv为紫外光,active species为活性物质.
DBD反应器运行过程中会产生大量的活性物质,并伴随着紫外光的产生,其波长约为315~390 nm[13],且DBD体系中紫外光能量仅占系统能量的3×10-4[30],因此,余辉区的Bi2WO6主要被活性物质激活产生催化活性[13],其光催化作用很小. Sano等[30]研究表明,TiO2吸收等离子体放电产生的紫外光直接催化降解乙醛的贡献率不到0.2%;同时,由于Bi2WO6催化O3分解产生的·OH具有强氧化性[29],DBDBi2WO6体系中EA的催化降解主要归结为O3催化氧化产生的作用. HUANG等[31]采用DBD联合TiO2催化降解甲苯发现,甲苯的催化降解主要为TiO2催化分解O3起到氧化作用,而紫外光激活TiO2直接催化降解甲苯的作用并不明显.
矿化率可反映污染物是否降解彻底,是实际工业应用中一项重要指标. 在初始ρ(EA)为0.4 mgL、流量为1.0 m3h下对尾气中ρ(CO2)进行测定,以探究输入功率和催化剂对矿化率的影响〔见图5(b)〕. 由图5(b)可见,各体系中矿化率均随输入功率的升高而增加. 原因是随着功率的升高,高能电子及活性物质密度增加,可同时作用于EA分子及中间产物,使之进一步降解[21]. 催化剂能显著提高矿化率,其中以Bi2WO6NH复合催化剂效果最优,当输入功率为84 W时,相较于DBD体系,DBDBi2WO6NH体系中EA矿化率提高了14.44%. DBD降解EA过程中起主要作用的为高能电子、O3、O·和·OH,O3并不能将EA完全氧化,生成的副产物浓度较高,导致DBD体系中矿化率较低[32]. 而Bi2WO6NH催化分解O3生成的O·、·OH可以无选择性的将EA和副产物氧化为CO2和H2O,从而提高矿化率[33].
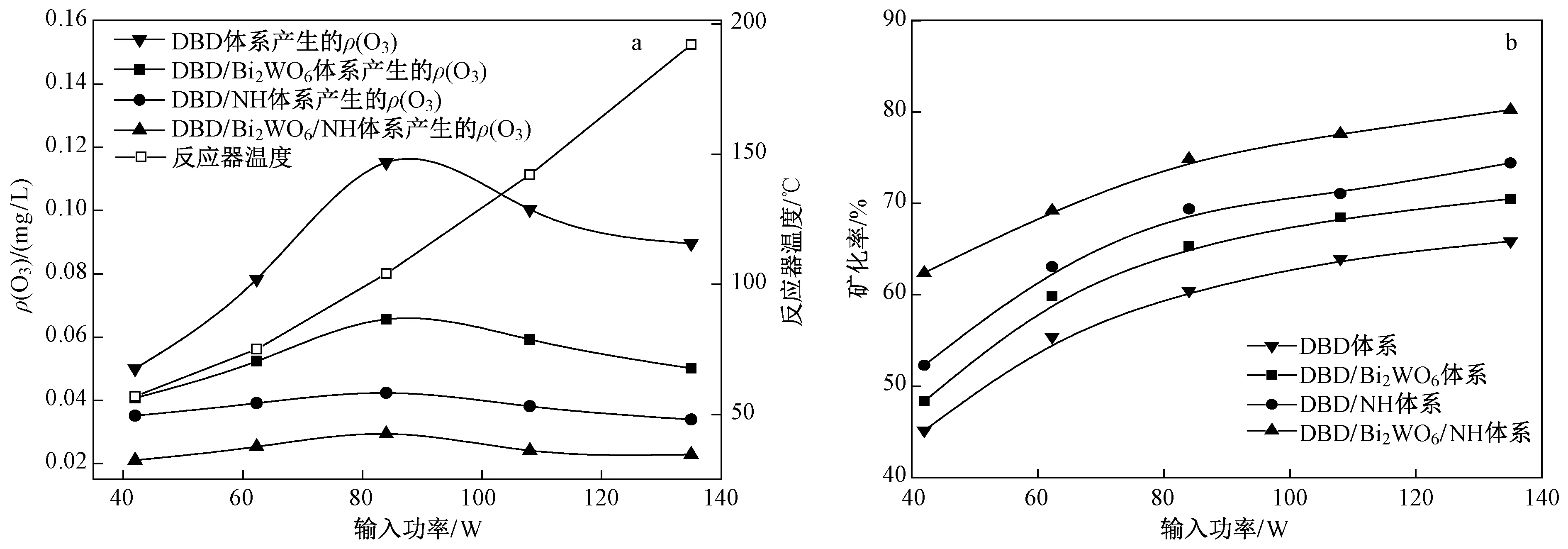
图5 输入功率和催化剂对ρ(O3)及矿化率的影响Fig.5 Effect of input power and catalysts on ρ(O3) and mineralization rate
2.4 反应途径探究
结合图5(b)和图6(a)可知,DBD降解EA的产物主要为CO2和H2O,以及微量的CH3OH、CH4、NO2、CO和CH3CH2OH等副产物. 对处理后的尾气进行GC-MS分析〔见图6(b)〕,表明其副产物中还含有CH3COOCH3、CH3CH2OH、HCOOH、CH3COOH、CH3COOCH2OH、OHCH2COOC2H5等. 另外,ZHU等[34]采用DBD降解EA发现,气相产物中存在微量HCHO、CH3CHO.
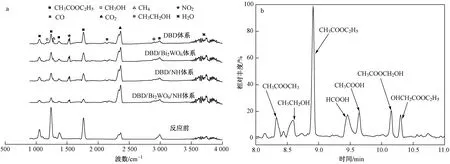
图6 气相产物FT-IR和GC-MS色谱Fig.6 FT-IR and GC-MS spectra of gas phase products

CH3COOC2H5+e→
·CH3(CH3CO·,·C2H5等)
(10)
·OH,O·,H·+·CH3(CH3CO·,C2H5O·等)→
CH4(CH3COOH,C2H5OH等)
(11)
在高能电子进一步作用下,EA分子断裂C—H生成·CH2COOC2H5等自由基,并与·OH反应生成OHCH2COOC2H5[35-36]:
CH3COOC2H5+e→·CH2COOC2H5
(12)
·CH2COOC2H5+·OH→OHCH2COOC2H5
(13)
·CH3与H·、·OH重组可生成CH4、CH3OH,同时在·OH和O·的作用下,·CH3被氧化为HCHO[34,37]:
CH3CO·(·C2H5,CH3COO·等)+e,·OH,O·→
·CH3,CO,CO2
(14)
·CH3+H·,·OH,O·→CH4,CH3OH,HCHO
(15)
其中,CH3OH、CH3CH2OH、HCHO、CH3CHO被·OH、O·进一步氧化生成HCOOH和CH3COOH[34,36]:
CH3OH,CH3CH2OH,HCHO,CH3CHO+·OH,O·→
HCOOH,CH3COOH
(16)
上述大部分中间产物在·OH、O·的作用下进一步被氧化为CO2和H2O实现矿化[38]:
CH4(CH3OH,CH3CH2OH等)+·OH,O·→
CO2,H2O
(17)
3 结论
a) 余辉区中催化剂的置入可显著提高EA的去除率和能量产率. 在不同工艺参数条件下,EA去除率和能量产率均表现为DBDBi2WO6NH体系>DBDNH 体系>DBDBi2WO6体系>DBD体系.
b) EA去除率随输入功率的升高和气体停留时间的延长而增加,随初始ρ(EA)的升高而降低,但能量产率随输入功率的升高和气体停留时间的延长而降低,随初始ρ(EA)的升高而增加.
c) Bi2WO6NH复合催化剂能够催化分解O3产生O·与·OH,促进EA的降解. 在输入功率为84 W、初始ρ(EA)为0.4 mgL、气体流量为1.0 m3h下,相较于单独DBD,DBDBi2WO6NH体系中EA去除率和矿化率分别提高了19.16%和14.44%,而ρ(O3)降低了74.47%.
d) DBD协同Bi2WO6NH可高效去除EA,其最终降解产物主要为CO2和H2O及微量的CH4、CH3CH2OH、CH3COOH等小分子有机化合物.

