四川牡丹花粉生活力测定方法的比较


摘 要:本研究以四川牡丹花粉为材料,利用离体萌发法、亚历山大染色法、TTC染色法及I2-KI染色法,测定四川牡丹花粉的活力。结果表明:开花后第1天花粉即具有活力,第4天花粉活力最高,随着开花时间的推移,花粉活力逐渐下降。开花后1~7 d,用4种测定方法测得的花粉活力变化趋势基本一致。亚历山大染色法与离体萌发法的结果差异极其显著(P<0.01)。TTC染色法和I2-KI染色法,与离体萌发法的结果差异不显著。其中I2-KI测定结果最接近离体萌发法。综合考虑实验条件、实验周期、实验过程和药品保存方法等因素,I2-KI染色法适合四川牡丹野外人工传粉之前快速准确地测定花粉活力。这为探讨四川牡丹濒危的原因、保护种质资源、开展引种驯化和杂交育种提供了理论依据。
关键词:四川牡丹;花粉;生活力;测定方法中图分类号:S685.11 文献标识码:A
Comparative Study on Determination Methods of Pollen Viability in Paeonia decomposita
WANG Shiquan
Ministry of Education Key Laboratory for Ecology of Tropical Islands / College of Life Sciences, Hainan Normal University, Haikou, Hainan 571158, China
Abstract: In this paper, the pollen viability ofPaeonia decompositawas studied using in vitrogermination, Alexander staining, TTC staining and I2-KI staining methods. The results showed that the pollen had viability on the first day after flowering, and the highest viability was on the fourth day. As the flowering time lapsed, the pollen viability gradually decreased. The change tendency of pollen viability in 1–7 d after flowering determinated by four methods were basically the same. The results of Alexander staining and in vitrogermination were extremely significantly different (P<0.01), while the differences between TTC staining, I2-KI staining and in vitro germination were not significant. The determination results of I2-KI were closer to that of thein vitro germination method. Taking into account factors such as experimental conditions, experimental periods, experimental processes and drug preservation methods, I2-KI staining method was suitable for the rapid and accurate determination of the pollen viability before artificial pollination of P. decompositain the field. This would provide a theoretical basis for exploring the endangered causes, protecting germplasm resources, introducing domestication and cross breeding ofP. decomposita.
Keywords: Paeonia decomposita; pollen; viability; determination methods
DOI: 10.3969/j.issn.1000-2561.2020.01.008
四川牡丹(Paeonia decompositaHand.-Mazz.)是芍藥科芍药属落叶灌木,被列为濒危植物[1-2]。野外仅分布于四川省西北部,分布范围狭窄,数量较少,自然更新能力相对较差,是野生牡丹中受威胁度高的种类[3]。国内学者从分类修订[4-6]、核型[7]、遗传进化[8-9]、生态位[10]、种子特性[11-12]、种间关系[13-17]等方面进行了深入研究。四川牡丹具有较高的观赏价值,根皮可入药(俗称丹皮),是宝贵的花卉种质资源和药用植物资源,也是新品种选育的重要遗传材料。
花粉是植物有性繁殖重要的遗传物质载体,其活力直接影响到种子结实,在杂交育种中扮演着重要角色,也是研究细胞极性生长、分化以及信号转导的重要体系[18-19]。目前缺乏对四川牡丹杂交育种方面的研究,缺乏对花粉活力的系统研究。而花粉活力的高低对杂交育种影响很大,因此,有必要对其花粉生活力进行检测。本研究以四川牡丹花粉为实验材料,以离体萌发测定法的结果为标准,比较亚历山大染色法、TTC染色法和I2-KI染色法的测定结果,确定四川牡丹花粉活力快速有效的测定方法,为探讨四川牡丹濒危的原因、保护种质资源、开展引种驯化和杂交育种提供理论依据。
1 材料与方法
1.1材料
四川牡丹一般3月中旬开始长出嫩叶,4月中旬开始开花,9—10月落叶,不同年份略有差异。2017年5月,在四川马尔康选择生长健壮、无病虫害的植株,按个体采集了开花后1~7 d的花粉。采集时用镊子将花药取下,放入纸袋中,置于4 ℃冰箱中贮存,用于后续实验。
1.2方法
1.2.1 离体萌发法测定花粉活力 参考律春燕等[20]的方法,将花粉散落到双凹面载玻片上,滴1~2滴预先筛选好的培养液(150 g/L蔗糖+30 mg/L硼酸+20 mg/L CaCl2,pH 5.8~6.5),搅拌均匀后,置于25 ℃恒温箱中,培养后在显微镜下观察花粉萌发情况。每个个体的不同开花天数,镜检花粉粒数都超过500个,并计算花粉萌发率。
1.2.2 亚历山大法测定花粉活力 参考Alexan der[21]的方法,将花粉置于载玻片上,用亚历山大染色液进行染色,可育花粉壁呈绿色,原生质呈红色,败育花粉呈绿色。压片后置于显微镜下分别统计各个视野中可育、败育的花粉数。每个个体的不同开花天数,镜检花粉粒数都超过400个。
1.2.3 TTC染色法测定花粉活力 参考张志良[22]的方法,用镊子取少量花粉置于干净载玻片上,加入1~2滴0.5%的TTC溶液,搅拌均匀,使花粉散开,盖上盖玻片,放于装有湿滤纸的培养皿中,于37 ℃恒温水浴锅中温浴后镜检,被染成红色的花粉表示生活力强,淡红色次之,没有活力的花粉或不育花粉无法着色。分别统计有活力和无活力的花粉粒数。每个个体的不同开花天数,镜检花粉粒数都超过400个。
1.2.4 I2-KI染色法测定花粉活力 参考李合生[23]的方法,用镊子取少量花粉置于干净载玻片上,滴1~2滴2%的I2-KI溶液,搅拌均匀,使花粉散开,盖上盖玻片,室温下静置后在显微镜下观察并分别统计有活力和无活力的花粉数。凡被染成蓝色的为含有淀粉的花粉,即活力较强的花粉;呈黄褐色的为发育不良的花粉,无色为无活力的花粉。每个个体的不同开花天数,镜检花粉粒数都超过500个。
1.3数据处理
每個个体不同开花天数,同种染色方法均统计花粉粒400个以上。采用Excel 2007和SPSS 19.0软件对相关数据进行统计分析。
2 结果与分析
2.1离体萌发法测定花粉萌发率
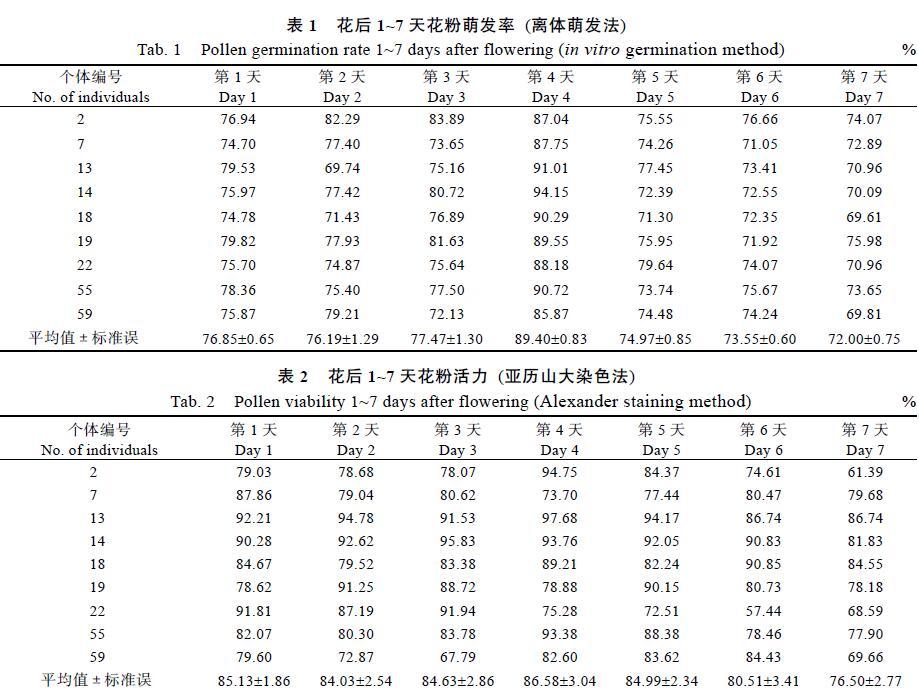
在杂交育种研究中,常涉及花粉活力的测定,而萌发法能直接反应父本的可育性。正常花粉成熟时有较强的活力,在适宜的培养条件下萌发出花粉管。依花粉管的长度≥花粉粒直径作为萌发标准,对其萌发情况进行统计,计算萌发率。培养2 h后,花粉的萌发沟处开始出现花粉管,8 h后花粉管开始生长变长(图1A)。
开花后1~7 d,离体培养萌发法测得的9个个体的萌发率为69.61%~94.15%,平均萌发率为72.00%~89.40%,所有个体的花粉活力都比较高。开花后第4天萌发率最高,达89.40%(表1)。随着开花时间的推移,花粉活力逐渐下降。
2.2亚历山大染色法测定花粉活力
亚历山大染色液可进行植物花粉活力鉴定,常用于细胞核染色,主要由孔雀绿、酸性品红、苯酚等组成,是较好的花粉粒染色剂。可育花粉的花粉壁被染成绿色,原生质被染成红色;而败育花粉不呈红色,被染成绿色(图1B)。通过统计花粉着色情况,计算其花粉活力。
开花后1~7 d,亚历山大染色法测得的9个个体的活力为57.44%~97.68%,平均活力为76.50%~86.58%,所有个体的花粉活力都较高。开花后第4天活力最强,高达86.58%(表2)。随着开花时间的推移,花粉活力逐渐下降。
2.3TTC染色法测定花粉活力
TTC是一种氧化还原染料,水溶液无色。当TTC渗入细胞后,遇到活细胞中的脱氢酶接受氢离子,由无色的氧化型变成红色的还原型不溶于水的化合物,以此来判断花粉的生活力。利用0.5%的TTC染液对花粉进行染色后,具有活力的花粉都被染成红色,而没有活力的花粉,无法着为红色(图1C)。
开花后1~7 d,TTC染色法测得的9个个体的活力在63.86%~90.64%之间, 平均活力为70.46%~88.50%,所有个体的花粉活力都较高。开花后第4天活力最强,高达88.50%(表3)。随着开花时间的推移,花粉活力逐渐下降。
2.4I2-KI染色法测定花粉活力
利用I2-KI溶液对花粉粒进行染色,有活力的花粉积累淀粉较多,被染成蓝色,无活力的花粉不含淀粉或积累的淀粉极少,呈黄褐色(图1D)。开花后1~7 d,I2-KI染色法测得的9个个体的活力为61.46%~91.33%, 平均活力为74.54%~ 87.00%,所有个体的花粉活力都较高。开花后第4天活力最强,高达87.00%(表4)。随着开花时间的推移,花粉活力逐渐下降。
2.5不同测定方法花粉活力的比较
开花后1~7 d,4种方法测定的花粉活力变化趋势基本一致(图2)。以离体萌发法为标准进行比较,发现亚历山大染色法的结果普遍高于离体萌发法(第4天除外),TTC染色法的结果低于离体萌发法,I2-KI染色法的结果略高于离体萌发法(第4天除外)。
亚历山大染色法与离体萌发法的结果差异极其显著(P<0.01)。TTC染色法和I2-KI染色法,与离体萌发法的结果差异不显著(P>0.01)(表5)。
说明:同列不同大写字母表示差异极显著(P<0.01)。
Note: Different uppercase letters in the same column indicate significant differences(P<0.01).
3 讨论
花粉活力的高低直接影响授粉实验的结果,因此在进行人工授粉前测定花粉活力是不可或缺的一步。有很多方法可以用于检测植物花粉的活力,不同方法有各自的适用范围,不同植物需要根据实际情况选择合适的花粉活力测定方法[24-29]。生物染色剂因为操作简单、耗时短、无需特别的外界辅助条件,能在短时间内测定花粉活力,因此挑选适合测定某种植物花粉活性的染料在杂交育种上具有非常重大的意义。
本研究表明,利用液体培养基,通过离体萌发法测定四川牡丹的花粉活力,需要为花粉萌发提供适宜的环境条件,如温度、pH、营养物质和矿质元素等,培养时间较长,步骤繁琐,实验过程复杂,不适合大量样本快速测定,不适合快速准确地测定花粉活力。TTC染色法需要将花粉和染色液在恒温条件下混合并保温一段时间,操作要求较高、TTC染液需要避光保存,1~7 d内TTC染色法获得的花粉活力都低于用离体培养法获得的萌发率,所以TTC染色法不适合快速准确地测定花粉活力。亚历山大染色法的染色效果好,染色时间短,容易辨别,但是除第四天外,其他时间的结果均高于离体萌发法的结果。而I2-KI染色法只需将花粉和染色液混合后置于室温条件下放置一段时间即可检测出花粉活力,是一种灵敏度高、经济、快速的花粉活力检测方法,尤其适合野外条件下花粉活力的检测,测定结果也最接近离体萌发法。可能是因为牡丹花粉中的淀粉含量较高,I2-KI较易渗透进花粉壁而使花粉粒染色。因此,综合考慮实验条件、实验周期、实验过程、实验结果和药品保存方法等因素,I2-KI染色法适合快速准确地测定四川牡丹的花粉活力。这为探讨四川牡丹濒危的原因、保护种质资源、开展引种驯化和杂交育种提供了理论依据。
参考文献
[1] 傅立国, 金鉴明. 中国植物红皮书——稀有濒危植物(第一册)[M]. 北京: 科学出版社, 1992: 530-564.
[2] 洪德元, 周世良, 何兴金, 等. 野生牡丹的生存状况和保护[J]. 生物多样性, 2017, 25 (7): 781–793.
[3] 中国牡丹全书编纂委员会. 中国牡丹全书[M]. 北京: 中国林业出版社, 1999: 1-71.
[4] Hong D Y, Pan K Y, Pei Y L. The identity ofPaeonia decompositaHand.-Mazz[J]. Taxon, 1996, 45(1): 67-69.
[5] Hong D Y. Notes onPaeonia decompositaHand.-Mazz[J]. Kew Bulletin, 1997, 52(4): 957-963.
[6] 洪德元, 潘开玉. 芍药属牡丹组的分类历史和分类处理[J]. 植物分类学报, 1999, 37(4): 351-368.
[7] 洪德元, 张志宪, 朱相云. 芍药属的研究(1)——国产几个野生种核型的报道[J]. 植物分类学报, 1988, 26(1): 33-43.
[8] Wang S Q, Zhang D M, Pan J. Chromosome inversion heterozygosity inPaeonia decomposita(Paeoniaceae)[J]. Caryologia, 2008, 61(2): 128-134.
[9] 王士泉, 张大明. 四川牡丹和块根芍药第五号染色体异常的减数分裂证据[J]. 植物分类学报, 2008, 46(2): 155-162.
[10] 馬 莘, 夏 颖, 马庆庆, 等. 四川牡丹群落物种生态位及空间关联度分析[J]. 重庆师范大学学报(自然科学版), 2011, 28(4): 57-61.
[11] 景新明, 郑光华, 裴颜龙, 等. 野生紫斑牡丹和四川牡丹种子萌发特性及与其致濒的关系[J]. 生物多样性, 1995, 3(2): 84-87.
[12] Jing X M, Zheng G H. The characteristiction seed germination and dormancy of four wild species of tree peonies and their bearing on endangerment[J]. Acta Phytophysiologica Sinica, 1999, 25(3): 214-221.
[13] 赵 宣, 周志钦, 林启冰, 等. 芍药属牡丹组(PaeoniaSect.Moutan)种间关系的分子证据:GPAT基因的PCR-RFLP和序列分析[J]. 植物分类学报, 2004, 42(3): 236-244.
[14] 林启冰, 周志钦, 赵 宣, 等. 基于Adh基因家族序列的牡丹组(Sect.MoutanDC.)种间关系[J]. 园艺学报, 2004, 31(5): 627-632.
[15] Zhao X, Zhou Z Q, Lin Q B,et al. Phylogenetic analysis of PaeoniaSect.Moutan(Paeoniaceae) based on multiple DNA fragments and morphological data[J]. Journal of Systematics and Evolution, 2008, 46(4): 563-572.
[16] Yu H P, Cheng F Y, Yuan Z,et al. Development of simple sequence repeat (SSR) markers fromPaeonia ostii to study the genetic relationships among tree peonies (Paeoniaceae)[J]. Scientia Horticulturae, 2013, 164: 58-64.
[17] Wang X W, Fan H M, Li Y Y, et al. Analysis of genetic relationships in tree peony of different colors using conserved DNA-derived polymorphism markers[J]. Scientia Horticulturae, 2014(175): 68-73.
[18] Yi W G, Law S E, Mccoy D,et al. Stigma development and receptivity in almond (Prunus dulcis)[J]. Annals of Botany, 2006, 97(1): 57-63.
[19] Twell D. Pollen developmental biology: Plant Reproduction. Annual Plant Reviews, Volume 6[M/OL]. Sheffield: Sheffield Academic Press, 2002: 86-153.
[20] 律春燕, 王 雁, 朱向涛, 等. 黄牡丹花粉生活力测定方法的比较研究[J]. 林业科学研究, 2010, 23(2): 272-277.
[21] Alexander M P. A versatile stain for pollen, fungi, yeast and bacteria[J]. Stain Technology, 1980, 55(1): 13-18.
[22] 张志良. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2000: 240-242.
[23] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[24] 王钦丽, 卢龙斗, 吴小琴, 等. 花粉的保存及其生活力测定[J]. 植物学通报, 2002, 19(3): 365-373.
[25] 刘林德, 张洪军, 祝 宁, 等. 刺五加花粉活力和柱头可授性的研究[J]. 植物研究, 2001, 21(3): 375-379, 483.
[26] Gelderen E V, Fossey A, Robbertse P J. The criteria of measurement of the inorganic acid test of pollen viability[J]. South African of Botany, 1994, 61(5): 253-259.
[27] Sato S, Katho N, Iwai S,et al. Establishment of reliable method of in vitropollen germination and pollen preservation ofBrassica rapa[J]. Euphytica, 1998, 103(1): 29-33.
[28] Roeckel P, Dumas C. Survival at 20 ℃ and cryopreservation of isolated sperm cells fromZea mayspollen grains[J]. Sex Plant Reprod, 1993, 6(3): 212-216.
[29] Mayer E, Gottsberger G. Pollen viability in the genusSilence(Caryophyllaceae) and its evaluation by means of different test procedures[J]. Flora, 2000, 195(4): 349-353.

