蛋白质介导硫化铜键合的介孔硅纳米载体的构筑及其用于癌症的光热和化疗协同治疗的研究
何若曦 王琦 李贝 贾晶 路雯婧 双少敏


摘 要 将牛血清白蛋白介导的硫化铜纳米复合物(BSA/CuS) 通过酰胺键修饰在负载了化疗药物阿霉素(DOX) 的介孔二氧化硅(MSN) 表面,制备了新型药物载体MSN-DOX@BSA/CuS。此复合物中BSA作为封闭剂,其二硫键与谷胱甘肽发生氧化还原反应后断裂,导致MSN孔隙暴露,使DOX从中释放;CuS作为光热试剂,可将光能转化为热能,具有光热治疗的作用。利用紫外-可见-近红外吸收光谱考察了其光吸收性质。结果表明,此药物载体在近红外区800~1100 nm范围内具有较强的吸收,可在近红外光照射下实现光热转换。另外,将未负载DOX的载体MSN@BSA/CuS与癌细胞孵育,此载体表现出低细胞毒性; 加入负载药物的MSN-DOX@BSA/CuS后,细胞的存活率降为49%;经过额外的激光照射后,细胞存活率仅为18%。以上结果表明,所合成的纳米药物载体可同时实现光热治疗与化疗的协同治疗,有效提高对癌症的治疗效率。
关键词 介孔二氧化硅; 牛血清白蛋白; 硫化铜; 光热治疗与化疗; 协同治疗
1 引 言
癌症是目前严重危害人类健康的疾病之一[1]。光热疗法利用光热材料将近红外光转化为热,实现对肿瘤细胞的热消融[2~4],是肿瘤治疗的有效方法之一, 具有非侵入、过程简单、正常组织损伤小等优点[5]。光热治疗中常用的光热纳米材料有聚合物纳米材料[6]、碳基纳米材料[7]及过渡金属硫化物纳米材料[8]等,上述材料在近红外区均有较强吸收,而且光学性质稳定。其中,硫化铜(CuS) 纳米粒子因其制备容易\,光热转换效率高\,细胞毒性低,成为一种新型光热试剂[9,10]。然而,单一光热治疗的治疗效率受限,因此,光热疗法与其它疗法(如光动力治疗[11,12]、化学动力治疗[13]和化疗[14,15]) 相结合的协同方法成为发展趋势[16],为高效治疗肿瘤提供了新策略。
近年来,光热疗法与化学疗法结合引起研究者的关注。文献报道将CuS纳米粒子与其它纳米材料(如介孔碳[17]、二氧化锰[18]、氧化石墨烯[19]、二氧化硅[20]等) 结合,构建了系列光热化疗协同治疗的复合纳米体系。这些复合纳米体系均利用肿瘤微环境和正常生理环境下某些性质(如pH值[21]、温度[22]、还原电位[23]等) 的差異,使药物在到达肿瘤组织时实现响应性释放。
高含量的谷胱甘肽是肿瘤微环境的特征表现之一。谷胱甘肽(GSH) 是人体中含量最丰富的还原性物质,肿瘤细胞内GSH水平(约2~10 mmol/L) 明显高于细胞外基质中GSH水平(约2~10 μmol/L) ,且肿瘤细胞中GSH的浓度明显高于正常细胞 [24,25]。二硫键作为常见的氧化还原敏感基团, 在GSH的存在下易裂解,使其成为设计氧化还原响应药物递送系统的最佳反应位点[26]。富含天然二硫键以及氨基和羧基的血清白蛋白是存在于生物体血清中的一种球状蛋白,它不仅可与其它载体材料结合构建氧化还原响应的新型药物载体,还可通过生物矿化,为CuS的形成提供生长平台。
本研究以牛血清白蛋白(BSA) 为模板,CuS为光热治疗核心纳米粒子,通过生物矿化形成纳米复合物(BSA/CuS) 。借助BSA将其共价键合在负载了化疗药物阿霉素(DOX) 的介孔二氧化硅(MSN) 载体表面,得到纳米复合材料MSN-DOX@BSA/CuS。BSA作为门控与肿瘤微环境中过表达的GSH发生氧化还原反应,导致二硫键打开,MSN孔隙暴露,从而快速释放化疗药物。同时,在激光照射下, 该复合材料中的CuS可将光能转化为热能,有效杀死癌细胞,实现癌症的化疗和光热协同治疗,提高治疗效果。
2 实验部分
2.1 仪器与试剂
JEM-2100型透射电子显微镜(日本JEOL公司) ; TriStar II 3020比表面与孔隙度分析仪(美国麦克默耐瑞提克公司) ; Bruker Tensor II傅里叶红外光谱仪(德国Bremen公司) ; AXIS ULTRA DLD 型 X-射线光电子能谱仪(英国Kratos公司) ; U-2910紫外可见分光光度计(日本日立公司) ; Lambda 950紫外-可见-近红外分光光度计(美国珀金埃尔默公司) ; Zetasizer Nano ZS90仪器(英国Malvern公司) ; ZD-85A型气浴恒温振荡器(常州恒隆仪器有限公司) ; 真空干燥箱(上海一恒科技仪器有限公司) ; 冷冻干燥机(宁波新芝生物科技股份有限公司) ; SZCL-3A型磁力电热套搅拌器(杭州瑞佳仪器有限公司) ; FE20酸度计(上海梅特勒-托利多仪器有限公司) ; LR-MFJ-980激光器(长春镭锐光电科技有限公司) ; Infinite 200 PRO酶标仪(瑞士Tecan公司) 正硅酸乙酯(纯度>99%) 、十六烷基三甲基溴化铵(纯度>99%) 、牛血清白蛋白(纯度99%) 、N-羟基琥珀酰亚胺(NHS,纯度98%) 和1-乙基-3-(3-二甲氨基丙基) 碳二亚胺(EDC,纯度98%) 均购于阿拉丁试剂公司; Cu(NO3) 2(分析纯,北京化工厂) ; Na2S·9H2O(分析纯,天津市天力化学试剂有限公司) ; 3-氨基丙基三乙氧基硅烷(APTES, 纯度98%) 和盐酸阿霉素(纯度98%) 购自上海麦克林生化科技有限公司; 实验用水为二次蒸馏水(18.2 MΩ·cm,Milli-Q纯水仪(美国Millipore公司) 制备) 。
2.2 MSN的合成
根据文献[27]的方法合成MSN。准确称取0.5000 g十六烷基三甲基溴化铵和1.5 mL NaOH(2 mol/L) 溶于240 mL水中,加热至80℃后,加入2.5 mL 正硅酸乙酯并搅拌2 h。将得到的白色沉淀离心后,用乙醇洗涤2次,于140 mL乙醇和6 mL浓HCl中回流36 h。将制得的MSN真空干燥。
2.3 MSN-NH2的合成
准确称取0.2000 g MSN分散于80 mL甲醇中,加入1.2 mL APTES, 在85℃油浴中回流12 h。反应完成后,用无水乙醇洗涤3次,于干燥箱中干燥。
2.4 BSA/CuS的合成
按照文献[10]方法并稍作改进。将Cu(NO3)2溶液(20 mmol/L,2 mL) 和BSA溶液(40 mg/mL,18 mL) 于单口烧瓶中混合,溶液出现浅绿色混浊。然后,用NaOH溶液(2 mol/L) 将混合物调至碱性(pH 12) ,此时混合物颜色变为深紫色。 加入1 mL Na2S·9H2O(100 mmol/L) ,溶液变为深棕色,在55℃油浴4 h。反应完成后,将溶液用二次蒸馏水透析(MWCO=300 kD) 24 h,除去过量的Cu2+。冷冻干燥,获得粉末状BSA/CuS。
2.5 MSN@BSA/CuS的合成
将80 mg EDC、60 mg NHS和80 mg BSA溶于40 mL 0.05 mol/L磷酸盐缓冲液(PBS,pH 6.3) 中,在室温下搅拌20 min,以活化BSA的羧基。随后向上述溶液中缓慢加入40 mg MSN-NH2,反应24 h。最终产物用水洗涤数次,室温下真空干燥12 h,研磨后,得到白色蓬松粉末。
2.6 DOX标准曲线和载药实验
配制濃度为1、2、5、10、20、30和40 μg/mL的DOX溶液,分别测试不同浓度DOX溶液在480 nm处的吸光度,将吸光度与DOX浓度进行线性拟合,得到测定DOX浓度的标准曲线。
称取15.0 mg干燥的MSN-NH2分散于8 mL 0.5 mg/mL DOX/PBS 缓冲溶液(pH 7.4) 中,室温避光搅拌24 h得到MSN-DOX。并将BSA/CuS按照2.5节的方法修饰于MSN-DOX表面,得到纳米载体MSN-DOX@BSA/CuS。用PBS缓冲溶液(pH 7.4) 充分洗涤,以除去未负载的药物,直至上清液变为无色。将收集的上清液定容后,稀释1倍,根据其在480 nm处的UV-Vis吸收和DOX标准曲线测定DOX加载量。根据公式(1) 计算载药率(Drug loading rate,L,%) :
L(%) =(m1-m2) /m×100% (1)
其中, m1为投入药物的质量, m2为上清液中药物的质量,m为载药的载体质量。DOX标准曲线回归方程y=0.0157x+0.0036,其中,y为吸光度值,x为DOX浓度(μg/mL) 。
2.7 药物释放实验
准确称取3.0 mg MSN-DOX@BSA/CuS分散在不同pH值(7.4、5.3) 和不同浓度GSH(0和10 mmol/L) 的PBS(10 mL) 中,并将其置于气浴恒温振荡器(37℃) 中振荡反应。 在预定的时间间隔取出2 mL释放介质,并加入等体积的新鲜培养液。通过监测 DOX的紫外-可见吸收光谱值, 绘制DOX释放曲线。
2.8 MSN@BSA/CuS纳米载体的光热转换测定
将1 mL不同浓度的MSN@BSA/CuS纳米颗粒悬浊液(0、2、4和6 mg/mL) 分别加入石英池中,使用激光持续照射(980 nm,1 W/cm2,6 min) ,每隔1 min记录溶液温度,绘制材料的升温曲线。为了测量光热转换效率(η) ,将MSN@BSA/CuS的水溶液在980 nm(1 W/cm2) 激光下照射600 s,然后关闭激光光源,使溶液自然冷却,记录温度变化与时间的关系。η值通过公式(2) 计算:
η=hS(Tmax-Tsurr) -QsI(1-10
A980) (2)
其中,h为热传递系数,S为辐射传热表面积。Tmax和Tsurr分别为系统最高温度和周围环境温度,Qs为溶剂吸收的热量,I为激光功率,A980为MSN@BSA/CuS在980 nm处的吸光度。 hS的值根据公式(3) 得出:
hS=mDCDτs(3)
mD和CD表示溶剂的质量和比热容(4.2 J/(g·℃) ) ,τs为系统时间常数。为了得到hS值,进一步引入θ,其计算公式如(4) :
θ=Tsurr-TTsurr-Tmax(4)
其中, θ是无量纲的驱动温度常数,T为溶液温度。因此, τs可以通过线性拟合冷却时间对驱动温度常数的自然对数的负值得到。
2.9 细胞毒性实验
将Hela细胞悬液以8000个/孔的密度接种到96孔板中,每孔加入100 μL培养基,在37℃、5% CO2条件下培养24 h后,弃去培养液,向孔中加入含不同浓度MSN、MSN@BSA/CuS、DOX或MSN-DOX@BSA/CuS的新鲜培养基。另设置MSN-DOX@BSA/CuS组,与癌细胞共孵育4 h后,给予980 nm近红外激光照射(1 W/cm2) 5 min,再孵育24 h。用含MTT新鲜培养基替换所有药孔中培养基,培养2 h,弃去上清液,加入DMSO轻摇,用酶标仪测量570 nm处吸光度。
3 结果与讨论
3.1 MSN-DOX@BSA/CuS的制备
根据Stber法制备MSN纳米粒子。采用APTES与表面SiOH基团之间的偶联反应,在MSN上修饰氨基。将DOX作为模型药物,通过氢键作用负载到氨基MSN的孔中。利用BSA的羧基与MSN-NH2的氨基之间的酰胺化反应合成MSN-DOX@BSA/CuS(图1) 。
3.2 纳米复合材料的表征
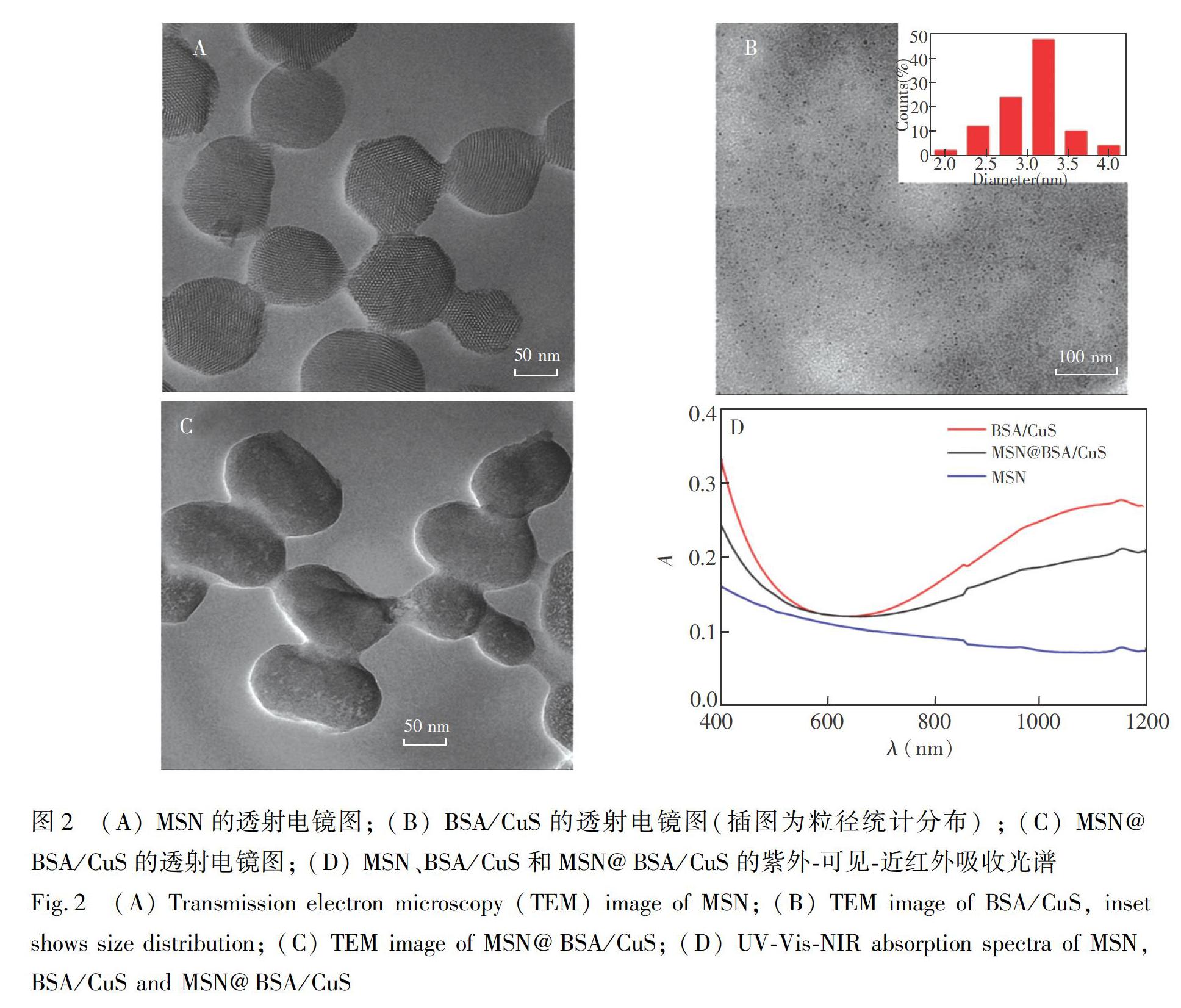
采用透射电镜(TEM) 表征所制备的纳米复合材料的形貌和尺寸。由图2可见,MSN的形状近似球形或椭圆形,粒径约为100 nm,并且具有明显的有序孔道(图2A) ; BSA/CuS 纳米粒子是单分散的,粒径约为2 nm(图2B) ; 修饰BSA/CuS后,由于MSN表面接枝了聚合物,孔道被封堵,表明BSA/CuS成功修饰在MSN表面(图2C) ;MSN、BSA/CuS和MSN@BSA/CuS的可见-近红外吸收光谱见图2D,MSN在近红外区几乎无吸收,BSA/CuS在可见区到近红外区800~1100 nm范围内有较强的吸收。MSN修饰BSA/CuS后,在相同波长范围内也有吸收,表明纳米材料MSN@BSA/CuS具有潜在的光热转化能力。
为了进一步确定BSA/CuS成功修饰在MSN表面以及MSN@BSA/CuS的元素组成,测定了MSN(图3A) 和MSN@BSA/CuS(图3D) 的X射线光电子能谱(XPS) 。在MSN高分辨率谱图中,在结合能为103 eV和532 eV出现了Si 2p峰(图3B) 和O 1s峰(图3C) 。与MSN相比,MSN@BSA/CuS出现了Cu 2p峰和N 1s峰。N 1s在400 eV出现峰值(图3E) ,证明了BSA存在。如图3F所示,Cu 2p3/2和Cu 2p1/2对应的932.7 eV和952.5 eV两个峰与Cu2+在CuS中的结合能基本相同,表明BSA/CuS成功修饰在MSN表面。
由氮气吸附/脱附曲线(图4A) 和孔径分布图(图4B)可见,MSN有较大的比表面积和孔体积,分别为1143 m2/g和1.25 cm3/g,孔径约为3 nm。修饰BSA/CuS后,MSN@BSA/CuS的比表面积和孔体积分别降至62 m2/g和0.13 cm3/g,且孔径也减小,表明MSN有较强的药物装载能力,且BSA/CuS有效封堵了MSN的孔道。图4C为MSN、BSA/CuS及MSN@BSA/CuS的Zeta电位分析结果,MSN的Zeta电位为19.9 mV,说明在其表面存在大量OH基团。进行氨基化修饰后电位由負变为10.7 mV,表明NH2基团成功修饰在MSN表面。测得BSA/CuS的电位为27.7 mV,在MSN-NH2上修饰BSA/CuS后,电位由正值变为22.6 mV,证明了BSA/CuS纳米复合物在MSN-NH2纳米载体上的有效连接。红外光谱(图4D) 表明,MSN和MSN@BSA/CuS在1080、960和797 cm1处均有吸收,分别为SiOSi不对称伸缩振动、MSN表面羟基的弯曲振动和SiO对称伸缩振动。此外,BSA/CuS与MSN@BSA/CuS在1658和1540 cm1处有相同的特征吸收峰,分别归属于酰胺键中CO的伸缩振动和NH的面内弯曲振动,表明BSA/CuS成功连接在MSN表面。
3.3 MSN@BSA/CuS的光热转换性能
以波长980 nm(1 W/cm2) 的激光为光源,考察了不同浓度MSN@BSA/CuS悬浊液的温度随照射时间的变化(图5A) 。在6 min持续照射后,对照组水的温度仅上升了3℃。随着MSN@BSA/CuS浓度增加,溶液温度也不断上升。当纳米载体浓度为6 mg/mL时,温度升高了19℃。为了进一步证明MSN@BSA/CuS的光热效应,评估了其光热转化效率。根据获得的数据(图5B~5D) ,MSN@BSA/CuS的光热转换效率η达到41.8%,表明此载体具有较好的光热转换性能,可进一步用于肿瘤的光热治疗。
ln(θ) (τs=249.11 s)
3.4 DOX负载量的计算
通过测定DOX标准曲线(图6A和6B) 和收集的上清液在480 nm处的紫外吸收光谱(图6C) ,计算出MSN上DOX的负载效率为10.68%。
3.5 体外释放行为分析
MSN表面修饰的BSA/CuS作为堵孔试剂可防止药物在进入癌细胞前发生泄漏,当载药体系进入细胞后,细胞内过量的谷胱甘肽与BSA发生氧化还原反应并打开其二硫键,使MSN孔隙暴露,从而实现药物释放。从体外药物释放曲线(图7) 可知,在未加入GSH的pH 7.4和pH 5.3的PBS溶液中,药物释放量仅为20%和8.6%。相比之下,当GSH浓度为10 mmol/L时,pH 7.4的PBS溶液药物释放量上升为27%,而pH 5.3的PBS溶液表现出更快更高的药物释放,达到了56%。体外药物释放实验结果表明,BSA/CuS能有效将药物包封在MSN中,避免药物在癌细胞内过早释放。同时,纳米复合物MSN-DOX@BSA/CuS还具有氧化还原响应释放的性质。
3.6 光热与化疗协同治疗肿瘤
通过MTT实验探究了载体的细胞毒性和光热与化疗协同治疗肿瘤的效果。由图8A可见,未载药的纳米载体MSN和MSN@BSA/CuS细胞存活率均高于80%,细胞毒性较小。图8B为不同载药体系对Hela细胞的化疗-热疗协同杀伤效果。单独使用MSN-DOX@BSA/CuS化疗的细胞毒性低于游离的DOX和MSN-DOX,说明BSA/CuS有效封堵MSN孔道,对DOX起缓释作用; MSN-DOX@BSA/CuS进入细胞后,无近红外光照射时,Hela细胞的存活率为49%; 当施加激光照射时,纳米粒子的光热效果导致局部温度过高,Hela细胞的存活率下降至18%,这是因为光照产生的热量会增加细胞膜通透性,进而增强化疗药物和纳米载体的转移。因此,此纳米粒子能够较好地将化疗与光热治疗相结合,对癌细胞进行更有效的协同治疗。
4 结 论
通过酰胺键将牛血清白蛋白介导的硫化铜键合在介孔二氧化硅上,构建了MSN@BSA/CuS载体。此载体具有易于制备、低细胞毒性和良好的光热转换性能等优点。当载入化疗药物DOX后,纳米复合物MSN-DOX@BSA/CuS在肿瘤微环境中GSH的存在下,通过氧化还原响应特性释放出抗癌药物。同时,复合纳米载体可以在激光照射下将光能转化为热能, 杀死癌细胞。与单一化疗效果相比,光热治疗可以增加癌细胞膜的通透性,有助于化疗药物能够更快更多地进入癌细胞, 发挥药效,从而表现出更高的细胞杀伤效率。此智能纳米载体可实现光热-化疗的协同治疗,提高治疗效果,为癌症的精准有效治疗提供了新思路。
References
1 Feng L L, Xie R, Wang C Q, Gai S L, He F, Yang D, Yang P P, Lin J. ACS Nano, 2018, 12(11): 11000-11012
2 Chen C, Tang W, Jiang D W, Yang G L, Wang X L, Zhou L N, Zhang W A, Wang P. Nanoscale,2019,11(22): 11012-11024
3 Li J, Zhang C T, Gong S M, Li X C, Yu M Y, Qian C G, Qiao H Z, Sun M J. Acta Biomater.,2019,94: 435-446
4 Girma W M, Dehvari K, Ling Y C, Chang J Y. Mater. Sci. Eng. C,2019,101: 179-189
5 Cai C, Li X, Wang Y, Liu M X, Shi X Y, Xia J D, Shen M W. Chem. Eng. J.,2019,362: 842-850
6 Rahoui N, Jiang B, Hegazy M, Taloub N, Wang Y L, Yu M, Huang Y D. Colloids Surf. B,2018,171: 176-185
7 Su T, Cheng F R, Yan J Q, Cao J, Luo K, Pu Y J, He B. J. Mater. Chem. B,2018,6(28): 4687-4696
8 Zheng Y Y, Liang Y Q, Zhang D P, Zhou Z J, Li J, Sun X Y, Liu Y N. Chem. Commun.,2018,54(98): 13805-13808
9 Liu X M, Yang T S, Han Y F, Zou L, Yang H R, Jiang J Y, Liu S J, Zhao Q, Huang W. ACS Appl. Mater. Interfaces,2018,10(37):31008-31018
10 Yang W T, Guo W S, Le W J, Lv G X, Zhang F H, Shi L, Wang X L, Wang J, Wang S, Chang J, Zhang B B. ACS Nano,2016,10(11): 10245-10257
11 Yang Y, Wang C, Tian C, Guo H L, Shen Y H, Zhu M Z. J. Mater. Chem. B,2018,6(42): 6848-6857
12 Goel S, Ferreira C A, Chen F, Ellison P A, Siamof C M, Barnhart T E, Cai W B. Adv. Mater.,2018,30(6): 1704367
13 Liu P, Wang Y R, An L, Tian Q W, Lin J M, Yang S P. ACS Appl. Mater. Interfaces,2018,10(45): 38833-38844
14 Wang Y Y, Liu X J, Deng G Y, Sun J, Yuan H K, Li Q, Wang Q G, Lu J. Nanoscale,2018,10(6): 2866-2875
15 Peng S W, He Y Y, Er M, Sheng Y Z, Gu Y Q, Chen H Y. Biomater. Sci.,2017,5(3): 475-484
16 Fan W P, Yung B, Huang P, Chen X Y. Chem. Rev.,2017,117(22): 13566-13638
17 Zhang L, Li Y C, Jin Z X, Chan K M, Yu J C. RSC Adv.,2015,5(113): 93226-93233
18 Lin X D, Fang Y, Tao Z H, Gao X, Wang T L, Zhao M Y, Wang S, Liu Y Q. ACS Appl. Mater. Interfaces,2019,11(28): 25043-25053
19 Xu Z Q, Wu S C, Huang G C, Ding H W, Gui R J, Zhu B H. Mater. Lett.,2017,195: 131-135
20 Liu X J, Ren Q L, Fu F F, Zou R J, Wang Q, Xin G B, Xiao Z Y, Huang X J, Liu Q, Hu J Q. Dalton Trans.,2015,44(22): 10343-10351
21 Cheng W, Nie J P, Xu L, Liang C Y, Peng Y M, Liu G, Wang T, Mei L, Huang L Q, Zeng X W. ACS Appl. Mater. Interfaces,2017,9(22): 18462-18473
22 Shen B B, Ma Y, Yu S Y, Ji C H. ACS Appl. Mater. Interfaces,2016,8(37): 24502-24508
23 Lin L S, Song J B, Song L, Ke K M, Liu Y J, Zhou Z J, Shen Z Y, Li J, Yang Z, Tang W, Niu G, Yang H H, Chen X Y. Angew. Chem. Int. Ed.,2018,57(18): 4902-4906
24 Gao Y, Zhong S L, Xu L F, He S H, Dou Y M, Zhao S N, Chen P, Cui X J. Micropor. Mesopor Mater.,2019,278:130-137
25 Zhang Y B, Li Y, Tian H N, Zhu Q X, Wang F F, Fan Z X, Zhou S, Wang X W, Xie L Y, Hou Z Q. Mol. Pharmaceut.,2019,16(7): 3133-3144
26 Song Y H, Li Y H, Xu Q E, Liu Z. Int. J. Nanomed.,2017,12: 87-110
27 Paris J L, Cabaas M V, Manzano M, Vallet-Regí M. ACS Nano,2015,9(11): 11023-11033
Construction of Protein-mediated Copper Sulfide Bonded Mesoporous
Silica Nanoparticles Vector for Chemo-photothermal
Synergistic Therapy of Cancer
HE Ruo-Xi, WANG Qi, LI Bei, JIA Jing, LU Wen-Jing, SHUANG Shao-Min*
(School of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China)
Abstract Bovine serum albumin-mediated copper sulfide nanocomplex (BSA/CuS)was modified on mesoporous silica (MSN)loaded with chemotherapeutic drug doxorubicin (DOX) by amide bond to prepare a new drug carrier, MSN-DOX@BSA/CuS. The disulfide bond of blocking agent BSA would break down after redox reaction with glutathione, resulting in MSN pore exposure and release of DOX. CuS, as a photothermal reagent, could convert light energy into heat for photothermal therapy. UV-Vis-NIR absorption spectra were used to investigate the absorption properties of the carrier. The results showed that the carrier had strong absorption in the range of 800-1100 nm and could realize the photothermal conversion under the near infrared light. In addition, MSN@BSA/CuS was incubated with cancer cells and showed no cytotoxicity. When MSN-DOX@BSA/CuS was added, the relative survival rate of the cells decreased to 49%. After the extra laser, the cell viability was only 18%. The above results showed that the synthesized nano drug carrier could realize the synergistic treatment of photothermal therapy and chemotherapy at the same time, and effectively improved the treatment efficiency of cancer.
Keywords Mesoporous silica nanoparticles;Bovine serum albumin;Copper sulfide;Chemotherapy and photothermal therapy;Synergistic therapy
(Received 19 October 2019;accepted 21 November 2019)
This work was supported by the National Natural Science Foundation of China (No. 21874087) .

