神经阻滞联合干扰素α治疗原发性三叉神经痛临床疗效观察
高嘉男 薛朝霞
(1山西医科大学麻醉学系,太原030001;2山西医科大学第一医院疼痛科,太原030001)
原发性三叉神经痛(idiopathic trigeminal neuralgia, ITN)是三叉神经分布区域发生的间断性剧烈疼痛,一般以老年人和女性多发[1,2],青少年发病率较低[3],多为单侧面部疼痛,偶尔双侧同时发病[4]。发病时病人往往疼痛难忍,是临床常见的疼痛性疾病之一。
目前ITN的主要治疗方法分为药物治疗、手术治疗和微创介入治疗等[5,6]。由于药物治疗不良反应多且老年病人对药物不良反应敏感[7],所以在药物难以控制病情或不耐药时多用手术方式治疗ITN。在考虑到病人年龄因素和医疗条件、受影响的三叉神经分支、疾病和疼痛的持续时间、对先前治疗的反应以及病人的偏好和从业者的经验等因素后,应当结合病人情况仔细考虑ITN的治疗方案。因为手术治疗花费较高、部分手术方式术后面部麻木发生率高,且可能出现一侧听力永久性损害[5],病人从生理和心理上都不易接受。因此神经阻滞是ITN药物控制不佳时常用的治疗方法,并且可将其当作手术治疗前的主要镇痛手段[8]。目前神经阻滞治疗用药多使用局麻药品与一种激素搭配使用。IFN-α是机体受到病毒感染时由免疫细胞产生的一类低分子糖蛋白,在人体免疫系统中起着十分重要的作用。目前临床使用的IFN-α为基因工程制备的临床用药之一。为了使神经阻滞达到更好的临床治疗效果,本研究通过将IFN-α加入神经阻滞药物配伍中治疗三叉神经痛,以期得到更好的病人反馈。IFN-α在治疗三叉神经痛方面的应用是本项临床治疗观察的创新之处。
方 法
1.一般资料
本研究在治疗前均与病人沟通治疗方式,取得病人同意后方进行治疗,并签署知情同意书。经山西医科大学第一医院伦理委员会审批,共收集2017年3月至2018年3月我科收治的ITN病人40例,使用随机数字表法分为实验组(A组)和对照组(B组),每组各20例;实验组使用药物为0.5%利多卡因3 ml + 甲强龙40 mg + IFN-α 150国际单位(U),对照组使用药物为0.5%利多卡因3 ml + 甲强龙40 mg。实验组病人年龄为30~80岁,平均年龄为54.4岁,男性8例、女性12例,实验组治疗部位为三叉神经第II支的病人5例、第III支8例、第II, III支7例;对照组病人年龄为40~72岁,平均年龄为54.2岁,男性9例、女性11例,治疗部位为三叉神经第II支7例、第III支7例、第II, III支6例。所有病人均为口服药物治疗效果不佳,且无其他重要脏器疾病和精神障碍,可以耐受该项治疗,进行治疗前签署知情同意书。两组病人年龄、性别、治疗部位之间差异无统计学意义(P> 0.05,见表1)。
2.治疗方法
治疗前明确病人疼痛部位所属分支,三叉神经II, III支病变病人经下颌骨髁突冠突间切迹穿刺神经阻滞临床效果良好[9],其中II支穿刺至翼腭窝区域,III支穿刺至翼突外板后侧。病人取卧位患侧朝上,确定颧弓中点和下颌切迹中点。要求病人微张口,在两中点之间作一连线,取连线下1/3确定为穿刺点。常规消毒铺巾,在穿刺点皮内和皮下注射1%利多卡因1.5~2 ml。再将穿刺针退至皮下,调整穿刺针角度对准瞳孔方向进针。穿刺过程中如果病人无放电样反应,可用针尖向左右作扇形寻找直至颧骨以下、上唇或鼻翼出现异感,且无其它不适,此为三叉神经第II支。相同穿刺点垂直进针3.5~5 cm可触及翼突外板,做距离深度标记后,退针至皮下,再向外耳道方向或外后方重新进针达标记处,使针尖滑过翼突外板,可出现下颌或舌部电击样异感,此为三叉神经第III支。回抽无血,注射药物退针后按压穿刺部位数分钟。实验组采用0.5%利多卡因3 ml + 甲强龙40 mg + IFN-α 150国际单位(U),对照组使用0.5%利多卡因3 ml + 甲强龙40 mg,药液总量为3 ml。若II, III支病变则分别在相应部位行神经阻滞,每个分支药物注射3 ml,以穿刺时寻找到患支神经电击样异感为佳。每隔5天时间治疗1次,3次治疗为一个疗程。治疗结束后观察病人治疗情况,跟踪随访6个月记录相关指标。
3.观察指标
使用视觉模拟评分法(visual analogue scale,VAS)评估记录治疗前后疼痛评分,0分为无痛,1~4分为轻度疼痛,5~6分为中度疼痛,7~9分为重度疼痛,10分为剧烈疼痛;根据VAS评估治疗效果,VAS下降< 50%被认定为无效;VAS下降≥50%认定为有效;VAS下降≥75%认定为显效;有效率计算方法为:(显效+有效)/病人例数×100%。使用匹兹堡睡眠质量指数(pittsburgh sleep quality index, PSQI)评分评价病人治疗前后的睡眠状况,总分范围为0~21,得分越高,表示睡眠质量越差。

表1 两组病人一般资料比较(n = 20)Table 1 Comparison of general information between two groups of patients (n = 20)
4.统计学分析
采用Excel进行数据录入,SPSS 22.0统计软件进行统计学分析。计量资料服从正态分布采用均数±标准差()表示,两组间差异性比较采用t检验;计数资料用率表示,组间比较采用卡方检验。治疗前后VAS及PSQI评分以均数±标准差表示,两组治疗前后VAS、PSQI评分比较采用重复测量资料的方差分析。检验水准α = 0.05。P<0.05为差异有统计学意义。
结 果
1.治疗前后VAS对比
由表2重复测量分析结果显示,两组间VAS有差异(F= 2527.733,P< 0.001),说明两组VAS不同,实验组的VAS低于对照组;不同时间点VAS有差异(F= 213.967,P< 0.001),治疗后1个月、6个月的VAS低于治疗前;交互作用有统计学差异(F= 4.892,P< 0.01,见表2),两组病人的VAS下降不同,实验组低于对照组。
实验组和对照组不同时间点VAS有显著差异(F值分别为975.21和1 630.70,均为P< 0.001,见表3)。治疗前,两组病人VAS比较差异无统计学意义,治疗后1个月、治疗后6个月两组病人VAS存在显著性差异(均为P< 0.01),均为实验组低于对照组。
2.治疗前后PSQI评分对比
由表4重复测量分析结果显示,两组间PSQI评分有差异(F= 3 231.401,P< 0.01),实验组的PSQI评分低于对照组;不同时间点PSQI评分有差异(F= 364.938,P< 0.01),治疗后1个月、6个月的PSQI评分低于治疗前;交互作用有统计学差异(F= 13.538,P< 0.01),两组病人的PSQI评分下降不同,实验组低于对照组。
实验组和对照组不同时间点PSQI评分有显著差异(F值分别为1491.83和1744.87,均为P< 0.01,见表5)。实验组的PSQI评分低于对照组。治疗前,两组病人VAS比较差异无统计学意义,治疗后1个月、治疗后6个月两组病人PSQI评分存在显著性差异(均为P< 0.01,见图1),均为实验组低于对照组。
3.两组病人治疗效果的比较
跟踪随访1个月后,Fisher确切概率检验结果显示,实验组的有效率为70%,对照组为35%,两组治疗的有效率之间差异无统计学意义(见表6),尚不能认为两组治疗的有效率不同。

图1 两组不同时间PSQI评分()Fig.1 Two groups of PSQI score at different times ()

表2 两组病人VAS分析Table 2 Repeated measure variance analysis of VAS between two groups
跟踪随访6个月后,卡方检验结果显示,实验组的有效率为90%,对照组为75%,两组治疗的有效率之间有显著性差异(P< 0.05,见表7),可以认为实验组治疗的有效率高于对照组。
讨 论
目前ITN具体的分子生物学发病机制尚未研究清楚,一般认为是三叉神经纤维受“微血管压迫”的脱髓鞘病变导致[10]。目前临床首选口服药物卡马西平治疗,但口服药物的不良反应与接下来进行的手术治疗的创伤和术后并发症是临床医师与病人都必须考虑的问题。在这之间还有神经阻滞这一微创治疗手段可供选用,对于药物治疗无效或者药物不良反应较为严重的病人,通过神经阻滞治疗三叉神经痛已经被临床证实是一种安全、微创、可重复的治疗手段[11,12]。治疗后病人颜面部麻木、听力损伤等并发症发生率低,病人花费较少,治疗过程简便,易于被病人接受。并且三叉神经痛手术治疗操作复杂,对医师专业技能要求高,在基层医院不易推广。而三叉神经周围支神经阻滞方法较为简单,易于学习,方便推广。
表3 两组病人VAS比较(n = 20,)Table 3 Comparison of VAS scores between two groups of patients (n = 20,)
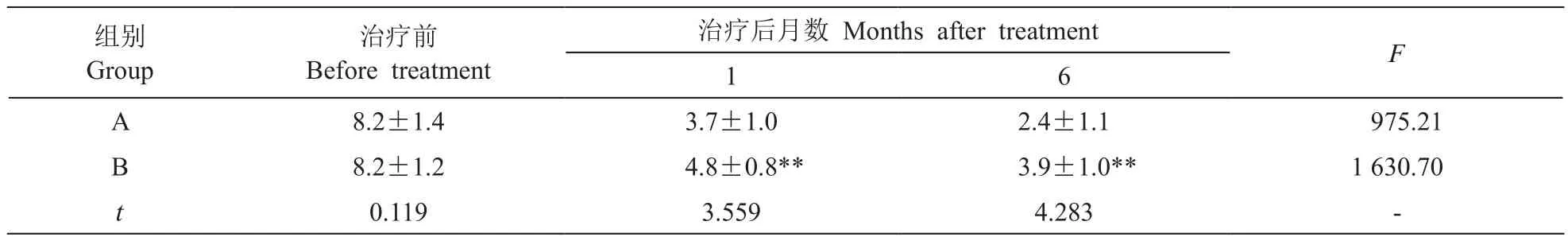
表3 两组病人VAS比较(n = 20,)Table 3 Comparison of VAS scores between two groups of patients (n = 20,)
**P < 0.01,与A组相比,compared with A group.
组别Group 8.2±1.4 3.7±1.0 2.4±1.1 975.21 B 8.2±1.2 4.8±0.8** 3.9±1.0** 1 630.70 t 0.119 3.559 4.283 -A治疗前Before treatment治疗后月数 Months after treatment F 1 6
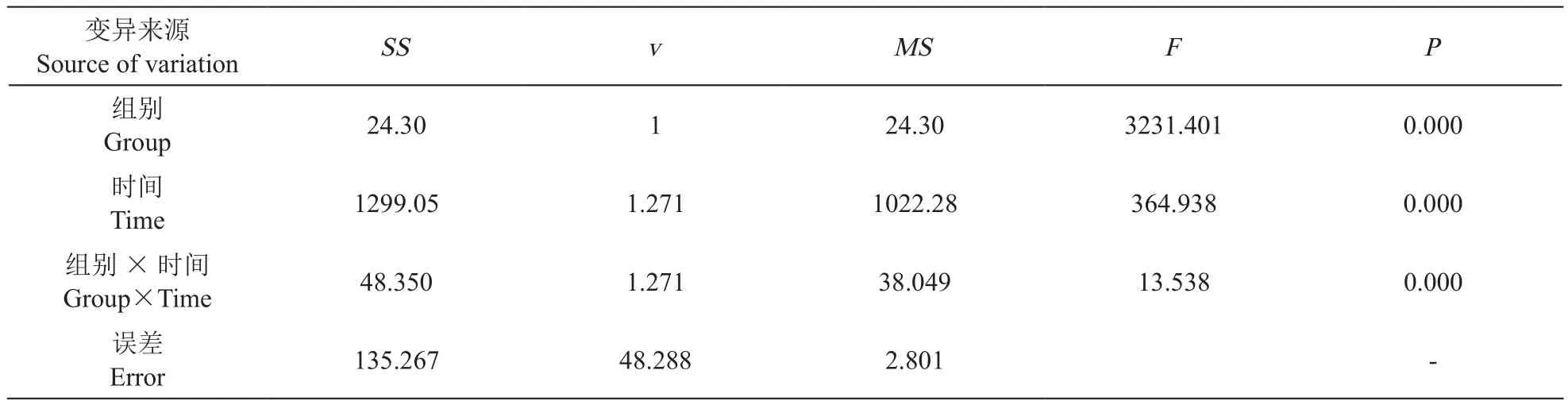
表4 两组病人PSQI分析Table 4 Repeated measure variance analysis of PSQI between two groups
表5 两组病人PSQI比较 (n = 20,)Table 5 Comparison of PSQI between two groups of patients (n = 20,)

表5 两组病人PSQI比较 (n = 20,)Table 5 Comparison of PSQI between two groups of patients (n = 20,)
**P < 0.01,与A组相比,compared with A group.
组别Group 16.8±2.4 9.5±1.3 8.0±1.3 1491.83 B 16.0±1.9 11.8±1.7** 9.2±1.2** 1744.87 t 1.152 4.672 3.052 -治疗前Before treatment治疗后月数 Months after treatment F 1 6 A

表6 随访1个月两组病人的疗效比较(n = 20)Table 6 Comparison of two groups of patients during one month follow-up (n = 20)

表7 随访6个月两组病人的疗效比较(n = 20)Table 7 Comparison of two groups of patients during six month follow-up (n = 20)
IFN-α是一类由机体免疫细胞、神经胶质细胞及神经元细胞等合成分泌的细胞因子,目前临床主要用于抗病毒、抗肿瘤和免疫调节[13]等方面。IFN-α被选为本次实验用药是因其本身是一种具有镇痛作用的神经递质[14,15]。Blalock 等[16]研究发现 IFN-α与脑啡肽在结构和功能上有很大的相似性,且IFN-α蛋白结构中存在独立的免疫调节与镇痛功能位点。Adams等[17]在小鼠研究中发现IFN-α具有镇痛作用,但是机制并不明确。后来Jiang和Wang[18,19]等的研究证实了IFN-α的镇痛作用与阿片受体有关。Lee等[20]报道,IFN-α与β-内啡肽可竞争性作用于μ受体,产生协同镇痛效应;IFN-α的镇痛作用可被特异性μ受体拮抗剂所完全阻断,而δ阿片受体拮抗剂与κ阿片受体拮抗剂不能阻断IFN-α的镇痛作用。目前来看IFN-α作为重要的神经递质作用于μ受体产生镇痛作用已经明确。作者分析IFN-α还可能通过对神经因子、细胞因子的调节作用对ITN起作用。Liu等[21]的研究证实IFN-α是一种内源性疼痛抑制剂,并介导一种新型的神经元-胶质相互作用,其内源性镇痛作用期待被进一步的发掘应用。以往IFN-α在临床上的应用以抗病毒治疗为主,在疼痛性疾病治疗方面报道很少。主要是因为动物实验证实,全身应用IFN-α达到镇痛作用所需剂量很大,相应不良反应会增加,临床耐受性差。但是将其注射到相关神经节附近,所需剂量将大大降低,不良反应非常小,安全性也得到了极大提高。
在本项研究中未发现有使用IFN-α后而出现相关不良反应的病例产生。且实验组6个月后的治疗有效率明显高于对照组,治疗后病人满意度较高,即使出现疼痛复发情况也可进行重复治疗。综上所述,作者通过将IFN-α加入常规神经阻滞药物中行三叉神经干阻滞,可以提高神经阻滞治疗后的临床疗效,无明显毒副作用。
本研究将IFN-α加入常规神经阻滞药物通过安全的神经阻滞手段治疗原发性三叉神经痛,取得了比常规神经阻滞更好的临床疗效。因IFN-α是一种生理性的细胞因子,机体不良反应发生几率小。此方法安全、刺激小,尚未发现有副作用出现,且不会导致患侧持续性麻木事件的发生。病人容易接受,可在无痛的轻松环境下等待下一步治疗,也不会造成病人经济负担过重。但是,本项研究因条件所限,纳入病例数较少,不能更加精确的反应出治疗效果,而该项技术仅能缓解病人的疼痛,不能从根源上解决病因问题,且远期疗效不明,至于治疗后的远期效果还需进一步临床论证。因此是药物治疗不佳时准备行三叉神经手术前的可靠辅助治疗,可用于各级医院治疗三叉神经痛和行三叉神经手术治疗前的止痛方案。

