蜥蜴散对慢性萎缩性胃炎模型大鼠IL-6的影响
黄 婷,陈一帆,张 燕,黄卫东,梁 岩
慢性萎缩性胃炎(CAG)是指胃黏膜在各种致病因素作用下胃黏膜反复受到刺激导致的胃黏膜变薄、胃固有腺体萎缩等病理改变,是临床常见的消化道疾病,特别是当其伴发肠上皮化生并诱发不典型增生或异型增生时被认为是胃癌的癌前病变[1]。由于单纯的西医治疗效果欠佳,临床上常采用中医或中西医结合进行治疗[2]。实践表明,蜥蜴散对CAG具有良好的治疗作用[3-4],但其作用机制尚不清楚。本实验通过建立CAG大鼠模型,初步探讨蜥蜴散对CAG模型大鼠胃黏膜及血清IL-6的影响。
1 资料与方法
1.1 动物:清洁级SD雄性大鼠18只,鼠龄4周,体重(100±20)g,均由宁夏医科大学实验动物中心提供,SYXK(宁):2015-0001。随机分为3组,即空白对照组、慢性萎缩性胃炎模型组、蜥蜴散治疗组,编为A~C组,空白对照组(A组)6只,CAG模型组(B组)6只,蜥蜴散治疗组(C组)6只,相同条件下分笼饲养,喂SPF大小鼠生长繁殖饲料,自由饮水,给食。
1.2 实验试剂及仪器:蜥蜴散(由蜥蜴粉、鹿角霜粉、海螵蛸粉、炒白术粉、半枝莲粉等组成)由宁夏医科大学中医消化病研究所提供,4%水杨酸钠(分析纯)由天津市大茂化学试剂厂生产(CAS No.:54-21-7),铜绿假单胞菌新鲜菌液由宁夏医科大学生化与分子生物学教研室提供,IL-6单克隆抗体(MB9020)和二抗(BS12478)均由南京巴傲得生物科技有限公司提供,光学显微镜及成像系统为日本奥林巴斯产品;酶标仪(Tecan Austria GmbH),电泳仪(北京六一仪器厂),摇床(上海柏欣机械厂),光学显微镜及成像系统(OLYMPUS),电子天平(上海民桥仪器公司),离心机(HITACHI),RM2125石蜡切片机(德国 LEICA 公司)。
1.3 方法
1.3.1 药物配制:蜥蜴散混悬液制备,即:蜥蜴散经过粉碎、蒸2.5 h,晾干后用灭菌后的去离子水分别配成0.3 g/mL糊剂混悬液装瓶,4 ℃冰箱保存备用。菌液制备:挑取单克隆菌落过夜摇菌并作为种子,种子每个星期重摇活化一次,配置LB培养基并将种子按1∶100加入LB培养基摇菌过夜且使菌液的OD在0.5左右。
1.3.2 造模及治疗方法:A组大鼠正常饲养。B、C组用4%水杨酸钠和过夜培养的铜绿假单胞菌交替灌胃,10 mL/(kg·d),处理8周。8周后A组继续正常饲养,B组继续4%水杨酸钠和过夜培养的铜绿假单胞菌交替灌胃;C组用蜥蜴散混悬液灌胃,每只每次给药20 mL/(kg·d),周一到周五给药,周六、周天休息,共治疗4周。
1.3.3 组织标本的处理:第12周末,将各组大鼠禁食禁水24 h后,麻醉,剖腹取出全胃,沿胃大弯侧切开,用生理盐水冲洗,40 g/L中性甲醛固定、酒精脱水、二甲苯将组织透明,然后进行浸蜡、包埋,为进行HE染色及免疫组化法检测做准备。
1.3.4 HE染色:将组织制成4.5 μm的石蜡切片,二甲苯Ⅰ、Ⅱ脱蜡各20min→无水乙醇Ⅰ、Ⅱ各5 min→95%、90%、80%、70%酒精中各2 min→蒸馏水速洗→苏木精染胞核10 min→用自来水洗去多余的苏木精→用1%的盐酸酒精分化数s→用自来水蓝化30 min→0.5%~1%伊红水溶液染 2 min→70%、80%、90%、95%酒精中各2 min→无水乙醇Ⅰ、Ⅱ各5 min→二甲苯Ⅰ、Ⅱ透明20 min→中性树胶封片。
1.3.5 免疫组化法:将组织制作成切片,厚度3~5 μm,经脱蜡、水化、修复等常规步骤后,用抗体IL-6(1∶200)4 ℃孵育过夜后,室温复温45 min,再用HRP一复合物孵育1 h,然后DAB显色,苏木精染核,封片。
1.3.6 Western 印迹检测蛋白表达:心脏取血后静置过夜,取血清置于-20 ℃冰箱保存。将血清稀释4倍后用BCA法检测血清蛋白浓度,并用PBS将血清蛋白浓度调整为50 mg/mL。将蛋白于12%聚丙烯酰胺凝胶电泳分离,湿转膜50 min,用含 5% 脱脂牛奶的 TBST 封闭膜 2 h,加入IL-6兔抗鼠单克隆抗体(1∶1 000)及内参TF兔抗鼠单克隆抗体(1∶1 000),4 ℃孵育过夜后用TBST漂洗3次,加二抗(1∶50 000)室温孵育1 h,滴加发光试剂暗室曝光显示条带。
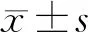
2 结果
2.1 不同组间大鼠病理组织学观察:空白对照组胃黏膜结构正常,慢性萎缩性胃炎模型组胃黏膜见不同程度萎缩,蜥蜴散治疗组病理结果有改善,说明蜥蜴散具有改善大鼠胃黏膜肠化、异型增生的效果。
2.2 不同组间大鼠免疫组化法结果:IL-6阳性颗粒表现为细胞核或细胞浆内棕黄色或深棕色染色,免疫组化法结果镜下观察到各组间均有IL-6分泌,空白对照组可见IL-6大量表达,CAG模型组IL-6表达明显下降,蜥蜴散治疗组IL-6表达回升,见图1-图3(目录后)。
2.3 不同组间大鼠血清Western blot结果:与对照组比较,慢性萎缩性胃炎模型组IL-6的表达明显下调,经过蜥蜴散治疗的大鼠血清中IL-6的表达量有了明显的回升。
2.4 不同组间大鼠血清IL-6含量的比较:模型组大鼠血清IL-6含量为(0.11±0.09)ng/L,对照组血清为(0.64±0.04)ng/L,治疗组为(0.65±0.04)ng/L,模型组血清IL-6含量低于对照组(P<0.05),治疗组与模型组相比,血清IL-6显著回升,差异有统计学意义(P<0.05)。治疗组与对照组相比,血清IL-6水平差异无统计学意义(P>0.05),说明CAG大鼠有炎症损伤,蜥蜴散具有促进IL-6分泌的作用,使血清IL-6水平回升。
3 讨论
CAG是一种常见、多发的消化系统疾病,它是由幽门螺杆菌感染,有遗传因素、免疫因素、饮食等多因素共同诱发的结果,伴有不典型增生时被视为癌前病变[5]。由于该病不是先天性疾病,目前对其病因、发病机制及治疗的研究只能依赖于诱发动物模型,比如采取幽门螺杆菌感染,水杨酸钠、酒精、胆酸等化学物质损伤胃黏膜[6]等方式造模,建立类似人类慢性萎缩性胃炎动物模型。本实验采取水杨酸钠和铜绿假单胞菌液交替灌胃的方式造模,12周后经过HE染色、常规光镜组织病理学观察,发现造模组大鼠的胃部已发生萎缩性胃炎特异性病理改变,说明成功建立了大鼠CAG模型,且方法简便易行。
近年来,感染因素、免疫因素及其共同涉及的细胞内信号转导系统与萎缩性胃炎及癌前病变的关系越来越受到人们的重视。有文献报道[7],IL-6在CAG的发生发展过程中发挥着重要作用,IL-6是一种多效促炎细胞因子,参与多种生物学过程。陶梅[8]等人研究发现,热水灌胃可导致大鼠萎缩性胃炎的形成,在此形成过程中,IL-6和IL-8的含量明显升高。2014年周语平[9]等人报道,慢性萎缩性胃炎模型大鼠胃组织IL-6与正常相比明显升高,用升阳益胃汤高剂量治疗后IL-6表达明显下降。2016年刘利民[10]等人研究发现,复方黄连素在治疗萎缩性胃炎中可显著降低患者血清中 IL-6水平。张静霜[11]等研究发现,复方蜥蜴散对CAG模型大鼠有明显的治疗作用,并降低模型大鼠血清中TNF-α含量。我们应用水杨酸钠和铜绿假单胞菌液交替灌胃建立的大鼠CAG模型,大鼠病理组织和血清中的IL-6含量显著下降,而经过蜥蜴散治疗后IL-6明显回升,这反映了CAG致病机理和中药作用机制的复杂性。蜥蜴散治疗可提高CAG模型大鼠胃组织和血清中IL-6含量,其机制可能与IL-6调节的炎症反应有关。由于本文研究样本数较少,上述研究结果还有待于今后大样本实验结果的证实,蜥蜴散治疗引起IL-6含量增高的原因和生物学意义尚待进一步的深入研究去证实。
本研究结果仍有一定的局限性,首先,为小样本实验性研究,需要进一步增加样本量来验证实验结果;其次,在大鼠体内观察到CAG大鼠血清IL-6下降而治疗后IL-6回升,但在人体内的IL-6尚不清楚;最后,由于中药复方成分复杂,对其作用机制还要从多环节进一步研究,了解细胞因子在疾病中的作用机制,可以为治疗并预防该疾病提供一定的理论依据。

