福建牡蛎17β-HSD基因的克隆及其生殖周期表达
曾 臻,倪健斌,谭强来,史 博,余美舜,李伟杰,蔡 广
(1.厦门医学院海洋生物医药资源福建省高校工程研究中心,福建 厦门 361023;2.厦门医学院天然化妆品福建省高校工程研究中心,福建 厦门 361023;3.厦门大学近海海洋环境科学国家重点实验室,福建 厦门 361102;4.集美大学水产学院,福建 厦门 361023)
福建牡蛎(Crassostreaangulata)是福建沿海最重要的养殖贝类,其养殖产量居于贝类养殖中的第一位,对生殖调控的研究在福建牡蛎养殖中具有重要的意义[1]。现代内分泌学认为激素是细胞与细胞之间传递信息的化学信号物质,其中性腺激素是参与贝类生殖活动的重要激素。然而目前国内外有关贝类生殖内分泌的研究却十分有限。
类固醇激素是最主要的一类性腺激素,包括雄激素、雌激素和孕酮等。目前有关贝类中类固醇激素合成和代谢机制的研究较少,而且比较零散。研究发现,贝类中类固醇激素合成的底物与脊椎动物同样是胆固醇和孕烯醇酮[2-3]。这些性类固醇激素参与了贝类的生殖调控,在贝类的性腺发育过程中发挥着重要作用。然而,关于类固醇激素在贝类中是如何发挥作用的还不甚清楚。
17β-羟基类固醇脱氢酶(17β-Hydroxysteroid dehydrogenase,17β-HSD)作用在类固醇激素合成的最后一步及之后代谢过程的起始阶段,它能够还原17-酮类固醇或者氧化17β-羟基类固醇,可以催化雄烯二醇和睾酮、雌酮和雌二醇、雄烯二酮和二氢睾酮之间的相互转化。对于脊椎动物来说,只有17β-羟基化的雄激素和雌激素才具有生物活性,而17β-酮基化的则没有[4]。之前的研究结果表明,在贻贝、牡蛎、蛤等贝类性腺和消化腺组织中能够检测到17β-HSD的活性,它具有跟脊椎动物17β-HSD类似的生物学功能[5];Matsumoto等(1997)还发现扇贝(Placopectenmagellanicus)体内17β-HSD的活性在生殖周期的不同时段呈现规律性变化,即随着性腺的发育逐渐升高,而在排卵后又明显降低,这说明其可能参与了扇贝性腺发育的调控过程[5]。
本研究拟通过对福建牡蛎类固醇激素合成相关酶的基因17β-HSD进行结构和功能探究,结合其时空表达特征及在性腺细胞中的定位,为阐明牡蛎类固醇激素的合成机制奠定基础,为进一步研究牡蛎生殖内分泌机理提供参考依据。
1 材料与方法
1.1 实验动物
实验用福建牡蛎购自福建省漳州市斗美村渔排,总重为3.8~14.0 g。根据形态学观察[6],将所采样品分为增殖期、生长期、繁殖期和排放期4个阶段,选取每个时期15只雄性和15只雌性作为本研究的实验对象。取每个时期牡蛎不同组织(性腺、闭壳肌、外套膜、鳃、内脏团)放入液氮中速冻后保存于-80 ℃冰箱中备用,同时取一小块成熟期性腺组织固定于4%多聚甲醛溶液中。
1.2 RNA提取
按照试剂使用说明书,将样品置于Trizol®Reagent(Invitrogen, USA)分别匀浆,分别提取不同组织总RNA,通过Nanodrop ND-2000分光光度计检测RNA的浓度和纯度,结合1%的变性琼脂糖凝胶上电泳检测其完整性。
1.3 17β-HSD 基因cDNA全长序列的克隆
将所得的RNA按照反转录试剂盒(TIANGEN,China)步骤分别进行反转录获得cDNA。按照Full-RACE Core Set Ver.2.0 试剂盒(TAKARA, China)要求,根据本实验室构建的福建牡蛎转录组文库中筛选获得的17β-HSD基因的序列片段,分别设计并合成5′和3′ RACE特异性引物(表1),对17β-HSD基因进行5′和3′ RACE扩增,并送广州英韦创津(Invitrogen)生物技术公司进行测序分析。

表1 实验所用引物序列
1.4 实时荧光定量PCR(qRT-PCR)
根据QuantacDNA 第一链合成试剂盒(TIANGEN, China)的说明书合成cDNA 第一条链。以cDNA第一条链为模板,以牡蛎Elongationfactor1α基因(EF1α, GenBank accession no.BQ426516)作为内参基因[6],运用SYBR GreenⅠ染料法在ABI 7500 fast system real-time PCR系统(Applied Biosystems, USA)上定量分析不同时期牡蛎17β-HSD基因的mRNA表达变化。每个实验组设置5个平行样,每个样品设置3个重复孔。每轮反应均设有cDNA实验组、阴性对照组。本实验所使用的试剂盒为SYBR Green qPCR Kit(Thermo,USA),反应条件如下:预变性95 ℃ 10 min; 95 ℃ 20 s, 52 ℃ 20 s, 72 ℃ 20 s, 35个循环。反应结束后对每个基因的熔解曲线进行分析。
所得数据用ABI 7500 system SDS 软件(version 1.4, Applied Biosystems)进行分析,用2-ΔΔCT法计算目的基因的相对表达量[7-8]。
1.5 原位杂交
基于所获的17β-HSD基因序列,设计杂交探针的引物(表1),参考Ni等(2013)的方法对固定于4%多聚甲醛溶液中(4 ℃固定过夜)的性腺组织进行原位杂交[9]。
1.6 目的基因的生物信息学分析
用BLAST软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性比对;用DNAMAN软件进行比对拼接,得到基因的全长序列;用Compute pI/Mw tool(http://web.expasy.org/protparam/)预测等电点和分子量;用SignalP 3.0 软件(http://www.cbs.dtu.dk/services/SignalP/)寻找信号肽;用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白跨膜结构域;用Predict Protein 软件(http://www.predictprotein.org/)预测蛋白质功能结构域;用CLUSTALX软件进行多重序列比对;用MEGA 4.0软件中的邻接法(1 000 bootstrap replicates)构建系统进化树。
2 结果与讨论
2.1 福建牡蛎17β-HSD基因的序列全长及特征
如图1,福建牡蛎17β-HSD基因(ca17β-HSD)cDNA全长1 149 bp,包括45 bp的5′-UTR(5′-Untranslated Region),183 bp的3′-UTR和921 bp的ORF(Open Reading Frame)。序列3′-UTR中存在典型的poly A加尾信号AATAAA。ca17β-HSD基因可编码307个氨基酸,预测蛋白分子量为34.084 kDa,等电点为8.58。SignalP和TMHMM软件预测ca17β-HSD氨基酸序列具有1个跨膜结构和1个信号肽,分别位于AA10—AA32和AA1—AA20。第AA44—AA283为ca17β-HSD氨基酸序列保守的氧化还原酶功能结构域,该结构域包括1个酶活性中心YSSSK(AA191—AA195)、1个辅酶结合位点TG***G*G(AA48—AA55)和1个结构性保守序列NNAG(AA125—AA128)。

图1 福建牡蛎17β-HSD基因的核酸序列和氨基酸序列
2.2 福建牡蛎17β-HSD基因的同源性和系统发育分析
经过序列多重比对发现,ca17β-HSD氨基酸序列属于17β-HSD11亚型,它与太平洋牡蛎(Crassostreagigas)和杂色鲍(Haliotisdiversicolor)17β-HSD11亚型的氨基酸序列相似性分别为99%和57%,与脊索动物17β-HSD11亚型的氨基酸序列相似性为45%,与其他脊椎动物17β-HSD11亚型的氨基酸序列相似性为40%~44%(图2)。通过构建系统进化树,我们发现所选取的不同物种的17β-HSD氨基酸序列可以分为三个亚型,分别是17β-HSD11亚型、17β-HSD12亚型和17β-HSD4亚型,其中17β-HSD11亚型和17β-HSD12亚型亲缘性更高。在17β-HSD11亚型中,ca17β-HSD11先与太平洋牡蛎17β-HSD11聚为一枝,再与同为贝类的杂色鲍17β-HSD11聚类,接着再依次与脊索动物和其他脊椎动物聚类(图3)。

图2 福建牡蛎及其他物种17β-HSD氨基酸序列的多重比对
图2、3中各物种17β-HSD氨基酸序列在NCBI上的登录号如下:太平洋牡蛎(Crassostreagigas)11, EKC30097.1; 杂色鲍(Haliotisdiversicolor)11, ADV02385.1; 柱头虫(Saccoglossuskowalevskii)11, XP_002732320.1;非洲爪蟾(Xenopustropicalis)11, NP_001011240.1; 原鸽(Columbalivia)11, EMC85029; 家鼠(Musmusculus)11, NM_053262.3; 牦牛(Bosgrunniensmutus)12, ELR49992; 鸭嘴兽(Ornithorhynchusanatinus)12, XP_001509870; 红原鸡(Gallusgallus)12, XP_426310.2; 斑马鱼(Daniorerio)12, NM_200881; 杂色鲍(Haliotisdiversicolor)12, ADF80270.1; 狗岩螺(Nucellalapillus)12, JX625140.1; 马(Equuscaballus)12, XP_001488432; 绵羊(Ovisaries)12, XP_004016470; 柱头虫(Saccoglossuskowalevskii)12, XP_002733503; 智人(Homosapiens)12, NP_057226.1; 野猪(Susscrofa)12, BAI47714; 紫海胆(Strongylocentrotuspurpuratus)12, XP_798337; 斑马鱼(Daniorerio)4, AAK27967; 河鳟(Salmotruttafario)4, ACN66287; 栉孔扇贝(Chlamysfarreri)4, AGC26171; 底鳉(Fundulusheteroclitus)4, BAF74749; 家鼠(Musmusculus)4,CAA62015。
2.3 福建牡蛎17β-HSD基因在不同组织中的表达
如图4所示,在福建牡蛎性腺、外套膜、鳃、闭壳肌和内脏团等组织中均能检测到17β-HSD基因的表达,其中性腺的表达量最高(p<0.05),其次为内脏团,而17β-HSD基因在鳃、外套膜、闭壳肌中的表达量差异不显著(p>0.05)。
2.4 福建牡蛎17β-HSD基因在生殖周期中的表达模式
图5反映了当性腺开始发育后,福建牡蛎性腺中17β-HSD基因的表达量开始下降(p<0.05),在性腺发育的生长期和成熟期,其表达量均维持在一个较低的水平。而在配子排放后,性腺中17β-HSD基因的表达量反而急剧升高,达到成熟期表达量的3倍之多(p<0.05)。
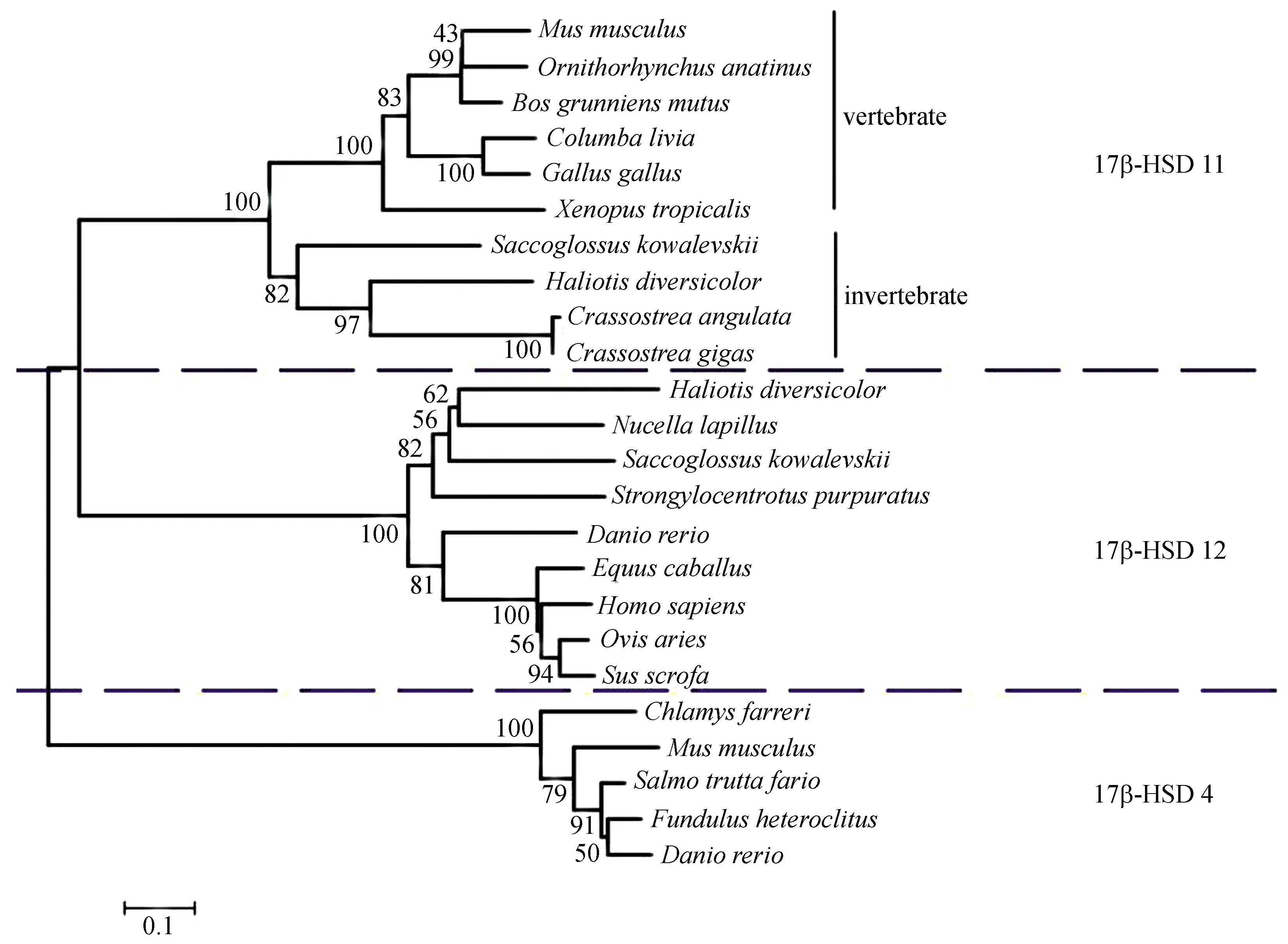
图3 17β-HSD在福建牡蛎和其他物种间的进化分析

图4 17β-HSD基因在福建牡蛎各组织中的表达

图5 17β-HSD基因在福建牡蛎性腺不同发育阶段的表达

图6 福建牡蛎17β-HSD基因在成熟卵巢中的分布
2.5 福建牡蛎17β-HSD基因在卵巢中的细胞定位
结果显示17β-HSD基因在福建牡蛎卵巢中呈现出细胞定位。能与DIG标记的17β-HSD基因的反义RNA探针杂交,显色后呈蓝黑颜色的阳性信号主要分布在卵细胞周边的个体小的滤泡细胞上,而在成熟卵细胞上没有发现有阳性信号(图6),这说明17β-HSD基因均主要表达在福建牡蛎卵巢组织的滤泡细胞中。
2.6 讨论
17β-HSD是性类固醇激素合成过程最后步骤中的催化酶,它以NADH/NADPH为辅基,通过催化性类固醇激素C17位上的醇基和酮基之间的氧化还原反应,使低生物活性的雌酮、雄烯二酮与高生物活性的雌二醇、睾酮之间进行相互转化[4]。脊椎动物17β-HSDs大都数均属于短链脱氢酶/还原酶(SDR)超家族,其中2、4、6、8、9、10、11、14亚型为氧化酶,1、3、5、7、12亚型是还原酶。已有的研究表明,贻贝、牡蛎、蛤等贝类性腺和消化腺中均存在17β-HSD的活性,它们具有跟脊椎动物中17β-HSD类似的生物学功能[5,10-12]。Matsumoto等(1997)还发现扇贝体内17β-HSD的活性变化与生殖过程显著相关,生长期性腺中17β-HSD的活性约是排卵后的2倍[5]。此外,目前已有研究者成功获得了狗岩螺(Nucellalapillus)[13]、杂色鲍[14-15]和栉孔扇贝(Chlamysfarreri)[16]的17β-HSD基因序列全长,并研究了其在不同性别及性腺发育不同阶段的表达模式,结果表明17β-HSD在贝类的性腺发育调控中发挥着重要作用。其中有研究者通过基因克隆和瞬时转染的方法在杂色鲍中鉴定到两种有活性的17β-HSD亚型,其中一种是17β-HSD12,它是一种还原酶,能将雌酮转化为雌二醇,增加雌激素的活性,杂色鲍生殖周期中,17β-HSD12的表达量随着性腺的发育逐步升高,催化了雌酮向雌二醇的转化,从而提高了雌二醇的水平,有助于性腺的发育[14];另一种亚型是17β-HSD11,它是一种氧化酶,能将睾酮氧化为雄烯二酮,可以降低雄激素的活性[15]。本实验用RACE的方法首次获得了福建牡蛎17β-HSD基因的cDNA全长序列,它们具有17β-HSDs家族基因保守的结构特征,如Rossman折叠结构、辅酶结合位点和催化活性位点等[17]。氨基酸序列比对的结果显示,福建牡蛎17β-HSD属于11亚型,与其他物种的氨基酸序列具有较高的同源性。QRT-PCR的结果表明,福建牡蛎性腺中17β-HSD基因的表达量高于其他组织,原位杂交的结果进一步显示17β-HSD基因主要表达在卵巢的滤泡细胞上。本研究还发现,福建牡蛎性腺中17β-HSD的表达量高低与性腺发育阶段密切相关,但其变化趋势却与性类固醇激素含量相反。我们推测这可能是由于其属于11亚型,主要起氧化酶的作用。在福建牡蛎性腺成熟前,该基因的表达量较低,氧化作用弱,雌激素和雄激素更多地以有活性的雌二醇和睾酮的形式存在,以便促进性腺的进一步发育,而当配子排放后性腺发育暂停,17β-HSD11基因的表达量显著提高,使得雌二醇和睾酮被转化为雌酮和雄烯二酮,导致雌二醇和睾酮的含量显著下降。Matsumoto等用放射性同位素标记的方法发现太平洋牡蛎中17β-HSD将雌二醇转化为雌酮的活性显著高于将雌酮转化为雌二醇的活性[5],这也佐证了我们之前的假设。此外,本次研究还发现,除性腺外,17β-HSD基因在福建牡蛎其他组织中(包括外套膜、鳃、闭壳肌和内脏团)也均有表达,这说明该种酶在牡蛎中可能与在其他脊椎动物和无脊椎动物中一样,具有多重生物学功能[18]。已有研究证实脊椎动物肝脏和肾脏中的17β-HSD可以催化长链脂肪酸的β-氧化[19],而本实验也发现福建牡蛎17β-HSD基因在内脏团中表达量较高,这说明其可能参与了牡蛎的脂肪代谢过程。类似的结果在栉孔扇贝[16,20]和狗岩螺[13]中也有报道。
3 结论
综上,本研究通过分子生物学的方法克隆获得了福建牡蛎性类固醇激素合成酶重要基因17β-HSD的全长,并研究了其序列结构特征和时空表达模式,推测17β-HSD可能参与了牡蛎性类固醇激素合成过程中的不同生化反应,是牡蛎性类固醇激素合成过程中的关键酶,对调节牡蛎性类固醇激素的合成起着重要的作用。

