Gac系统中gacS基因的缺失对东湖假单胞菌HYS毒性的影响
游佳, 桂哲, 谢志雄
武汉大学生命科学学院, 武汉 430072
铜绿假单胞菌(Pseudomonasaeruginosa)是一种普遍生活在各种环境中、可引起人类疾病的条件致病菌[1]。P.aeruginosaPAO1是北美医院中常见的致病菌之一,因其具有生成生物膜和转运抗生素的能力,因此对多种抗生素具有高抗性,可引起肺部感染,还可引起烧伤病人败血症,甚至死亡[2]。
在动植物及人体病源性假单胞菌中,Gac系统是一个保守的双组分(GacS/GacA)调控系统,陆续在多种细菌中被鉴定出来[3-4]。GacS/GacA系统主要通过调控所在细菌的运动能力、蛋白酶的分泌、细菌脂多糖(lipopolysaccharides,LPS)的产生、氢氰酸的合成等来影响毒力因子的产生,从而改变细菌的致病性[5-6]。其中,GacS是该系统的跨膜感应蛋白,最初在丁香假单胞菌(Pseudomonassyingaepv.)中被鉴定出来,其受到外界信号激活后可自磷酸化。而GacA蛋白是该系统的调控蛋白,当GacS自磷酸化后可激活GacA,假单胞菌中GacA蛋白通过结合到RsmY/Z等小RNA(small RNA,sRNA)的启动子上起始表达。在P.aeruginosaPAO1中,这些sRNA与翻译抑制蛋白RsmA结合,从而解除RsmA对下游目的基因的抑制作用。因此,GacS蛋白的缺失最终会导致目的基因的低表达[7]。
东湖假单胞菌(Pseudomonasdonghuensis)HYS菌株是本实验室在前期工作中首次从武汉东湖水域分离的一株具备高产铁载体能力的革兰氏阴性菌,通过生理生化测试和基于全基因组测序的16S rRNA基因的进化分析,这株高产铁载体的菌株应归属于Pseudomonasdonghuensissp.,并作为模式菌株被命名为PseudomonasdonghuensisHYS[8]。该HYS菌株可产生荧光铁载体和非荧光铁载体,且在同等培养条件下,其产铁载体总量的能力是其他假单胞菌的5倍。HYS菌株还被发现对秀丽隐杆线虫胚胎具有极强的致死效应,秀丽隐杆线虫胚胎在HYS菌苔上的孵化比例为0(大肠杆菌OP50阴性对照的孵化比例为100%),且HYS喂食的秀丽隐杆线虫半数致死时间约为3.6 d,由此也可推测出HYS具备成为致病菌的可能性[9]。然而,目前HYS的毒性调控机制尚不清楚。为了探究Gac系统对于潜在致病菌HYS毒性的影响,确定HYS中毒性因子的调控途径,本研究先通过氨基酸序列BlastP比对以确定HYS中Gac系统的存在,再将不同来源的gacS片段通过基因克隆回补至HYS的gacS基因敲除株ΔgacS中,通过细菌-线虫的致病模型验证Gac系统对于HYS毒性的影响。随后通过比较野生型HYS菌株、敲除株ΔgacS以及不同来源的gacS片段回补株在脱脂牛奶平板、运动能力平板以及脂多糖和氢氰酸的检测中的表型,进一步明确gacS基因的缺失对于多种毒性因子的影响,以期完善HYS菌株的致病途径,为后期HYS的防治提供参考。
1 材料与方法
1.1 质粒、线虫和菌株
pBBR1-MCS2质粒由本实验室保存;秀丽隐杆线虫(Caenorhabditiselegans)N2购自美国线虫遗传学中心(Caenorhabditis Genetics Center,CGC);大肠杆菌S17-1、OP50以及铜绿假单胞菌(P.aeruginosa)PAO1均由本实验室保存;东湖假单胞菌(P.donghuensis)HYS分离自东湖水域,HYS的gacS基因敲除株ΔgacS由本实验室构建并保存[10]。
1.2 主要试剂与培养基
LB液体培养基、NGM培养基的配置方法参照高经纬[9]的配方;脱脂牛奶培养基的配置方法参照Reinmman等[11]的配方。
泳动运动检测培养基:蛋白胨9 g,NaCl 4.5 g,琼脂糖2.7 g,用自来水完全溶解后定容至900 mL,分装至三角瓶中,每瓶150 mL,121 ℃、20 min高温高压灭菌。
群集运动检测培养基:蛋白胨9 g,酵母提取物4.5 g,葡萄糖4.5 g,琼脂4.5 g,用自来水完全溶解后定容至900 mL,分装至三角瓶中,每瓶150 mL,121 ℃、20 min高温高压灭菌。
蹭行运动检测培养基:蛋白胨9 g,酵母提取物4.5 g,NaCl 4.5 g,琼脂9 g,用自来水完全溶解后定容至900 mL,分装至三角瓶中,每瓶150 mL,121 ℃、20 min高温高压灭菌。
KMB培养基:蛋白胨20 g,MgSO4·7H2O 1.5 g,K2HPO41.5 g,甘油10 mL,混合后加水定容至1 L,121 ℃、20 min高温高压灭菌。
1.3 仪器与试剂盒
HV-50型高压灭菌锅(日本Hirayama公司);BS110S型分析电子天平(德国Sartorius公司);GHP-9080隔水式恒温培养箱(上海一恒科学仪器有限公司);PCR仪(德国Eppendorf股份公司)。
苦味酸试纸购自北京华科盛精细化工产品贸易有限公司;细菌脂多糖提取试剂盒购自上海贝博生物科技有限公司;细菌脂多糖酶联免疫分析试剂盒购自上海酶联生物科技有限公司。
1.4 生物信息学分析
HYS全基因组测序工作已由本实验室高经纬完成并上传至NCBI Whole Genome Shotgun数据库,当前版本接入号为AJJP01000000[9]。为了确定HYS中是否存在Gac系统,利用生物信息学方法预测并定位HYS基因组中gacS基因的位置。
将P.aeruginosaPAO1的Gac系统关键蛋白GacS作为参照,在数据库中设置Pseudomonasdonghuensis种属为背景。P.aeruginosaPAO1的PA0925、PA0926、PA0927(被注释为idhA)、PA0928(被注释为gacS)、PA0929以及PA0930序列均调取自NCBI;P.donghuensisHYS的UW3_RS0101475、UW3_RS0101480、UW3_RS0101485、UW3_RS0101490、UW3_RS0101500基因序列均调取自NCBI核酸数据库,HYS的核酸数据库接入号为NZ_AJJP01000185.1。将2组基因对应的氨基酸序列进行BlastP比对,并对结果进行分析,保留HYS来源的高同源性比对结果并排序。
1.5 gacS基因回补菌株的构建
分别从NCBI网站上调取P.donghuensisHYS和P.aeruginosaPAO1的gacS基因序列,以其为模板进行PCR扩增,并将扩增产物克隆至pBBR1-MCS2质粒上,再利用细菌结合的方法将二者的gacS基因回补到HYS的gacS基因敲除株ΔgacS中,并分别标记为ΔgacS/pBBR2-gacSHYS和ΔgacS/pBBR2-gacSPAO1。具体操作参照高经纬[9]的方法。将构建成功的ΔgacS/pBBR2-gacSHYS和ΔgacS/pBBR2-gacSPAO1菌株平板划线至含50 μg·mL-1卡那霉素抗性的LB平板上,于4 ℃保存。
1.6 线虫培养
将大肠杆菌OP50、P.aeruginosaPAO1、P.donghuensisHYS和ΔgacS菌株在LB平板上划线,HYS/pBBR2、ΔgacS/pBBR2、ΔgacS/pBBR2-gacSHYS、ΔgacS/pBBR2-gacSpao1在含50 μg·mL-1的卡那霉素抗性平板上划线。挑单菌落于5 mL液体LB培养基中,置于30 ℃、200 r·min-1摇床培养12 h,其中带有pBBR1-MCS2质粒的菌株均用50 μg·mL-1的卡那霉素抗性平板培养。取200 μL菌液滴加到NGM平板上,每个菌株滴5个NGM平板,待菌液晾干后,将滴有菌液的NGM平板放置于22 ℃恒温培养箱培养12 h。将同步培养到L4期的秀丽隐杆线虫转移到NGM-实验菌株平板上,每个平板20只。转移线虫的当天记为第1天,之后每5天记录1次线虫状态,同时将存活的线虫转移到新的NGM-实验菌株平板上,直至线虫全部死亡。通过统计线虫存活的个数和天数可指示菌株对线虫的毒性大小。本实验室培养秀丽隐杆线虫用大肠杆菌OP50作为食物维持,因此将仅含大肠杆菌OP50的处理组作为阴性对照。

表1 实验所用引物
1.7 胞外蛋白酶的检测
利用分光光度计测定各菌株活化所得菌液的OD600,并将其OD600调至0.2。用无菌的枪头取2 μL待测菌液滴到脱脂牛奶平板的表面,待菌液晾干后,倒置于30 ℃恒温培养箱中培养72 h,测量其产生的透明圈大小。
1.8 运动能力的检测
利用分光光度计测定各菌株活化所得菌液的OD600,并将其OD600调至0.1。泳动运动和群集运动的检测用无菌的枪头取2 μL待测菌液滴到泳动运动平板、群集运动平板的表面,待菌液晾干后,正置于30 ℃恒温培养箱中12 h后,测量2种运动圈直径大小。蹭行运动的检测用无菌的枪头垂直刺穿直至蹭行运动培养基底部,然后将菌液沿着刺穿的孔点加至培养基的底部,待菌液完全吸入培养基后,将其倒置于30 ℃恒温培养箱中24 h后,测量蹭行运动产生的运动痕迹的大小。记录数据并拍照保存,每个菌株独立实验3次。
1.9 脂多糖的提取与检测
将各菌株活化所得的菌液按1%接种到50 mL LB液体培养基中,30 ℃、200 r·min-1振荡培养12 h,将菌液的OD600调至3.0,利用细菌脂多糖提取试剂盒提取各菌株的脂多糖样品,具体操作参见试剂盒说明书。然后利用细菌脂多糖酶联免疫分析试剂盒进行脂多糖浓度检测,具体操作参见试剂盒说明书。
1.10 氢氰酸检测
在KMB平板上(添加了4.5 g·L-1的甘氨酸)上活化实验菌株,然后将苦味酸试纸浸泡在2%碳酸钠溶液中,将试纸灭菌后烘干,再将试纸放置于培养皿上盖内侧,封口膜密封培养皿,正置于30 ℃下培养48 h,拍照记录。
1.11 数据与分析
P.donghuensisHYS和P.aeruginosaPAO1中同源性基因的排列绘制自SnapGene 2.3.2。柱状图绘制自Origin 9.0和Photoshop CS2软件。显著性分析采用Duncan多重比较法。
2 结果与分析
2.1 HYS的生物信息学分析
将P.aeruginosaPAO1的Gac系统关键蛋白GacS作为参照,以Pseudomonasdonghuensis种属为数据库,在NCBI中进行氨基酸序列BlastP比对,结果如表2所示。
为了更精准定位HYS中GacS蛋白的位置,需将PAO1基因组中的gacS核酸序列与表2中蛋白同源性最高的WP_026001148.1的核酸序列以及相邻基因核酸序列进行比对分析。PAO1中GacS蛋白对应的gacS编码基因的编号为PA0928,HYS基因组中WP_026001148.1蛋白编码基因的编号为UW3_RS0101480。结果如图1所示,2个基因组中相同的颜色代表2个同源基因,而不同颜色代表基因组内不同的基因。可知P.donghuensisHYS中编号为UW3_RS0101485的基因与P.aeruginosaPAO1中gacS基因所在位置的相邻基因排布一致(图1),且具有高度同源性(表3)。该结果说明UW3_RS0101485基因即是PAO1中Gac系统关键的gacS基因的同源基因,由此可推测HYS中存在Gac系统。

表2 东湖假单胞菌HYS中GacS蛋白的同源性比对
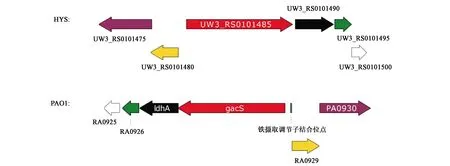
图1 P. aeruginosa PAO1与P. donghuensis HYS中gacS基因的定位

PAO1基因编号HYS基因编号HYS蛋白编号蛋白同源性E值PA0930UW3_RS0101475WP_036995139.156.18%5E-165PA0929UW3_RS0101480WP_010220372.157.50%3E-99PA0927UW3_RS0101490WP_010220374.177.98%0.0PA0926UW3-RS0101495WP_010220375.176.60%2E-84PA0925UW3_RS0101500WP_010220376.154.96%3E-58
2.2 Gac系统对HYS毒性的影响
为了检测HYS的Gac系统是否发挥毒性调控作用,分别将P.aeruginosaPAO1和P.donghuensisHYS的gacS基因回补到HYS的gacS基因敲除株ΔgacS中,将所得菌株喂食秀丽隐杆线虫,通过比较线虫的生存天数和生存数量来判断菌株毒性的强弱,从而验证HYS菌株中Gac系统的功能保守性。
由表4可知,野生型HYS菌株和PAO1菌株均对线虫有较为强烈的毒性,且HYS对线虫的毒性更强。而ΔgacS菌株毒性明显减弱,其喂食的线虫甚至与OP50喂食的线虫生存率相当(在第15天还有26条存活)。喂食ΔgacS的空载体菌株ΔgacS/pBBR2的线虫在培养19 d后仍有1条存活;而喂食HYS的空载体菌株HYS/pBBR2的线虫在第5天只有9条存活,培养到第10天没有线虫存活。回补菌株ΔgacS/pBBR2-gacSHYS对线虫的毒性恢复明显,在第10天后没有线虫存活;同时,回补PAO1的gacS基因的ΔgacS/pBBR2-gacSPAO1菌株对线虫的毒性也有一定程度的恢复,但与回补菌株ΔgacS/pBBR2-gacSHYS存在一定差距。上述结果说明,HYS中的Gac系统参与了毒性调控途径,且PAO1的gacS基因在HYS菌株中同样能够发挥一定的毒性调控作用。
2.3 HYS的Gac系统对毒性因子表型的影响
2.3.1HYS的Gac系统对蛋白酶分泌的影响
由图2可知,将gacS基因敲除后,ΔgacS菌株不能产生蛋白酶水解圈,说明没有蛋白酶的产生或蛋白酶活性完全丧失;而回补菌株ΔgacS/pBBR2-gacSHYS的蛋白酶活性几乎恢复到野生型HYS的水平,由此推测gacS基因的缺失抑制了HYS菌株胞外蛋白酶的表达或分泌。此外,回补菌株ΔgacS/pBBR2-gacSPAO1和敲除株ΔgacS相比,蛋白酶活性有一定的恢复,但其蛋白酶水解圈显著小于回补菌株ΔgacS/pBBR2-gacSHYS(P<0.05),说明PAO1的gacS基因只能够恢复部分蛋白酶活性。

表4 各菌株毒性对线虫生存天数和生存数量的影响

A:各菌株在脱脂牛奶平板上的胞外蛋白酶产生情况;B:A中数据对应的柱状图,不同小写字母表示不同菌株间蛋白酶产量的差异具有统计学意义(P<0.05)。
2.3.2HYS的Gac系统对运动能力的影响 为了探究HYS菌株Gac系统对其运动能力的影响,本研究检测了所得菌株的运动能力。由表5可知,敲除株ΔgacS与野生型HYS间的3种运动能力的差异均具有统计学意义(P<0.05);且ΔgacS/pBBR2与野生型HYS/pBBR2间3种运动能力的差异也均具有统计学意义(P<0.05)。向敲除株ΔgacS回补HYS的gacS基因后,回补菌株ΔgacS/pBBR2-gacSHYS的3种运动能力均能恢复到甚至超过野生型HYS菌株的水平。而回补菌株ΔgacS/pBBR2-gacSHYS和ΔgacS/pBBR2-gacSPAO1间泳动运动和群集运动能力的差异不具有统计学意义(P>0.05),即HYS自身的gacS基因和PAO1的gacS基因均能恢复HYS菌株因gacS基因缺失所产生的2种运动表型变化。与野生型菌株相比,携带pBBR2质粒的菌株的3种运动能力均显著下降(P<0.05),表明质粒也会对菌株的运动能力造成一定的影响。

表5 菌株运动能力的比较
注:同列数据后不同小写字母表示不同菌株间运动能力的差异具有统计学意义(P<0.05)。
2.3.3HYS的Gac系统对脂多糖产量的影响
为了探究HYS菌株Gac系统对毒性因子脂多糖的影响,对所得菌株进行了脂多糖浓度的检测。利用细菌脂多糖提取试剂盒对菌株的脂多糖进行提取,提取后的脂多糖用脂多糖检测试剂盒进行浓度检测。标准物所做标准曲线如图3A所示,其线性回归方程为:Y=0.002 4X+0.212 7(R2=0.983 2)。
由图3B可知,将gacS基因敲除后,与野生型HYS相比,敲除株ΔgacS的脂多糖浓度显著下降(P<0.05);回补HYS的gacS基因后,回补菌株的脂多糖浓度有所上升,差值小于敲除株ΔgacS与野生型HYS之间的差距,说明回补的基因发挥了作用(图3B)。此外,回补了PAO1的gacS基因的ΔgacS/pBBR2-gacSPAO1菌株的LPS产量恢复至野生型PAO1的水平(P>0.05),但仍显著低于ΔgacS/pBBR2-gacSHYS菌株(P<0.05)。上述结果说明HYS的Gac系统可正调控其脂多糖的生成。

A:标准曲线;B:各菌株生产的脂多糖浓度,不同小写字母表示不同菌株间脂多糖产量的差异具有统计学意义(P<0.05)。
2.3.4HYS的Gac系统对氢氰酸生成的影响
为了探究HYS菌株Gac系统对其生成有毒代谢物氢氰酸的影响,本研究进行了氢氰酸生成的检测。根据试纸的变色程度来判断氢氰酸的产生情况。
从图4可以看出,野生型HYS在KMB培养基能产生氢氰酸,试纸变黄褐色;而敲除株ΔgacS试纸不变色,说明没有氢氰酸产生。回补HYS的gacS基因后,试纸变色,说明回补菌株ΔgacS/pBBR2-gacSHYS重新产生氢氰酸,回补基因发挥了功能。但其变色程度不如HYS/pBBR2野生型明显,由此推测其产生的氢氰酸含量少于HYS/pBBR2野生型菌株。此外,回补了PAO1gacS基因的ΔgacS/pBBR2-gacSPAO1的变色程度虽然有恢复,但不及ΔgacS/pBBR2-gacSHYS明显。

图4 不同菌株的氢氰酸含量检测
上述结果表明,HYS的Gac系统与PAO1中Gac系统高度保守,可形成一定程度上的功能互补,且HYS中gacS的缺失影响了HYS对线虫的慢性毒性。PAO1中的gacS基因控制着线虫的致病因子的产生,如胞外蛋白酶、脂多糖、氢氰酸等[12-13],而在HYS中,gacS基因也发挥着同样的作用,进而可能引发潜在的动植物致病性。
3 讨论
P.aeruginosaPAO1是一种人类机会致病菌,因其可造成人类疾病而被广泛研究。秀丽隐杆线虫因具有个体小、形态简单、易于培养保存与复苏、满足高通量筛选以及与人类疾病相关基因高度同源等特点,而被广泛应用于各类微生物致病机制的研究[14-15]。本研究发现,相对于大肠杆菌OP50,P.donghuensisHYS菌株与机会致病菌PAO1均具备强烈的毒杀线虫的能力。此外,HYS喂食的线虫在第5天只有9条存活,而PAO1喂食线虫在第9天依然有13条存活,表明HYS相比人类机会致病菌PAO1对线虫具备更强的致死效应。
本研究通过生物信息学比对分析确定了HYS菌株中存在与PAO1高度同源的Gac系统。对于P.aeruginosa菌种,已有研究报道Gac系统与其致病性紧密相关[11]。 在本研究中,HYS的gacS基因敲除株ΔgacS所喂食的线虫在第15天还存活26条,相比于野生型HYS,其毒性几乎完全丧失。由于HYS和PAO1的GacS蛋白具有同源性,将PAO1的gacS片段回补到HYS的ΔgacS菌株中在一定程度上恢复了ΔgacS菌株的毒性表型,提示着PAO1的Gac系统与HYS的Gac系统对毒性控制具有同样的功能。但值得注意的是,HYS对线虫的毒性明显强于PAO1,且回补PAO1的gacS基因无法完全恢复HYS的毒性表型。在第5天时,喂食ΔgacS/pBBR2-gacSPAO1的线虫与喂食ΔgacS/pBBR2-gacSHYS相比,存活数量几乎多了一倍;在第10天时,喂食ΔgacS/pBBR2-gacSPAO1的线虫仍存活35条,而喂食ΔgacS/pBBR2-gacSHYS的线虫则全部死亡,暗示着HYS中除了存在PAO1中被GacS蛋白调控的毒力因子外,可能还存在着HYS中特有的、更强烈的毒力因子。
脂多糖(lipopolysaccharide,LPS),也称为脂质聚糖和内毒素,是革兰氏阴性菌外膜的主要组成成分。LPS的功能包括细菌的粘附、外膜渗透屏障、抗血清以及抗吞噬,另外还可作为某些噬菌体的吸附受体[16]。LPS还介导着细菌和周围环境间的相互作用,有利于细菌应对极端生存环境[17]。有研究表明,绿针假单胞菌(Pseudomonaschlororaphis) G5的Gac系统显示出与HYS不同的调控方向,G5菌株的gacA缺失株负调控LPS的产量,粗糙型脂多糖的产量明显增多,这与HYS的ΔgacS菌株中LPS的总量下降的现象相反[18],也就意味着在HYS中Gac系统正调控LPS的产量。氢氰酸(hydrogen cyanide, HCN)作为假单胞菌产生的一种毒性物质,在多种假单胞菌的分泌物中均有发现,如荧光假单胞菌(P.fluorescent)CHA0、P.aeruginosaPAO1等[19-20]。氢氰酸可以通过抑制呼吸酶造成细胞内窒息,曾作为一种生物杀菌剂用于烟草的黑根腐病的防治研究[20]。本研究发现,HYS的gacS基因敲除株ΔgacS中HCN产量几乎丧失,这一结果与闫小雪等[21]在荧光假单胞菌中Gac系统对HCN产量的调控趋势相同。P.aeruginosaPAO1中的碱性蛋白酶AprA和弹性蛋白酶LasA、LasB所组成的胞外蛋白酶也是其毒力因子的一种,蛋白酶通过降解免疫球蛋白或抗菌肽等帮助病原体入侵[22]。HYS的gacS基因缺失株胞外蛋白酶活性丧失,脱脂牛奶平板上的蛋白酶水解圈完全消失。这和Duffy等[23]发现Gac系统对一些胞外酶基因的表达起正调控作用现象一致。此外,细菌的运动性也参与帮助病原体附着到宿主表面,以及促进生物膜的产生帮助发挥细菌毒性等作用[24]。细菌常见的运动方式有3种:泳动运动、群集运动和蹭行运动[25]。本研究发现敲除gacS基因后,细菌在3种运动平板上的运动直径均明显增大,这一现象与魏雪[26]在P.aeruginosaM18中观察到的gacA缺失菌株的运动性表型极为相近。
然而,本研究并未深入到基因或蛋白质表达层次的调控研究。许多研究表明Gac系统是通过下游sRNA进行调控作用的[27]。HYS中确实存在RsmY/Z/A sRNA[10],但如何对细菌的运动能力以及LPS、氢氰酸和蛋白酶的生成进行调控还有待深入研究,尤其是HYS中Gac系统调控LPS的模式与其他菌株不同,提示HYS中RsmY/Z/A sRNA对LPS可能存在特殊的调控模式。综上所述,本研究发现相比人类机会致病菌PAO1,HYS具备更强的线虫致死能力,敲除株ΔgacS通过下调多种毒力因子来影响其毒性的产生。本研究的结果为未来深入探讨HYS中毒力因子调控机制奠定了基础,同时也为HYS可能引起的动物毒害作用提供了抗毒研究的新思路。

