异源表达芥菜BjMATE增强紫花苜蓿耐酸铝胁迫的机理
李小冬,尚以顺,李世歌,陈光吉,裴成江,孙方,熊先勤
异源表达芥菜增强紫花苜蓿耐酸铝胁迫的机理
李小冬1,2,尚以顺1,李世歌1,2,陈光吉1,2,裴成江1,2,孙方1,熊先勤1
(1贵州省农业科学院草业研究所,贵阳 550006;2贵州鼎芯农牧科技有限公司,贵阳 550006)
【】酸铝胁迫是南方农业生产面临的主要环境胁迫之一。研究乡土植物对酸铝胁迫的适应机理,发掘并利用优良基因培育抗酸耐铝作物新品种,从而为紫花苜蓿分子遗传改良奠定基础。贵州省草业研究所紫花苜蓿遗传改良组前期已从贵州乡土资源平坝苦油菜中克隆获得,并将其构建过量表达载体。采用组织培养和花器官浸泡法分别对紫花苜蓿和拟南芥进行遗传转化,根据NPT抗性基因和特异基因设计引物对转化材料进行分子鉴定,并采用qRT-PCR进行表达量的鉴定。利用水培法平行比较转基因和对照紫花苜蓿在酸、铝和酸铝组合胁迫条件下的发芽率、幼苗生长状况,以及在长时间弱酸铝胁迫条件下的幼苗地上和地下部分的生长变化。采用酶标仪检测酸、铝以及酸铝组合胁迫条件下转基因和对照紫花苜蓿根系中POD、SOD、CAT等抗氧化酶的活性和MDA含量的变化,同时在过表达的拟南芥中采用qRT-PCR的方法分析酸铝代谢途径的关键基因、、、和在胁迫条件下的表达变化,并对其调控关系进行讨论。过量表达的拟南芥和紫花苜蓿的阳性率分别为100%与66.7%,候选紫花苜蓿和拟南芥转基因株系中的表达量分别比对照上调63.02和76.87倍。过量表达紫花苜蓿株系和对照中苜1号紫花苜蓿的发芽率在正常、酸胁迫、铝胁迫和酸铝组合胁迫条件下都没有显著差别,但是其发芽势在胁迫条件下显著优于对照中苜1号。在长时间弱胁迫条件下,的株高与对照没有显著区别,但在铝离子胁迫和酸铝组合胁迫条件下,其的生物产量和根系伸长显著优于对照中苜1号。抗氧化酶活性和MDA含量在与中苜1号中的变化不尽相同。POD和SOD的活性在胁迫处理后的2个材料中都显著上升,但只有SOD的活性在2材料间差异显著。CAT的活性在处理间和材料间都没有显著的差异。MDA的含量略有下降,在铝离子和酸铝组合胁迫条件下的2个材料中差异达显著水平。qRT-PCR显示,在植株中,、、、和受铝和酸铝组合胁迫诱导,但只有在与野生型之间差异显著。能够正向调节紫花苜蓿在种子萌发和幼苗生长阶段对酸铝胁迫的耐受性。活性氧清除系统尤其是SOD以及酸铝代谢途径关键基因可能参与介导的酸铝胁迫调节。
酸铝胁迫;;紫花苜蓿;基因表达调控
0 引言
【研究意义】南方酸性土壤氮磷等养分缺乏、离子不平衡和活性铝含量较高等特点,是限制农作物生长的主要非生物逆境胁迫因素之一[1]。紫花苜蓿作为“饲草之王”在贵州地区适应性较差,是草畜产业发展的主要限制性因素之一。同时,由于贵州地区生态气候的多样性,孕育了丰富的植物种质资源,其中,有许多资源能够适应当地的酸铝土壤环境。研究并开发利用地方种质资源的功能基因,对酸铝胁迫敏感农作物品种进行遗传改良以培育南方适应性强的作物品种(如紫花苜蓿等)有一定的指导意义。【前人研究进展】酸铝胁迫对植物生长发育的抑制作用在多个植物中被报道,分别涉及植物形态、生理和基因表达等多个不同方面。酸铝胁迫早期直接的性状是抑制植物根系伸长,根部的根冠、分生组织、伸长区细胞、根毛和分枝形成点等细胞受铝离子毒害最严重[2]。铝离子通过靶定到细胞表面的结合位点,导致细胞壁、细胞膜和信号转导等细胞结构和功能紊乱[3]。目前,已报道铝离子主要通过3条途径对根系产生毒害,首先是增强铁离子介导的膜脂氧化导致细胞膜完整性下降;其次是通过扰乱线粒体正常功能导致活性氧类物质含量增加;再次是上调液泡加工酶的活性,导致液泡解体进而影响膜脂的完整性[4]。相关结果在动物细胞中也有类似的报道,在铝离子敏感细胞系PC12中外源施加甘草酸能通过增强线粒体基因的表达,增加细胞内抗氧化酶活性,缓解了铝离子对细胞膜的毒害作用[5]。植物细胞周期也受铝离子毒害的影响。JASKOWIAK等[6]研究表明在大麦()中,铝离子毒害能够显著抑制根尖细胞的有丝分裂活性,并伴随有微核和损伤的核出现,铝离子对细胞周期的伤害主要集中在S期和G2/M期。ZHANG等[7]研究表明在拟南芥()中,铝离子对植物根系伸长的抑制作用依赖于细胞周期调控基因和等基因介导的调控途径。另外,还发现多种方法可以缓解铝离子的毒害作用。RIAZ等[8]研究表明外源施加硼元素能够通过调节抗氧化酶活性、脯氨酸含量、次生代谢物等缓解酸铝胁迫对枸橘()的毒害作用。TENG等[9]在2个对铝离子耐受能力不同的桉树()无性克隆系中,通过施加磷肥能够减少铝离子的毒害作用,磷元素主要通过将有害的铝离子固定在植物的根部,以及增加植物根系向土壤分泌有机酸的量来缓解铝离子对植物的伤害,在耐受性强的无性系植株中铝离子在根系中富集,不向叶片中转运,而铝离子敏感的植株中呈现相反的趋势。ZHU等[10]通过外源施加硫化氢能够显著缓解铝离子对水稻()根系的伤害,通过增加根系柠檬酸的分泌量以及减少根系细胞壁中的果胶和半纤维素的含量,增强植物对酸铝胁迫耐受性,此外,超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)的活性增加,苯二醛(malondialdehyde,MDA)和H2O2的含量减低。通过突变体等多种技术手段,许多铝离子毒害的调控基因已被发现。细胞壁是保护植物细胞的第一道屏障,在缓解铝离子毒害中起十分重要的作用,水稻OsSTAR1/OsSTAR2蛋白复合体能够向细胞壁中分泌尿苷二磷酸葡萄糖,改变细胞壁的组成,减弱铝离子对细胞的毒害作用[11]。细胞膜上有许多离子转运蛋白和水通道蛋白,在调节铝离子毒害过程中起至关重要的作用,最著名的是Al-activated malate transporter(ALMT)家族和multidrug and toxic compound extrusion(MATE)家族基因[12-13],它们通过分泌有机酸将活性铝离子熬合成无毒的复合物阻止铝离子进入细胞[14],除了这两个转运蛋白家族外,NRAMs[15]、ABC转运蛋白[11]和水通道蛋白[16]也参与铝离子毒害的调节过程。【本研究切入点】在这些膜蛋白中,MATE家族基因在高粱()[13]、大麦[12]、拟南芥[17]、水稻[18]多个植物物种的功能高度保守,参与铝离子毒害的调控过程。然而在芥菜中的功能还没有报道。【拟解决的关键问题】本研究拟通过转基因技术将乡土资源中的重要功能基因转化到生产上亟需的牧草品种紫花苜蓿中,比较转基因植株在正常、酸胁迫、铝离子胁迫和酸铝组合胁迫条件下的表型、生理生化以及基因调控网络分析,对功能进行了鉴定与研究,为进一步剖析家族基因在酸铝胁迫下的分子作用机制提供有价值的参考,并为紫花苜蓿分子遗传改良及转基因新品种的培育提供重要的候选功能基因。
1 材料与方法
1.1 材料
芥菜型油菜种质资源平坝苦油菜(Pingba bitter rape)是由贵州省农业科学院油料研究所饶勇馈赠。紫花苜蓿品种中苜1号(Zhongmu 1#)由中国农业科学院北京畜牧兽医研究所高洪文团队馈赠,哥伦比亚型野生型拟南芥(Col-0)从ABRC购买。所有植物都在人工气候室中培养,其生长条件参考Li等[19]方法,具体参数如下:温度为22℃,湿度为60%,光照强度为230—300 μE·m-2·s-1,光周期为16 h光照/8 h黑暗,试验于2015—2018年在贵州省草业研究所完成。
1.2 紫花苜蓿和拟南芥的遗传转化
将贵州省草业研究所紫花苜蓿遗传改良项目组前期构建的过量表达载体分别通过组织培养和花器官浸泡法转化到紫花苜蓿和拟南芥中。
采用农杆菌介导转化愈伤组织的方法转化紫花苜蓿,用酒精和市售84对紫花苜蓿中苜1号种子各消毒1 min,并用无菌水清洗3—4次;在光照培养箱中培养15—20 d,将新生叶片切成2—4 mm2的小块备用;用MS液体培养基+30%蔗糖+100 μmol·L-1AS悬浮农杆菌细胞,然后侵染外植体10—30 min,共培养2—3 d(MS+2 mmol·L-1TDZ+1 mmol·L-16BA);在分化培养基(MS+2 mmol·L-1TDZ+1 mmol·L-16BA+50 mg·L-1Km+150 mg·L-1Cr)中培养30—45 d,每10—15 d继代一次,挑出心形胚和鱼雷形胚到分化培养基(MS + 2 mmol·L-1KT + 1 mmol·L-1IAA + 50 mg·L-1Km + 150 mg·L-1Cr)至分化成苗,每10—15 d继代一次;将再生植株移栽到生根培养基(MS + 1 mmol·L-1NAA + 50 mg·L-1Km + 150 mg·L-1Cr)进行生根培养。将长成的苜蓿幼苗移栽到营养土中炼苗7—10 d后,移栽隔离棚。
参考李小冬等[20]方法转化拟南芥。
1.3 转基因紫花苜蓿和转基因拟南芥的基因组水平鉴定
分别采用CTAB法和Edwards DNA快速提取法提取紫花苜蓿和拟南芥的DNA[21]。利用PCR法分别对插入片段的位点和+R引物组合进行转基因植物的分子检测(表1)。PCR反应体系为2×Taq PCR Mixture(生物工程(上海)股份有限公司)10 μL、正向引物(10 mmol·L-1)1 μL、反向引物(10 mmol·L-1)1 μL、dd H2O 6μL和DNA 2 μL。反应程序为94℃ 3 min;94℃ 30 s,58℃ 45 s,72℃ 1 min 30 s,30 cycles;72℃ 5 min。1%琼脂糖凝胶电泳检测。
1.4 RNA提取与反转录
分别取100 mg转基因紫花苜蓿和转基因拟南芥生长7 d的幼苗(包括根),采用TRIZOLTMKit RNA提取试剂(Invitrogen,USA)参照说明书提取植物总RNA[21],根据MBI公司的RevertAid H Minus First Strand cDNA Synthesis Kit(Fermentas)反转录cDNA第一链合成试剂盒说明书进行反转录试验。采用qRT-PCR方法分析转基因紫花苜蓿和转基因拟南芥中的表达量。反应体系为2×SYBR Green Realtime PCR Master Mix plus(TOYUBO,QPK-212)、正向引物(10 mmol·L-1)1 μL、反向引物(10 mmol·L-1)1 μL、10倍稀释的cDNA模板2 μL和ddH2O 6 μL。反应程序为94℃ 2 min;94℃ 15 s,58℃ 15 s,72℃ 30 s,45个循环;72℃ 5 min,25℃ 5 min。采用2-ΔΔct方法分析的表达情况,每个样品3个生物学重复,每个生物学重复3个技术重复。内参基因为(拟南芥)和(紫花苜蓿)。
1.5 酸铝胁迫处理及表型观察
采用水培法进行酸铝胁迫处理。
发芽试验:挑选大小一致的转基因紫花苜蓿和对照中苜1号种子,分成4组,每组30粒,对照组用正常Hoagland全营养培养液(1.25 mmol·L-1KNO3、1.25 mmol·L-1Ca(NO3)2·4H2O、0.5 mmol·L-1MgSO4·7H2O、0.25 mmol·L-1KH2(PO4)、11.6 µmol·L-1H3BO3、4.6 µmol·L-1MnCl2·4H2O、0.19 µmol·L-1ZnSO4·7H2O、0.12 µmol·L-1Na2MoO4·2H2O、0.08 µmol·L-1CuSO4·5H2O和10 µmol·L-1Fe(III)-EDTA,NaOH调pH7.0)培养。酸处理组为Hoagland全营养培养液,且HCl调pH4.5。铝处理组为Hoagland全营养培养液,且加入100 mg·L-1的硝酸铝,用NaOH调pH7.0。酸铝组合处理为Hoagland全营养培养液,且加入100 mg·L-1的硝酸铝,用HCl调pH4.5。在人工气候室中胁迫处理7 d,统计各材料的发芽率,并测量幼苗的根长。
幼苗处理试验:挑选生长整齐一致的幼苗分别在减弱的酸铝胁迫强度下进行处理,对照组仍为正常的Hoagland全营养培养液(pH7.0);酸处理组为Hoagland全营养培养液(pH5.5);铝离子处理组为Hoagland全营养培养液,加入50 mg·L-1的硝酸铝(pH7.0);酸铝组合组为Hoagland全营养培养液,加入50 mg·L-1的硝酸铝(pH5.5)。胁迫处理20 d后测量株高、地上部分鲜重和根长。
1.6 抗氧化酶活性的测定
采取胁迫处理后的紫花苜蓿根系样品,采用南京建成POD测定试剂盒(A084-3)测定POD活性,采用碧云天SOD活性检测试剂盒(S0102)和CAT检测试剂盒(S0055)测定SOD和CAT活性,采用试剂盒(Solarbio,BC0025)测定MDA含量。
1.7 相关基因的表达分析
根据1.3和1.4方法进行转基因植株中相关基因的qRT-PCR分析。
1.8 数据分析
采用测验分析表达差异显著性,阈值设为<0.05,采用Excel 2010与Power Point 2010作图。
2 结果
2.1 BjMATE的遗传转化与转基因植株的筛选鉴定
分别采用组织培养和花器官浸泡方法对紫花苜蓿和拟南芥进行遗传转化,利用卡那霉素筛选,共获得15株转紫花苜蓿与24株转拟南芥植株。分别用和的引物对转基因植株进行PCR鉴定,发现转基因拟南芥中2对引物组合的检测阳性率均为100%,而在转基因苜蓿中,检测结果阳性率为100%,+R引物组合阳性植株为10株,阳性率为66.7%(图1-A和图1-B)。
分别挑选转基因株系-、-与-和、-与-进行基因的qRT-PCR分析。所有挑选植株的的表达量均显著上调,与野生型拟南芥相比,-、-和-中分别上调了76.87、67.73和62.68倍。在紫花苜蓿中,、-和-中分别上调了63.02、31.99和58.65倍(图1-C和图1-D)。在后续研究中,以-和为试验材料进行研究。

表1 试验中用到的引物
2.2 酸铝胁迫下35S:BjMATE转基因紫花苜蓿的生长情况
为分析是否具有调节植物耐酸铝胁迫的功能,通过比较分析和对照紫花苜蓿中苜1号在酸、铝离子以及酸铝组合胁迫条件下种子的发芽率和发芽势变化(图2-A和图2-B)。在正常条件下,和中苜1号的发芽率分别为95.3%和96.5%,两者之间没有显著差异。在胁迫条件下,和中苜1号的发芽率为92.3%—96.2%,2种材料之间以及不同处理之间在发芽率上没有显著差异。
通过比较分析和对照中苜1号在酸铝胁迫条件下根系的生长变化。在正常条件下,和对照中苜1号根系长度分别为6.33和6.23 cm,差异不显著(图2-A和图2-C)。胁迫处理后,和中苜1号根系长度显著受到抑制,但材料间和处理间存在不同的变化。与正常条件相比,在酸胁迫条件下,根长为5.30 cm,下降16.3%;中苜1号根长为5.07 cm,下降18.7%,但在与中苜1号之间差异不显著(>0.05)(图2-A和图2-C)。在铝离子胁迫条件下,与中苜1号根系长度分别为3.97和3.23 cm,分别下降37.3%和48.1%,在2个材料间差异显著(<0.05)。与铝离子胁迫类似,在酸铝组和胁迫条件下,与中苜1号根系长度分别为3.37和2.87 cm,分别下降46.8%和54.0%,2个材料间差异显著(<0.05,图2-A和图2-C)。
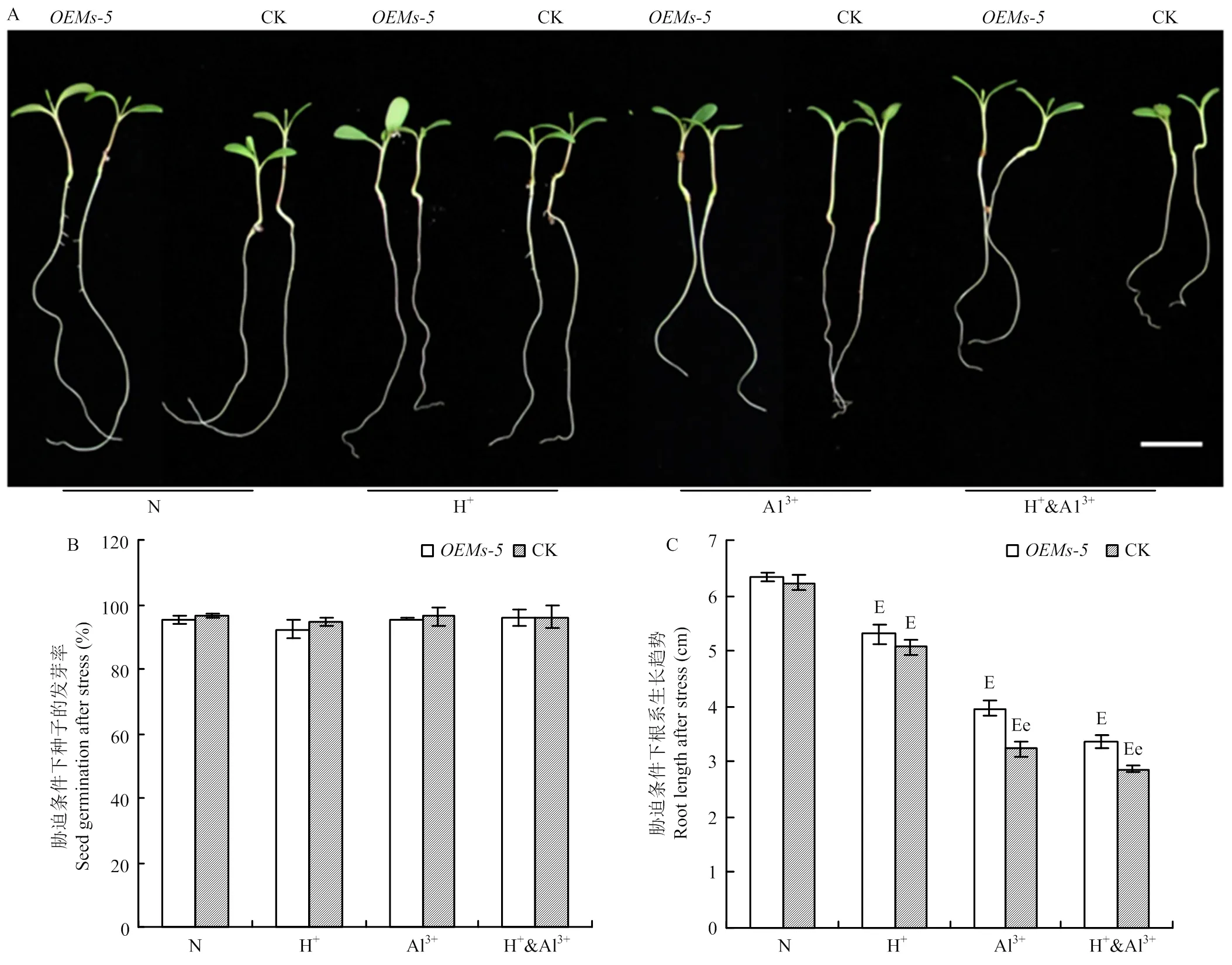
A:胁迫处理后紫花苜蓿种子萌发后根系伸长情况,Bar=1 cm;B:胁迫条件下种子发芽率;C:胁迫条件下不同紫花苜蓿材料幼苗根长的变化。e表示OEMs-5和中苜1号在p<0.05水平差异显著,E表示同一种材料在胁迫处理和正常条件之间在p<0.05水平差异显著。下同
为进一步分析调节植物应答酸铝胁迫的功能,在长时间减弱的酸铝胁迫条件下,比较分析和对照中苜1号紫花苜蓿幼苗的地上部分和地下部分的变化。在正常、酸胁迫、铝离子胁迫和酸铝组合胁迫条件下,和对照中苜1号株高在5.0—5.8 cm,材料间和处理间均没有显著差异(图3-A和图3-B)。在正常条件下,和中苜1号的单株产量分别为0.42和0.41 g,二者差异不显著(图3-A和图3-C)。在胁迫条件下,虽然植株株高没有变化,但生物产量变化趋势不尽相同。在酸胁迫条件下,和中苜1号的单株生物产量都为0.35 g,与正常条件相比,分别下降18.5%与14.1%,但两者差异不显著(图3-A和图3-C)。在铝离子胁迫条件下,和中苜1号的单株生物产量分别为0.36 和0.32 g,分别下降14.8%和20.5%,显著优于中苜1号(图3-A和图3-C)。在酸铝组合胁迫条件下,的生物产量为0.34 g,下降19.5%,显著优于中苜1号(0.30 g,下降26.1%),2个材料间的变化趋势与铝离子胁迫类似(图3-A和图3-C)。

A:胁迫处理后紫花苜蓿幼苗生长情况,Bar=1 cm;B:胁迫条件下株高的变化;C:胁迫条件下紫花苜蓿幼苗地上部分生物量的变化。D:胁迫条件下紫花苜蓿幼苗根长的变化
地下部分的变化趋势要比地上部分更加显著。胁迫处理后的根系长度变化与地上部分类似,在正常条件和酸胁迫条件下,和中苜1号的根长在14.7—16.2 cm,均没有显著差异(图3-A和图3-D)。铝离子和酸铝组合胁迫后,和中苜1号的根长都受到抑制,但受抑制程度不相同。铝离子胁迫后,根长为15.1 cm,根长比正常条件减少6.8%,显著优于中苜1号(12.6 cm,减少17.6%)。酸铝组合胁迫对根系伸长的抑制效果更加明显,和中苜1号的根长分别为12.8和11.2 cm,下降12.9%和24.8%,材料间和处理间的差异都达显著水平(图3-A和图3-D)。
2.3 酸铝胁迫条件下35S:BjMATE转基因紫花苜蓿的生理变化
和中苜1号在酸、铝离子以及酸铝组胁迫条件下的表型和生物产量有显著差异,为分析导致差异的原因,比较分析2个材料在胁迫条件下的抗氧化酶活性的变化。在正常条件下,和中苜1号植株中POD、SOD、CAT的活性和MDA含量都没有显著区别(图4)。酸胁迫后,与正常条件相比,SOD的活性在和中苜1号中都显著升高,但它们之间差异不显著(图4-B),POD、CAT的活性和MDA的含量在材料间和处理间都没有显著差异(图4)。铝离子胁迫后,各酶活的变化趋势不相同。与正常条件相比,POD和SOD活性在中和中苜1号均有升高,但只有SOD在两材料间差异显著(图4-A和图4-B)。CAT的活性在处理间和材料间没有显著区别(图4-C)。MDA的含量略有下降,但差异不显著(图4-D)。在酸铝组合胁迫条件下,POD、SOD和CAT的活性在和中苜1号的变化趋势与铝离子胁迫相同(图4-A—图4-C),与正常条件相比,MDA的含量在中苜1号中下降,而在没有显著变化,与中苜1号的差异达显著水平(图4-D)。

A—D:胁迫处理后紫花苜蓿POD(A)、SOD(B)、CAT(C)和MDA(D)的变化
2.4 酸铝胁迫调节关键基因在下35S:BjMATE转基因拟南芥中的表达变化
因为紫花苜蓿基因组较大较复杂,其酸铝调控网络研究不如模式植物拟南芥深入;此外,来源于芥菜基因组,与拟南芥同源性更高,因此,以和野生型拟南芥为研究对象,通过比较酸铝调节途径上重要功能基因在酸铝胁迫条件下的表达变化,发现在正常和胁迫条件下的野生拟南芥中检测不到的表达,而在植株中一直表现为高丰度表达,说明材料中一直被过量表达(图5-A)。正常条件下,在和野生型拟南芥中、、与的表达差异显著,而在植株中显著被诱导表达,为野生型植株表达量的2.63倍(图5-B)。在酸胁迫条件下,与正常条件相比,、与的表达差异不显著,而与上调表达,但在和野生型之间差异不显著(图5-B)。在铝离子胁迫条件下,所有挑选的基因都被显著诱导,其中,、、与的表达在和野生型拟南芥材料间没有显著差异,而在两材料间差异显著(图5-B)。酸铝组合胁迫条件下各基因的变化趋势与铝离子单独胁迫相似(图5-B)。
3 讨论
3.1 BjMATE为功能保守的酸铝胁迫调节基因
酸性土壤面积分布广而且对作物生产限制大,铝离子毒害是酸性土壤的首要限制性因素。当pH低于5时,以活性的Al3+形式存在的铝元素在土壤中的含量显著增加,能够在数分钟之内抑制植物根系生长,随后导致植物根系和营养缺乏[22]。前人研究发现,单独的酸胁迫就能够导致植物根系生长受抑制[23-24],在本研究中,转基因和中苜1号紫花苜蓿在单独的酸胁迫条件下,根系伸长受抑制程度与正常条件差异不显著,可能与减弱的酸胁迫条件有关。而在铝离子胁迫和酸铝组合胁迫条件下,无论是在萌发后的幼苗还是长时间弱酸铝胁迫后植株的根系生长都显著受到抑制,而且在和中苜1号之间也具有显著差异。除此之外,转基因和中苜1号紫花苜蓿的地上部分生物产量也发生显著的变化,但的生物产量显著高于中苜1号,并且相同材料在不同的组合处理之间也具有显著差异。说明对紫花苜蓿酸铝胁迫的调节作用的功能的保守性较高。
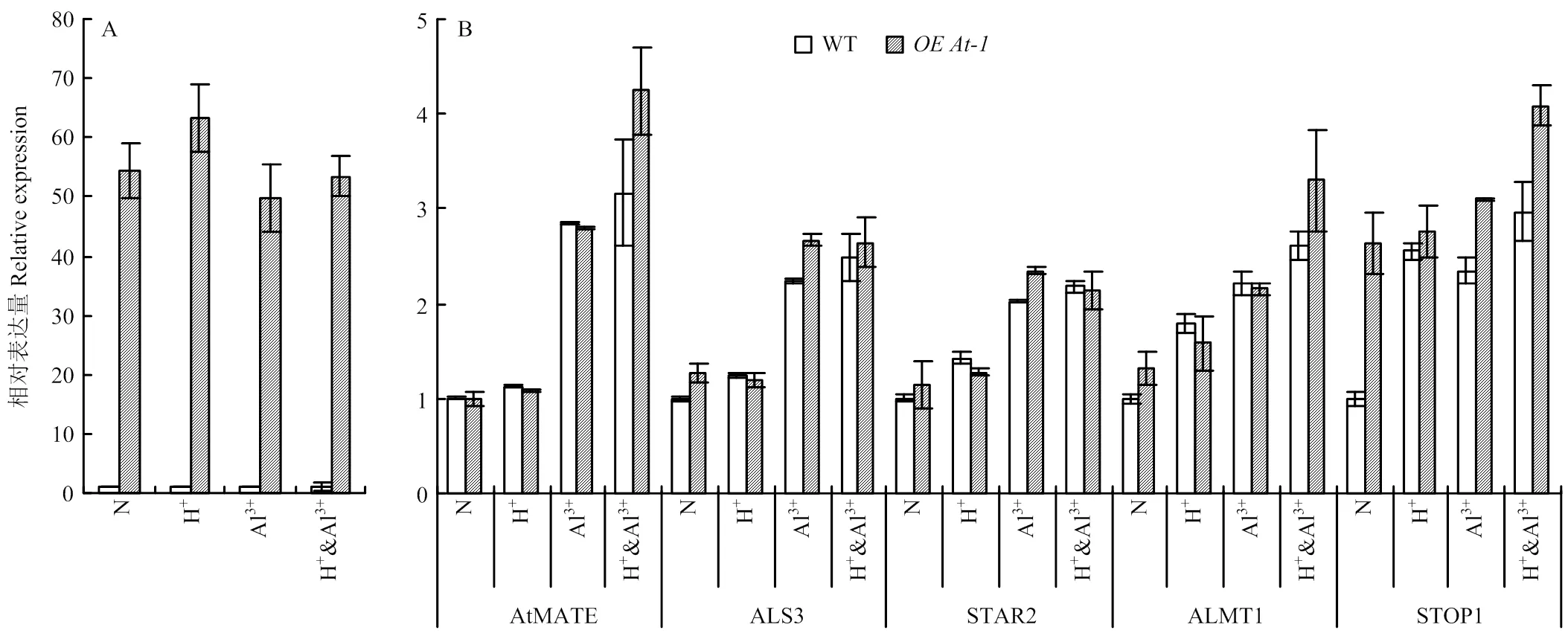
A:BjMATE在正常(N)、酸(H+)、铝(Al3+)和酸铝组合胁迫(H+ & Al3+)后的OEAt-1中的表达分析;B:拟南芥中酸铝胁迫标志性基因在正常、酸、铝和酸铝组合胁迫后的OEAt-1中的表达分析
3.2 SOD的活性在BjMATE介导的抗酸铝胁迫调节中起重要作用
铝离子抑制植物根系伸长的主要机制之一是扰乱线粒体的正常功能,导致细胞内的活性氧物质含量增加。在水稻中铝离子毒害能够整体的显著增加细胞内抗氧化酶活性[10],本研究发现紫花苜蓿在胁迫处理之后SOD、POD活性增加,而CAT的活性没有显著变化。尽管与水稻中结果不一致,但总体的趋势是吻合的,在水稻中,SOD、POD活性增加的幅度比CAT的要更剧烈[10]。因为铝离子对植物毒害作用受很多因素的影响,包括培养基、pH、Al3+浓度、处理的时期和时间等。因此,本研究中CAT的活性与水稻中的变化趋势不一致,可能是由于物种差异、酸铝胁迫处理方式或胁迫处理时间等因素造成。在本研究中,除了SOD的活性外,抗氧化酶的活性在处理之间差异显著,但在和中苜1号之间差异不显著。中SOD的活性在铝离子胁迫和酸铝组合胁迫条件下显著高于中苜1号,说明过SOD调控途径可能在介导的酸铝胁迫调节途径中起重要作用。
3.3 STOP1可能参与BjMATE介导的抗酸铝胁迫调节
作物遗传改良是减少酸性土壤中铝离子对植物细胞伤害的主要的方法之一。铝离子胁迫能够诱导多个基因的表达,本研究中,以及挑选的、等基因都不同程度地受到酸、铝离子和酸铝组合胁迫的诱导,相应结果与前人结果一致[17]。AtSTOP1转录因子位于MATE的上游,能够调节多个铝离子耐受基因和酸胁迫耐受基因表达[17,25]。与生理变化类似,除以外,挑选酸铝调节的标志性基因在胁迫处理之间差异显著,但在和中苜1号之间差异不显著,说明与挑选的、等基因处于平行的酸铝胁迫调控途径。在株系中,在酸铝胁迫和正常条件下的表达量显著高于对照中苜1号,说明的上调表达可能通过某种未知的调解途径正向反馈调节的表达,或者这种现象是由芥菜的特性造成,因为不同物种的同源基因的功能具有相似性,同时也有物种的特异性。在拟南芥中,能够同时调控酸胁迫和铝胁迫相关基因的表达;但在水稻中,只调节铝离子耐受基因的表达,不参与酸胁迫调控[26],更深入的结果还有待后续研究。
4 结论
在紫花苜蓿中,过量表达显著提高转基因植物在种子萌发和幼苗生长阶段对酸铝耐胁迫的耐受性。抗氧化酶的活性受酸铝胁迫处理诱导,其中SOD活性在介导的抗酸铝胁迫调节中起重要作用。在中,酸铝胁迫调控的标志性基因1可能与之间存在一个正反馈调节,通过某种未知的途径与互作调控植物对酸铝胁迫的应答。
[1] 郭彦军, 黄建国. 酸性紫色土上紫花苜蓿的结瘤性能与养分吸收. 植物营养与肥料学报, 2006, 12(1): 97-103.
GUO Y J, HUANG J G. Nutrients absorption and nodulation ability of alfalfa in acid purple soil., 2006, 12(1): 97-103. (in Chinese)
[2] VITORELLO V A, CAPALDI F R, STEFANUTO V A. Recent advances in aluminum toxicity and resistance in higher plants., 2005, 17(1): 129-143.
[3] JIAN F M. Syndrome of aluminum toxicity and diversity of aluminum resistance in higher plants., 2007, 264: 225-252.
[4] YAMAMOTO Y. Aluminum toxicity in plant cells: Mechanisms of cell death and inhibition of cell elongation., 2019, 65(1): 41-55.
[5] RASHEDINIA M, SABERZADEH J, BAKHTIARI TK, HOZHABRI S, ARABSOLGHAR R. Glycyrrhizic acid ameliorates mitochondrial function and biogenesis against aluminum toxicity in PC12 cells., 2019, 35(3): 584-593.
[6] JASKOWIAK J, TKACZYK O, SLOTA M, KWASNIEWSKA J, SZAREJKO I. Analysis of aluminum toxicity inroots with an emphasis on DNA integrity and cell cycle., 2018, 13(2): e0193156.
[7] ZHANG Y, GUO J, CHEN M, LI L, WANG L, HUANG C F. The cell cycle checkpoint regulatoris required for internal aluminum toxicity-mediated root growth inhibition in., 2018,9: 118.
[8] RIAZ M, YAN L, WU X, HUSSAIN S, AZIZ O, WANG Y, IMRAN M, JIANG C. Boron alleviates the aluminum toxicity inby regulating antioxidant defense system and reducing root cell injury., 2018, 208: 149-158.
[9] TENG W C, KANG Y C, HOU W J, HU H Z, LUO W J, WEI J, WANG, L H, ZHANG, B Y. Phosphorus application reduces aluminum toxicity in twoclones by increasing its accumulation in roots and decreasing its content in leaves., 2018, 13(1): e0190900.
[10] ZHU C Q, ZHANG J H, SUN L M, ZHU L F, ABLIZ B, HU, W J, ZHONG C, BAI Z G, SAJID H, CAO, X C. Hydrogen sulfide alleviates aluminum toxicity via decreasing apoplast and symplast al contents in rice., 2018, 9: 294.
[11] FENG H C, NAOKI Y, NAMIKI M, MASAHIRO Y, YOSHIAKI N, FENG M J. A bacterial-type ABC transporter is involved in aluminum tolerance in rice., 2009, 21(2): 655-667.
[12] JUN F, NAOKI Y, HUA W, NAMIKI M, YOSHIKO M, KAZUHIRO S, MAKI K, KAZUYOSHI T, FENG M J. An aluminum-activated citrate transporter in barley., 2007, 48(8): 1081-1091.
[13] MAGALHAES J V, JIPING L, GUIMARES C T, LANA U G P, ALVES V M C, WANG Y H, SCHAFFERT R E, HOEKENGA O A, PIEROS M A, SHAFF J E. A gene in the() family confers aluminum tolerance in sorghum., 2007, 39(9): 1156-1161.
[14] KOCHIAN L V, PIEROS M A, JIPING L, MAGALHAES J V. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance., 2015, 66(1): 571-598.
[15] LI J Y, LIU JIPING, DONG DK, JIA XM, MCCOUCH S R, KOCHIAN L V. Natural variation underlies alterations inaluminum transporter () expression and function that play a key role in rice aluminum tolerance., 2014,111(17): 6503-6508.
[16] NEGISHI T, OSHIMA K, HATTORI M, KANAI M, MANO S, NISHIMURA M, YOSHIDA K. Tonoplast-and plasma membrane- localized aquaporin-family transporters in blue hydrangea sepals of aluminum hyperaccumulating plant., 2012, 7(8): e43189.
[17] JIPING L, MAGALHAES J V, JON S, KOCHIAN L V. Aluminum- activated citrate and malate transporters from theandfamilies function independently to conferaluminum tolerance., 2010, 57(3): 389-399.
[18] KENGO Y, NAOKI Y, FENG M J. An Al-induciblegene is involved in external detoxification of Al in rice., 2011, 68(6): 1061-1069.
[19] LI X D, WANG X L, CAI Y M, WU J H, MO B T, YU E R.() and() function in the same heat regulation pathway., 2017, 39(3): 67-76.
[20] 李小冬, 莫本田, 牟琼, 娄芬, 陈文贵, 陈光吉, 张瑜, 韩永芬. 紫花苜蓿高温诱导启动子的克隆与功能分析. 草业学报, 2019, 28(1): 128-137.
LI X D, MO B T, MOU Q, LOU F, CHEN W G, CHEN G J, ZHANG Y, HAN Y F. Cloning and function ananlysis of the high temperature inducible promoterin alfalfa ()., 2019, 28(1): 128-137. (in Chinese)
[21] 李小冬. 拟南芥IKU2互作蛋白鉴定及同源四倍体分析[D]. 武汉: 华中农业大学, 2012.
LI X D. Screening ofIKU2 interacting proteins and analysis of an autotetraploid[D]. Wuhan: Huazhong Agriculture University, 2012. (in Chinese)
[22] BOJÓRQUEZ-QUINTAL E, ESCALANTE-MAGAÑA C, ECHEVARRÍA- MACHADO I, MARTÍNEZ-ESTÉVEZ M. Aluminum, a friend or foe of higher plants in acid soils., 2017, 8: 1-18.
[23] MONSHAUSEN G B, BIBIKOVA T N, MESSERLI M A, SHI C, GILROY S. Oscillations in extracellular pH and reactive oxygen species modulate tip growth ofroot hairs., 2007, 104(52): 20996-21001.
[24] JIAN L Y, SHAO J Z, YUN F H, MATSUMOTO H. Aluminium resistance requires resistance to acid stress: a case study with spinach that exudes oxalate rapidly when exposed to Al stress., 2005, 56(414): 1197-1203.
[25] SAWAKI Y, IUCHI S, KOBAYASHI Y, KOBAYASHI Y, IKKA T, Sakurai N, Fujita M, Shinozaki K, Shibata D, Kobayashi M.regulates multiple genes that protectfrom proton and aluminum toxicities., 2009, 150(1): 281-294.
[26] NAOKI Y, FENG H C, SAKIKO N, MASAHIRO Y, YUTAKA S, YOSHIAKI N, FENG M J. A zinc finger transcription factorregulates multiple genes implicated in aluminum tolerance in rice., 2009, 21(10): 3339-3349.
The Mechanism of Ectopic Expression of() to Enhance the Resistance to Acid and Aluminum Stress in Alfalfa
LI XiaoDong1,2, SHANG YiShun1, LI ShiGe1,2, CHEN GuangJi1,2, PEI ChengJiang1,2, SUN Fang1, XIONG XianQin1
(1Guizhou Institute of Prataculture, Guizhou Academy of Agricultural Science, Guiyang 550006;2Guizhou Dingxin Agriculture and Animal Husbandry Technology co. ltd, Guiyang 550006)
【】 Acid and aluminum stress is one of the major environmental stresses in agricultural production in the south of China. Studying the mechanism of native plants adaptation to acid and aluminum stress, and identifying and making use of the excellent gene resources would benefit to breed new varieties of acid and aluminum resistant crops, that will play a fundamental role in molecular breeding of alfalfa. 【】In previous study, full length ofwas cloned from Pingba bitter rape, a nativeresource in Guizhou province, and the overexpression vector was constructed by the alfalfa genetic improvement group of Guizhou Institute of Prataculture. The transgenic plants of alfalfa andwere obtained by tissue culture and flower dipping methods, respectively. Molecular examination was carried out with NPT resistance gene primers and gene-specific primers; and the expression ofin transgenic plants was examined by qRT-PCR. The germination rate and seedling growth of transgenic and control alfalfa lines were analyzed by hydroponic method under acid, aluminum and acid aluminum combination stress conditions. The alteration of the seedling and root growth was also analyzed between transgenic and Zhongmu 1# alfalfa under a long term but weaker acid-aluminum stress condition. Antioxidant enzyme activity, including POD, SOD, CAT, and MDA concentration alterations betweenandZhongmu 1# were analyzed with microplate reader under acid, aluminum and acid-aluminum combined stress conditions. At the same time, expression changes of,,,,andwhich were key genes involving in acid aluminum regulation pathways, were analyzed in the model plantby qRT-PCR, and potential regulation network were discussed. 【】 The positive rates of transgenicand alfalfa were 100% and 66.7%, respectively. Compared with the control lines, the expression levels of the candidate transgenic alfalfa andlines were up-regulated by 63.02 and 76.87 times, respectively. There was no significant difference in seed germination rate betweenand Zhongmu 1# under normal, acid stress, aluminum ion stress and acid-aluminum combination stress conditions. While the germination potential was significantly different among the treatments, as well as the materials,was significantly better than Zhongmu 1#. After a long-term weak stress treatment, the plant height ofwas not significantly different from that of Zhongmu 1#; but the biomass and root length ofwas significantly better than that of Zhongmu 1# under aluminum stress and acid-aluminum combined stress conditions. Antioxidant enzyme activity and MDA concentration alterations betweenand Zhongmu 1# were different. POD and SOD activity increased in bothand Zhongmu 1# after stress treatment, however, significant difference was only detected in SOD assay. No significant difference in CAT activity was detected between the two materials, and the treatments. The content of MDA decreased slightly, significant differences were detected betweenand Zhongmu 1# under aluminum stress and acid-aluminum combined stress conditions. Expressions of,andwere up-regulated under aluminum stress and acid-aluminum combined stress in bothand Zhongmu 1#, however, no significant difference were detected between them except.【】can positively regulate alfalfa tolerance to acid-aluminum stress during seed germination and seedling growth stages. Reactive oxygen species (ROS) scavenger system, especially the activity of SOD, andgene which is a key gene involving in acid-aluminum stress regulation pathway, may participate inmediated acid-aluminum stress regulation.
acid aluminum stress;; alfalfa; gene expression regulation
10.3864/j.issn.0578-1752.2020.01.002

2019-06-03;
2019-09-10
国家自然科学基金(31960345)、贵州省科学技术基金(黔科合J字[2015]2080号)、贵州省科研机构服务企业行动计划(黔科合服企[2018]4001号)、贵州省农业科学院院专项基金(黔农科院院专项[2013]003号)、贵州省科研机构创新能力建设专项资金项目(黔科合服企[2019]4010号)
李小冬,E-mail:lixiaodongzl@163.com。通信作者尚以顺,E-mail:2892486467@qq.com
(责任编辑 李莉)

