瓜蒂水提物和醇提物对食管癌TE-1、EC-1细胞的增殖、迁移、克隆形成的影响及机制研究
赵雯宇 司富春


中图分类号 R73 5.1;R965
文献标志码A
文章编号1001-0408(2020)03-0314-07
DOI 10.6039/j.issn.1001-0408.2020.03.12
摘要 目的:研究瓜蒂水提物和醇提物对食管癌TE-1、EC-1细胞增殖、迁移、克隆形成的影响及作用机制。方法:体外培养TE-1、EC-1细胞,分别加入质量浓度均为0、1.5625、3.125、6.25、12.5、25、50、100、200μg/mL的瓜蒂水提物或醇提物(以提取物粉末計)进行培养,采用MTT法检测细胞的生长抑制率并计算半数抑制浓度(IC50)。将TE-1、EC-1细胞分为TE-1/EC-1空白组、TE-1/EC-1瓜蒂水提物组(药液浓度均为ICso)、TE-1/EC-1瓜蒂醇提物组(药液浓度均为ICso),采用实时无标记细胞分析(RTCA)法检测各组细胞的增殖与迁移,绘制细胞增殖、迁移曲线;采用显微镜观察各组细胞形态学的变化;采用软琼脂克隆形成试验分析各组细胞克隆形成能力的变化,并计算细胞克隆形成率;采用流式细胞仪检测各组细胞的细胞周期、凋亡率;采用Western blotting检测各组细胞表皮生长因子受体(EGFR)、蛋白激酶C-a(PKC-a)的相对表达量。结果:瓜蒂水提物作用于TE-1、EC-1细胞的ICso分别为49.24、76.38μg/mL,瓜蒂醇提物作用于TE-1、EC-1细胞ICs。分别为9.08、14.53μg/mL;瓜蒂水提物和醇提物加药后30h内对细胞有增殖抑制作用;瓜蒂水提物和醇提物加药后60 h内对细胞有迁移抑制作用。与TE-1/EC-1空白组比较,各加药组细胞数量明显减少,细胞结构松散,多数细胞轮廓消失、变圆等;细胞克隆形成率显著下降(P<0.Ol);G2期细胞百分率显著升高( P<0.01),G1期、S期细胞百分率显著降低(P<0.05);早、晚期凋亡率均显著增加(P<0.05);EGFR、PKC-a蛋白相对表达量显著降低(P<0.01)。与TE-1/EC-1瓜蒂水提物组比较,TE-1/EC-1瓜蒂醇提物组细胞克隆形成率显著下降(P<0.05);G2期细胞率显著升高(P<0.05);EGFR、PKC-a蛋白相对表达量显著降低(P<0.01);TE-1瓜蒂醇提物组早、晚期细胞凋亡率显著降低(JP<0.05);EC-1瓜蒂醇提物组早、晚期细胞凋亡率显著升高(P<0.05)。结论:瓜蒂水提物和醇提物可影响TE-1、EC-1细胞增殖、迁移、克隆形成的能力,促进细胞凋亡,其作用机制可能与下调EGFR、PKC-a蛋白有关。关键词瓜蒂;食管癌;水提物;醇提物;细胞增殖;细胞迁移;克隆形成;作用机制
食管癌是全球十大癌症之一,2018年新增病例572000例,死亡率居全球第6位,5年生存率低于20% [1-2],其中亚洲是食管癌的高发区[3]。由于对食管癌发病机制的认识有限,目前缺乏特异性的临床诊断指标,加之其早期症状不典型,故大部分患者确诊时已处于中晚期,错失了手术机会;而且临床化疗副作用较大,化疗耐药不断出现,致使化疗效果欠佳[4]。虽然近几年出现了针对表皮生长因子受体(EGFR)、程序性细胞死亡蛋白1通路(PDl-PDL1)等的靶向治疗方法[5-6],但肿瘤的发生发展涉及多阶段、多个基因及多条信号通路的异常,机制复杂,致使靶向药物的研发和应用也受到限制,大部分食管癌患者仍然不能得到有效的治疗[7]。
为寻找抗肿瘤作用的有效新药,本课题组前期以人食管癌细胞为模型,做了大量的中药方剂筛选,发现《伤寒论》中瓜蒂散水提物能够明显抑制食管癌细胞增殖[8]。瓜蒂是葫芦科植物甜瓜(Cucumis melo L)的果蒂,其性味苦寒有毒,归足阳明胃经,具有涌吐痰食、祛湿退黄的功效[9]。有研究发现,瓜蒂水提物、醇提物对人胃腺癌SGC-7901细胞、人肺癌NCI-H460细胞、人肝癌SMMC-7721细胞、人白血病K562细胞及小鼠成纤维细胞L929的增殖有明显抑制作用[10]。其主要成分葫芦素类成分,也具有强大的抗肿瘤作用,同时可以降压、抑制心肌收缩力、减慢心律及抗炎[11-13]。
为了进一步明确瓜蒂抗食管癌细胞的主要成分及机制,笔者研究瓜蒂水提物和醇提物对人食管癌TE-1、EC-1细胞的增殖、迁移、克隆形成、细胞周期、细胞凋亡的影响;同时考察其对细胞EGFR及其下游的中心分子蛋白激酶C-a(PKC-a)蛋白表达的影响,进行初步的分子机制研究,以期为瓜蒂临床应用及新药研发提供参考。
l 材料
1,1 仪器
xCElligence型实时无标记细胞功能分析(RTCA)仪(美国ACEA生物公司);ELx800型酶标仪(美国Bio-Tek公司);RE5299FACSCalibur型流式细胞仪(美国BD公司);BPN-80CW型细胞培养箱(美国Kendro公司);Ax-iovert20型倒置显微镜(德国Zeiss公司)。
1.2 药品与试剂
瓜蒂药材(批号:20103112)购自河南本草国药馆,经河南中医药大学药学院陈随清教授鉴定为真品;RP-MI1640培养基(美国Gibco公司,批号:1877236);胎牛血清(澳大利亚AusGenex公司,批号:FBSSA00518-2);MTT(批号:511C023)、胰蛋白酶(批号:20326B)均购自美国Sigma公司;乙二胺四乙酸(EDTA,批号:0105-1KG)、二甲基亚砜(DMSO,批号:821D036)均购自美国Amresco公司;青霉素干粉(华北制药股份有限公司,批号:H20013036,规格:80万单位);链霉素干粉(山东鲁抗股份有限公司,批号:120913,规格:100万单位);流式细胞周期检测试剂盒(江苏凯基生物技术股份有限公司,批号:KGA511-KGA512);流式细胞凋亡检测试剂盒(杭州联科生物技术股份有限公司,批号:AP101);兔抗EGFR单克隆抗体(批号:GR320346-9)、兔抗PKC-a单克隆抗体(批号:GR316444-6)、兔抗人肌动蛋白β(β-actin)单克隆抗体(批号:GR3176819-2)均购自英国Abcam公司;山羊抗兔免疫球蛋白G(IgG)二抗(北京康为世纪生物科技有限公司,批号:00051405);水为超纯水。
1.3 细胞
人食管癌细胞株TE-1、EC-1为河南中医药大学中医方证信号传导重点实验室保存。
2 方法与结果
2.1 瓜蒂提取物的制备
2.1.1 瓜蒂水提物称取瓜蒂药材20g,加入350mL水浸泡1h,武火煮沸,文火煎煮约1h,放至室温后过滤,55℃旋蒸至药液浓稠,50℃真空干燥48h后刮取药物粉末、称质量,得率为141.2mg/g;取适量瓜蒂水提物粉末用DMSO适量溶解,加水制成质量浓度为300mg/mL的瓜蒂水提物母液(以提取物粉末计,下同),再用培养基稀释成4mg/mL药液,0.22μm滤头过滤除菌,-20℃冰箱保存,备用。
2.1.2 瓜蒂醇提物取瓜蒂药材100g于粉碎机中粉碎,按照1:7(m/V)加入95%乙醇700mL,混匀,避光浸泡7d,每日振荡2次,5min/次;7d后过滤,55℃旋蒸至药液浓稠,50℃真空干燥48h后刮取药物粉末、称质量,得率为52.4mg/g;取适量瓜蒂醇提物粉末按“2.1.1”项下“DMSO溶解……备用”处理,即得。
2.2 细胞培养
将细胞置于37℃、5% CO2培养箱中,用含10%胎牛血清的RPMI1640培养液进行培养。试验时,细胞用含EDTA胰蛋白酶进行消化,接种于直径10cm培养皿或96孔培养板中。
2.3 统计学方法
采用SPSS 21.O软件对数据进行统计分析。计量资料以 ±s表示,多组间比较用单因素方差分析,两组比较采用f检验。以概率法[16]计算半数抑制浓度(IC50)。P<0.05表示差异有统计学意义。
2.4 MTT法检测瓜蒂水提物和醇提物对两种细胞生长的抑制作用
将TE-1、EC-1细胞以5×104个/mL的细胞浓度接种于96孔培养板,于37℃,5% C02条件下贴壁培养24h后加入含有瓜蒂水提物和醇提物的含血清培养基,药液浓度分别为O(空白组)、1.5625、3.125、6.25、12.5、25、50、100、200μg/mL(每个浓度平行3孔),继续培养48h;去除培养上清,每孔加入0.5mg/mL MTT溶液100μL,继续培养4h,弃MTT溶液,然后加入150μL DMSO。用酶标仪于570、630nm波长处分别测定各孔吸光度(OD值),计算两种细胞的生长抑制率(%),细胞生长抑制率=(1-加药组平均OD值)/空白组平均OD值×100%。两种细胞生长抑制率及IC。。测定结果见表1。
2,5 瓜蒂水提物和醇提物对两种细胞增殖、迁移的影响
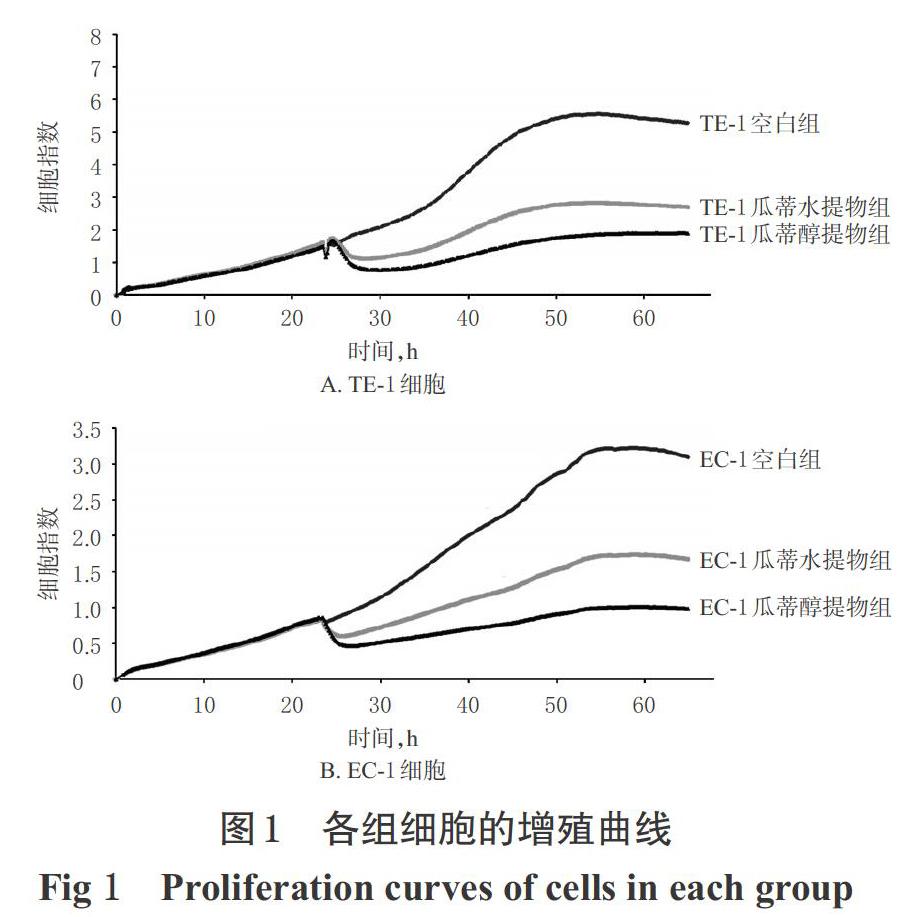
2.5.1 增殖试验在E-Plate View 16孔板中加入50μL无血清培养基,于RTCA DP监测台检测基线后,在每孔中分别加入100μL TE-1细胞或EC-1细胞悬液(1Xl05个/mL),于超净台中室温沉降30min后,放回RTCA DP监测台检测各孔细胞指数。持续检测24h后,将细胞分为TE-1空白组、TE-1瓜蒂水提物组、TE-1瓜蒂醇提物组、EC-1空白组、EC-1瓜蒂水提物组、EC-1瓜蒂醇提物组,每组4个复孔。各加药组每孔加入5μL瓜蒂相应的水提物或醇提物IC50。浓度的药液(空白组不加)后继续检测各组细胞指数变化,共检测60h,记录细胞增殖曲线。各组细胞的增殖曲线见图1。
由图1可知,与TE-1/EC-1空白组比较,瓜蒂水提物或醇提物均能明显抑制TE-1细胞或EC-1细胞的增殖,且瓜蒂醇提物对细胞的抑制作用更明显,两种提取物在加药后30h内有增殖抑制作用。
2.5.2 迁移试验将细胞分为TE-1空白组、TE-1瓜蒂水提物组、TE-1瓜蒂醇提物组、EC-1空白组、EC-1瓜蒂水提物组、EC-1瓜蒂醇提物组,每组4个复孔。在CIM-Plate16下室空广1组每孔中加入165μL含血清培养基,加药组每孔加入165μL含有瓜蒂水提物或醇提物IC。o浓度的含血清培养基;CIM-Plate16上室中空门组和各加药组分别加入30μL无血清培养基,将CIM-Plate16置于培养箱中平衡1h。在平衡期间制备两种细胞悬液,调整细胞悬液浓度均为6xl05个/mL。CIM-Plate16平衡th后,于RTCA DP监测台上检测基线,后在CIM-Plate16上室中加入100μL細胞悬液,室温沉降30min后,将CIM-Plate16放回RTCA DP监测台继续检测各组细胞指数,共检测48h,记录细胞迁移曲线。各组细胞的迁移曲线见图2。
由图2可知,与TE-1/EC-1空白组比较,TE-1/EC-1各加药组细胞迁移缓慢,抑制作用主要集中在加药后60h内,约60h后TE-1、EC-1细胞迁移进入平台期。
2.6 瓜蒂水提物和醇提物对两种细胞形态学的影响
将TE-1、EC-1细胞于直径10cm培养皿中培养24h后,分为TE-1空白组、TE-1瓜蒂水提物组、TE-1瓜蒂醇提物组、EC-1空白组、EC-1瓜蒂水提物组、EC-1瓜蒂醇提物组。各加药组加入含有瓜蒂水提物或醇提物IC50浓度的含血清培养基,空白组加入等体积的空白含血清培养基,继续培养48h后采用倒置显微镜观察各组细胞的形态。各组细胞形态学观察结果见图3。
由图3可知,TE-1/EC-1空白组细胞轮廓清晰,形态规则;与TE-1/EC-1空白组比较,TE-1/EC-1各加药组细胞数量明显减少,细胞结构松散,且可见少量细胞碎片,多数细胞细胞轮廓消失、变圆,甚至呈不规则形,细胞膜皱缩、发泡。
2.7 瓜蒂水提物和醇提物对两种细胞克隆能力的影响
制备TE-1、EC-1单细胞悬液,调整细胞浓度为8x103个/mL。将细胞分为TE-1空白组、TE-1瓜蒂水提物组、TE-1瓜蒂醇提物组,EC-1空白组、EC-1瓜蒂水提物组、EC-1瓜蒂醇提物组,每组3个复孔,进行软琼脂克隆形成试验。分别配制0.6%、1.2%的低熔点琼脂糖溶液,80 0C水浴完全溶解后高压灭菌,备用;将1.2%低熔点琼脂溶液与2xRMPI 1640含血清培养基以1:1(V/V)制成0.6%底层琼脂液,再以0.8mL/孔铺满24孔板(TE-1、EC-1细胞各1个),室温静置凝固;将0.6%低熔点琼脂液与2xRMPI 1640含血清培养基以1:1(V/V)制成0.3%的上层琼脂液,每孔加0.8mL上层琼脂液和100μLTE-1细胞或EC-1单细胞悬液。各加药组分别加入含有瓜蒂水提物或醇提物IC50浓度药液10μL(空白组不加),室温静置凝固,再于37℃、5%C02的细胞培养箱中培养2周。显微镜下肉眼观察细胞克隆球并计数,计算细胞克隆数和克隆形成率,细胞克隆形成率=平均细胞克隆数/每孔接种细胞数×100%[8]。各组细胞的软琼脂克隆球观察结果见图4,细胞克隆形成率见表2。
由图4可知,TE-1/EC-1空白组在不同的软琼脂层有多个圆形和类圆形细胞克隆形成,细胞轮廓清晰、结构紧密、排列整齐、形态规则,TE-1/EC-1各加药组细胞克隆数明显减少、变小,且克隆球呈现不规则的多边形、棍棒形,边缘不光滑,结构松散,皱缩变小,轮廓不清晰。
由表2可知,与TE-1/EC-1空白组比较,TE-1/EC-1瓜蒂各加药组的细胞克隆形成率显著降低(P<0.01);与TE-1/EC-1瓜蒂水提物组比较,TE-1/EC-1瓜蒂醇提物组细胞克隆形成率显著降低(P<0.05)。
2.8 瓜蒂水提物和醇提物对两种细胞周期的影响
将TE-1、EC-1细胞以lXl05个/mL的浓度接种于直径10cm的培养皿中,于37℃、5%C02条件下贴壁培养24h后,将细胞分为TE-1空白组、TE-1瓜蒂水提物组、TE-1瓜蒂醇提物组、EC-1空白组、EC-1瓜蒂水提物组、EC-1瓜蒂醇提物组,每组3个平行。各加药组分别加入含有瓜蒂水提物或醇提物IC50浓度的药液,空白组加入RMPI 1640含血清培养基,继续培养48h后,用15mL离心管收集细胞,2000 r/min离心3min或弃上清,1mLPBS重悬细胞,加入乙醇固定细胞(终体积分数为70%),于4℃下过夜。弃掉乙醇,PBS洗去固定液,加入500μL PI/RNase A染色工作液,室温避光孵育30min后,用400目筛网过滤细胞。用流式细胞仪分析各组细胞的周期,并用Modifit LT软件分析不同细胞周期的百分率。各组细胞周期的检测结果见表3。
与TE-1/EC-1空白组比较,TE-1/EC-1各加药组G2期细胞百分率显著升高(P<0.01),G1期、S期细胞百分率显著降低(P<0.05);与TE-1/EC-1瓜蒂水提物组比较,TE-1/EC-1瓜蒂醇提物组G2期细胞百分率显著升高(P<0.05)。
2.9 瓜蒂水提物和醇提物对两种细胞凋亡的影响
按“2.8”项下方法“将TE-1、EC-1细胞以……培养48h后”操作,收集细胞,按Annexin V-FITC细胞凋亡检测试剂盒操作说明处理细胞。用流式细胞仪检测各组细胞的凋亡情况,并用CellQuest软件分析细胞凋亡率。各组细胞凋亡率检测结果见表4。
由表4可知,与TE-1/EC-1空白组比较,TE-1/EC-1各加药组细胞的早、晚期凋亡率均显著升高(P<0.05);与TE-1瓜蒂水提物组比较,TE-1瓜蒂醇提物组早、晚期细胞凋亡率均显著降低(P<0.05);与EC-1瓜蒂水提物组比较,EC-1瓜蒂醇提物组早、晚期细胞凋亡率均显著升高(P<0.05)。
2,10 瓜蒂水提物和醇提物对两种细胞中EGFR、PKC-a,蛋白表达的影响
按“2.8”项下方法“将TE-1、EC-1细胞以……培养48h后”操作,收集细胞。采用Western blotting法检测各组细胞中EGFR、PKC-a蛋白的表达情况。将所收集的各组细胞处理后上样,进行十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,转膜,封闭,洗涤,加入EGFR、PKC-a-抗(1:2000)孵育,洗涤,加入二抗(1:1000)反应,洗涤后,以ECL试剂盒进行曝光、显影、定影,洗片。采用Image图像分析软件对蛋白的相对表达量进行分析,以目标蛋白与内参蛋白(β-actin)的灰度比值表示。各组细胞中EGFR、PKC-a蛋白表达的电泳图见图5,相对表达量的测定结果见表5。
由表5可知,与TE-1/EC-1空白组比较,TE-1/EC-1各加药组EGFR、PKC-a蛋白相对表达量均显著降低(P<0.01);与TE-1/EC-1瓜蒂水提物组比较,TE-1/EC-1瓜蒂醇提物组EGFR、PKC-a蛋白相对表达量均显著降低(P<0.01)。
3 讨论
食管癌为常见的消化系统肿瘤,东南亚、东亚地区发病率最高,中国的食管癌发病率也在全球排名前5位[3]。目前植物源药物如紫杉类、长春碱类、鬼臼素类等药物的出现给肿瘤治疗带来了新的希望,且具有毒副作用小、不易耐药等优点[14]。近年来对瓜蒂的主要成分葫芦素的研究较多,结果发现葫芦素A、B、D、E均具有广泛的抗肿瘤作用[15-19],提示瓜蒂提取物可能具有良好的抗肿瘤活性。基于此,笔者推测瓜蒂提取物也可能对食管癌具有抗肿瘤活性。
食管癌细胞的转移和侵袭是影响其预后的主要因素[20]。本试验结果证实了瓜蒂水提物和醇提物均能够显著抑制人食管癌TE-1、EC-1细胞的增殖,且存在一定的剂量、时间依赖关系;其也能够显著抑制两种细胞迁移,药物作用时间主要集中在加药后60h内。细胞克隆试验结果证实瓜蒂水提物和醇提物作用后细胞克隆球较相应空白组明显减小,数量明显减少,提示瓜蒂两种提取物均能有效降低食管癌细胞克隆形成能力。
细胞周期是细胞生命活动的基本过程,细胞分裂增殖必须通过两个关键的周期调控点,即G1和G2期调控点。肿瘤细胞周期调控点失调、凋亡受到抑制,造成肿瘤细胞过度增殖,病情进一步发展和恶化。几乎所有的癌基因、抑癌基因的功能效应均与细胞周期机制有关,肿瘤可归属于一类细胞周期疾病[21-22]。在本研究中发现,以瓜蒂水提物和醇提物作用后,两种细胞分裂被明显阻滞在G2期且细胞早期和晚期凋亡率明显上升,其中晚期凋亡率高于早期凋亡率。对于不同细胞,瓜蒂提取物诱导凋亡的效果不同:在TE-1细胞中,瓜蒂水提物诱导凋亡的效果强于醇提物;而在EC-1细胞中,则是瓜蒂醇提物诱导凋亡效果强于水提物。流式细胞周期和凋亡试验结果提示瓜蒂水提物和醇提取物均可通过阻滯细胞周期、诱导细胞凋亡,以此来达到抑制两种食管癌细胞的目的。
EGFR是原癌基因Cerb B-l的表达产物,是一种具有酪氨酸激酶活性的跨膜糖蛋白,与相应配体结合后,其信号通路可调控细胞的增殖、凋亡、血管形成及侵袭转移等生命活动[23]。多种恶性肿瘤中均可检测到EGFR的过度表达,研究发现EGFR在食管癌组织存在高表达[14]。EGFR高表达与肿瘤分化程度、淋巴结转移、TNM分期有关[24-25]。PKC是一类富含丝、苏氨基酸的激酶[27],PKC-a是其中重要的一种亚型,有促进神经递质的释放、突触塑形、细胞增生、基因表达等作用。活化后的PKC-a可催化各种蛋白质底物上的丝氨酸或苏氨酸残基,使其磷酸化,通过原癌基因丝苏氨酸蛋门激酶/丝裂原活化蛋白激酶/激活蛋白1(raf-MAPK-APl)、B淋巴细胞瘤-2基因(bcl-2)、细胞周期蛋门依赖性激酶抑制蛋白(p27)、小G蛋白超家族激酶A(RhoA)等通路,发挥其调节细胞生长、分化、周期、迁移、凋亡、基因表达等多种功能[28-29],是信号通路的中心分子之一。EGFR可通过活化PLC-yl从而激活下游PKC-a。本研究顯示,TE-1/EC-1空门组细胞中EGFR、PKC-a均高表达,而瓜蒂水提物和醇提物作用后均下调了EGFR、PKC-a的表达,提示瓜蒂两种提取物可能通过部分阻断EGFR信号通路发挥抑制食管癌细胞增殖与迁移、阻滞细胞周期、诱导细胞凋亡的作用。
综上所述,瓜蒂水提物和醇提物能有效抑制人食管癌TE-1、EC-1细胞的增殖、迁移,降低细胞的克隆形成能力,阻滞细胞周期与诱导细胞凋亡,其机制可能与下调EGFR、PKC-a蛋白表达有关。在后续研究中,可对瓜蒂提取物中抗食管癌的主要成分、药理作用及进一步的分子机制进行深入挖掘,以期为瓜蒂治疗食管癌的临床应用提供参考。
参考文献
[1]ZHANG HF,ALSHAREEF A,WU C,et al.Loss of miR-200b promotes in vasion via activating the Kindlin-2/inte-grin β l/AKT pathway in esophageal squamous cell carci-noma: an E-cadherin-independent mechanism[J]. Oncotar-get,2015,6(30):28949-28960
[2]MILLER KD, SIEGEL RL, LIN CC. Cancer treatment and sur-vivorship statistics[J]. CA Cancer,Clin, 2016, 66 (4):271-289.
[3]BRAY F,FERLAY J, SOERJOMATARAM I,et al Glob-al cancer statistics 2018: GLOBOCAN estimates of inci-dence and mortality worldwide for 36 cancers in 185 coun-tries[J]. CA Cancer,Clin,2018,68(6):394-4 24
[4]李道娟,梁迪,靳晶,等,上消化道恶性肿瘤流行病学趋势[J]肿瘤预防与治疗,2018,31(1):62-68
[5] BURTNESS B,GOLDWASSER MA,FLOOD W,et alPhaseⅢrandomized trial of cisplatin plus placebo com-pared with cisplatin plus cetuximab in metastatic/recurrenthead and neck cancer: an Eastern Cooperative OncologyGroup study[J].L, Clin Oncol, 2005, 23( 34):864 6-8654
[6]SHARMA P,ALLISON JP. The future ofimmune check-point therapy[J]. Science, 2015.DOI: 10.1126/science.aaa8172.
[7]SONG Y, LI L, QU Y, et al Identiflcation of genomic al-terations ln oesophageal squamous cell cancer[J]. Nature,2014,509(7498):91-95
[8]刘锋.《伤寒论》方剂对人食管癌TE-1 .EC-1、EC109.EC9706细胞株生物学活性的影响[D]郑州:河南中医药大学,2018.
[9]国家中医药管理局《中华本草》编委会中华本草:第五册[M].上海:上海科技出版社,1999:515-519.
[10]王露,陶遵威甜瓜蒂3种提取物体外抗肿瘤活性的比较研究[J]天津医药,2017,45(4):359-363.
[11]李瑾,刘炯活性氧与肿瘤关系的研究进展[J]东南国防医药,2019,21(3):297-301
[12]张洪亮,葫芦素B在体内外对肝癌细胞的生长抑制作用[D]沈阳:中国医科大学,2008.
[13]陈永献.治疗肝炎、肝癌新药葫芦素片[J]中草药,1987,18(10):21.
[14]冯阳阳,黑忠林,拜周兰,等,食管鳞癌组织中HIF-la、VEGF和EGFR蛋白的表达与预后的关系[J]国际医药卫生导报,2018,24(3):297-307.
[15]崔姗姗,邵雷,高小玲,等,半夏泻心汤对食管癌Eca9706细胞周期、凋亡及STAT3蛋白的影响[J]中国实验方剂学杂志,2016,22(4):142-145
[16]SIKANDER M,HAFEEZ BB,MALIK S,et al.Cucurbita-cin D exhibits potent anti-cancer activity ln cervical cancer[J]. Sci Rep,2016.DOI: 10.103 8/srep36594
[17]张萌,边志刚,何平葫芦素B对人胃癌BGC-823细胞增殖及凋亡的影响[J]实用药物与临床,2016,19(5):548-552
[18]CHEN W, LEITER A, YIN D, et al.Cucurbitacin B inhi-bits growth, arrests the cell cycle, and potentiates anti-pro-liferative efficacy of cisplatin in cutaneous squamous cellcarcmoma cell lines[J]. Int‘,Oncol, 2010, 37 (3):737-743
[19]沈杭,陈宗科,钱叶本,等.葫芦素E诱导肝癌细胞凋亡及其机制[J]临床与实验病理学杂志,2015, 31(12):1339-1343
[20]JAFARGHOLIZADEH N, ZARGAR SJ,YASSA N, et alPurification of Cucurbitacins D, E, and I from Ecballiumelaterium (L.)A Rich fruits and study of their cytotoxiceffects on the AGS cell Iine[J]. APJCP, 2016, 17( 10):4631-4635
[21]11 YL, ZHANG XY, LENG Y, et al Global protein ex-pression analysis of molecular markers of DS-1 -47,a com-ponent of implantation-promoting traditional Chinesemedicine[J].L,Huazhong Univ Sci Technolog Med Sci,2016,36(6):910-915
[22]HARTWELL LH, KASTAN MB. Cell cycle control andcancer[J]. Science, 1994, 266(5 192): 1821-1828.
[23]YARDEN Y,SLIWKOWSKI M. Untangling the ErbB sig-naling network[J]. Nat Rev MoI Cell Biol, 2001,2(2):127-137
[24]WANG KL,WU TT,CHOIIS,et al Expression of epider-mal growth factor receptor in esophageal and esophago-gastric junction on adenocarcinomas: association withpoor outcorue[J]. Cancer, 2007, 109(4):658-667
[25]姚型鋒,黄俊星,赵坤,等EGFR.HER2在食管鳞癌中的状态及临床意义研究[J]现代肿瘤医学,2014, 22(4):819-822.
[26]孙文泽,苏进,施瑶,等EGFR与VEGF在食管鳞癌组织中的表达及其与疗效的关系[J]现代肿瘤医学,2019,27(6):981-985.
[27]ADAMS JM,CORY S The bcl-2 family: arbiters of cellsurvival[J]. Science, 1998, 281( 5381): 1322-1326
[28]MICHIE AM, NAKAGAWA R.The link between PKCoregulation and cellular transforruation[J]. Immunol Lett,2005,96(2):155-162.
[29]BALBOA MA, FIRESTEIN BL, GODSON C, et al.Pro-tein kinase C alpha mediates phospholipase D activationby nucleotides and phorbolester in Madin-Darby caninekidney cells. Stimulation of phospholipase D is indepen-dent of activation of polyphosphoinositide-specitlc phos-pholipase C and phospholipase A2 [J].L, Biol Chem, 1994,269(14):10511-10516
(收稿日期:2019-08-27修回日期:2019-10-24)
(编辑:唐晓莲)

