子宫内膜癌患者再发乳腺癌的临床病理特征及预后分析
郭建宾,钱海利,马飞,崔秀娟,段华,孔娜,张颖★
1首都医科大学附属北京妇产医院妇科微创中心,北京 100006;2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室,北京 100021;3国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京 100021;4滕州市中心人民医院妇产科,山东滕州277500;5首都医科大学宣武医院手术麻醉科,北京 100053
乳腺癌(breast cancer,BC)是女性最常见的恶性肿瘤[1],子宫内膜癌(endometrial cancer,EMC)是最常见的女性生殖系统恶性肿瘤,近年来发病率持续上升,严重危害女性健康[2]。EMC和BC作为激素依赖性肿瘤,雌激素暴露是BC与EMC的共同发病基础。他莫西芬治疗BC可导致子宫内膜增殖,增加EMC的风险[3],因此经内分泌治疗的BC患者,其子宫内膜监测情况越来越受到临床医师的重视。但目前研究主要集中于BC及内分泌治疗对子宫内膜的影响,对于EMC患者再发BC的风险及特点尚不明确。本研究对比了EMC-BC患者与原发BC患者在发病年龄、临床分期、淋巴结转移、组织学特点等方面的差异,并比较了二者的生存情况,旨在探索EMC患者再发BC的临床病理特征及预后特点。
1 资料与方法
1.1 研究对象 研究组:选取2004年1月-2015年12月美国国家癌症研究所Surveillance,Epidemiology,and End Results (SEER)数据库收录的EMC-再发BC(endometrial-breast cancer,EBC)患者。纳入标准:①组织学病理确诊为EMC,包括子宫内膜样腺癌、黏液性腺癌、浆液性腺癌、透明细胞癌,根据雌激素依赖性分为Ⅰ型癌(子宫内膜样腺癌)和Ⅱ型癌(黏液性腺癌、浆液性腺癌及透明细胞癌);②EMC诊断后,再次被组织病理学诊断为BC,间隔时间不限。排除标准:特殊类型子宫内膜肿瘤及合并其他系统恶性肿瘤者。共纳入1324例患者,随访时间截至2017年12月。在探讨EMC-再发BC的时间效应时,为避免观察时间过短造成的偏倚,EMC诊断时间限制在2004年1月-2007年12月,BC观察时间截至2015年12月,所有患者观察时间均>8年,共有683例纳入。在数据库同期收录的78 343例EMC(包括上述4种病理类型)患者中,再发BC的发病率为1.69%。在比较EBC组患者BC的临床病理特征时,根据诊断年份的比例匹配SEER同期收录的11 001例BC患者作为BC组。纳入标准:2004年1月-2015年12月经组织学确诊的BC患者;排除标准:合并其他系统恶性肿瘤。
1.2 观察指标 收集两组患者的人口统计学资料和临床资料,包括诊断年龄、病理类型、组织学分化程度、临床分期、BC激素受体状态、淋巴结转移和肿瘤特异性生存(cancer-specific survival,CSS)情况。按发病年龄分为3个亚组:≤50岁、50~60岁及>60岁;按激素受体(HR)状态分为两个亚组:HR(+)组[包括雌激素受体阳性和(或)孕激素受体阳性]及HR(-)组。
1.3 指标分析 分析EBC与BC组患者的临床病理特征,观察二者是否存在差异;观察EMC-再发BC间隔时间的分布,初步探索EBC发生的时间效应,并比较EBC患者与BC患者的生存差异。
1.4 统计学处理 采用SPSS 22.0软件进行统计分析,GraphPad Prism 5软件进行绘图。计数资料以%表示,组间比较采用χ2检验及Mann-WhitneyU检验;单因素生存分析采用Log Rank检验,多因素生存分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 人口统计学资料和临床资料比较 与BC组相比,发病年龄>60岁的患者在EBC组占79.1%,高于BC组的60.7%,差异有统计学意义(P<0.001);淋巴结转移的比例分别为26.2%和29.3%,差异有统计学意义(P=0.021)。两组在发病部位(左侧或右侧)、病理类型、组织分化程度、激素受体状态和临床分期方面差异均无统计学意义(表1)。
2.2 EMC-BC的时间效应 随着EMC发病时间的延长,BC无明显的发病高峰,其分布随间隔时间波动不大,具体见图1。
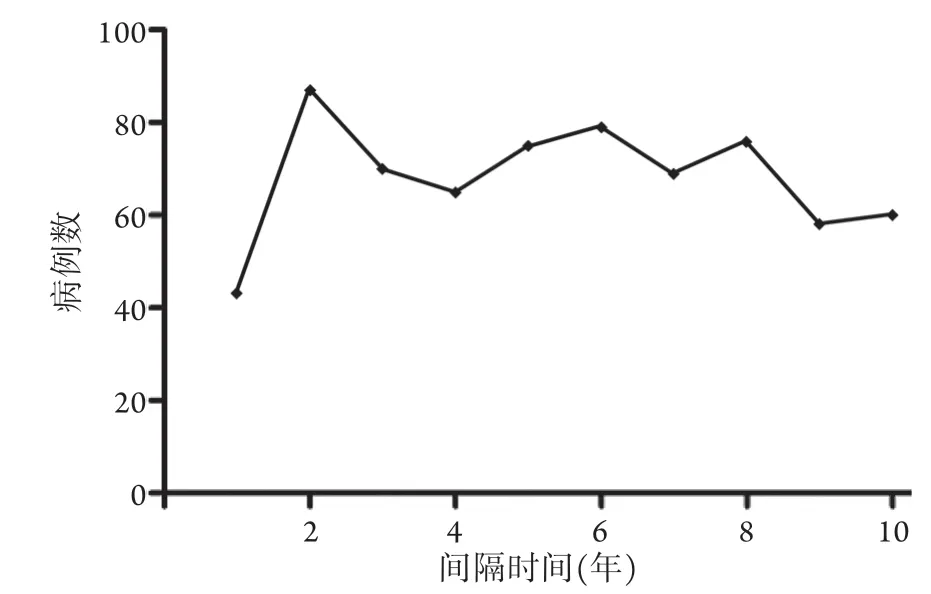
图1 EMC-BC不同间隔时间的发病情况Fig.1 Onset of EMC-BC patients at different intervals
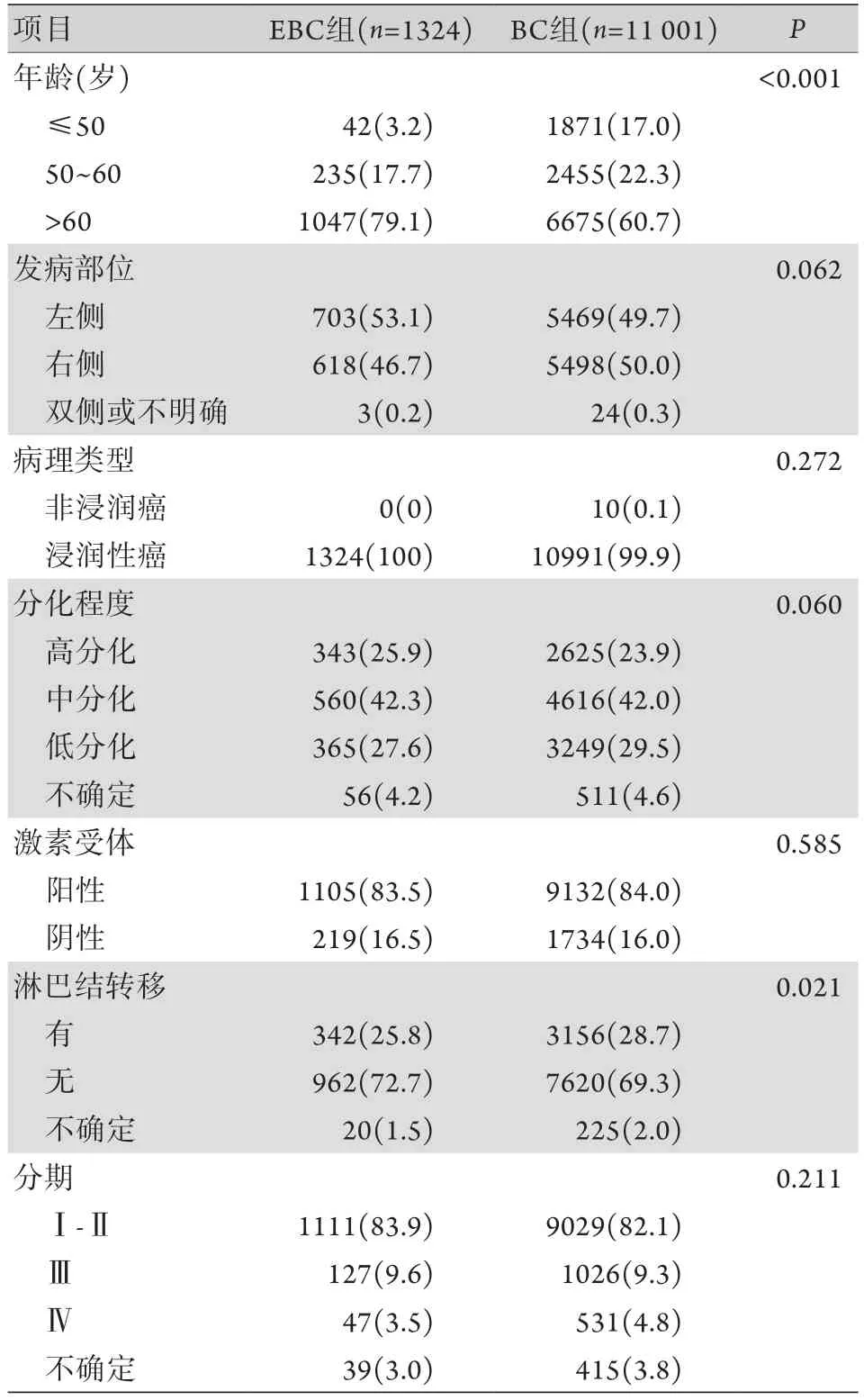
表1 EBC与BC患者的临床病理特征比较[例(%)]Tab.1 The clinicopathological characteristics of EBC and BC patients [n(%)]
2.3 基于BC的生存分析 多因素生存分析结果显示,BC发病部位(左侧或右侧)、病理类型与生存无关,诊断年龄、组织分化程度、分期、激素受体状态、淋巴结转移与生存明显相关,EMC病史对BC的特异性生存具有独立保护作用,风险降低至0.653(95%CI:0.497~0.859,P=0.002,表2)。在HR(+) BC亚组中,合并EMC病史患者的BC特异性生存率优于原发BC患者(P=0.0001),而对于HR(-)BC患者,两者的特异性生存率差异无统计学意义(P=0.329,图2)。
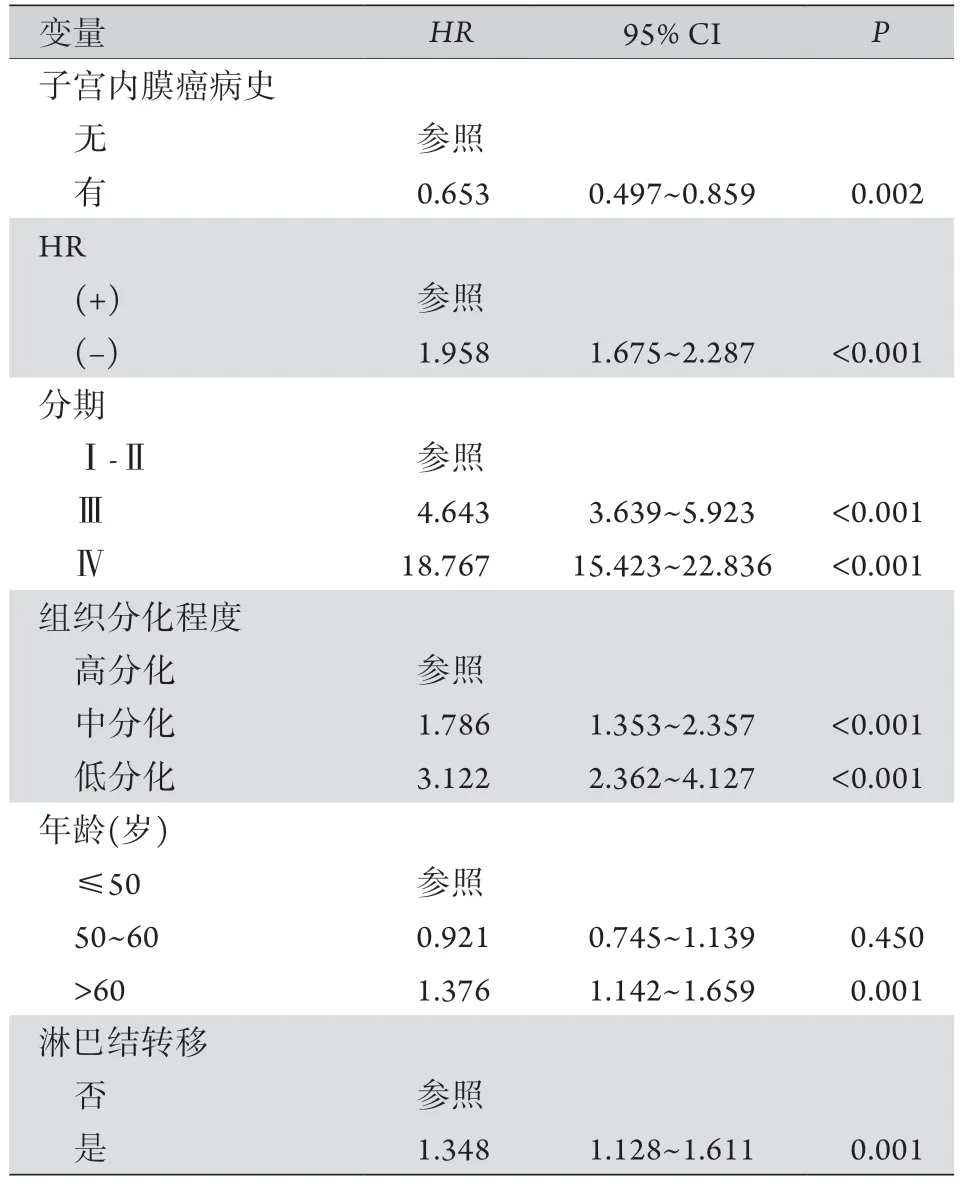
表2 乳腺癌特异性生存多因素分析Tab.2 Multiplicity analysis of breast cancer-specific survival
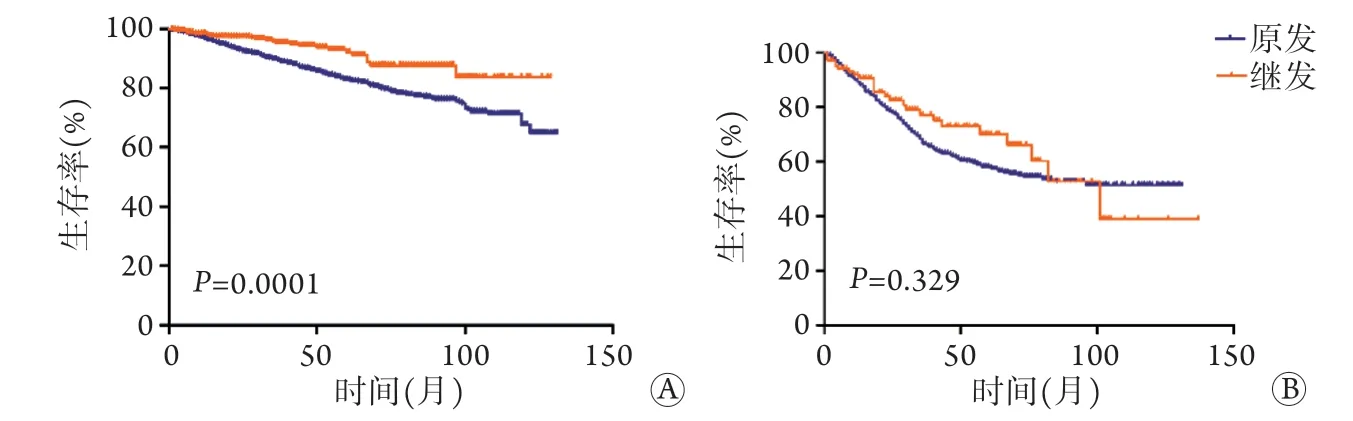
图2 HR(+)(A)、HR(-) (B) BC患者的肿瘤特异性生存率比较Fig.2 Comparison of survival rate in BC patients with HR(+) (A) and HR(-) (B)
3 讨 论
普通人群BC发病率为0.2%~0.4%[4]。本研究结果显示,在EMC人群中,BC的发病率为1.69%,是普通人群的4~8倍,EBC患者具有与BC患者相似的临床病理特征,且EMC病史是HR(+) BC患者的独立保护因素。
EMC患者BC发病率明显增高,可能与以下3个方面有关。首先,BC及EMC均为激素依赖性肿瘤[5-6]。雌激素具有组织特异性,其受体广泛分布于乳腺组织及子宫内膜组织[7]。异常的雌激素合成及分解代谢使子宫内膜累积暴露,导致异常增殖。在EMC患者中,乳腺组织具有同样的高危因素,即雌激素失稳态及组织敏感性[8]。其次,BC与EMC具有相似的遗传基础[9-12]。高龄化是继发BC的显著特征,近80%的EBC患者在诊断BC时年龄>60岁,在平衡BC年龄分布基础之后,EBC患者仍表现出高龄化趋势,EBC患者年龄分布的特点提示BC发病率增高很可能是由于遗传物质的累积突变引起的。肿瘤的发生发展是缓慢的动态过程,在长期重复增殖过程中,肿瘤细胞发生基因突变,向更具攻击性的肿瘤细胞发展[13]。BC的易感基因包括BRCA-1、BRCA-2、P53、HER-2及PTEN,这些易感基因同样对EMC具有易感性。PTEN是Ⅰ型EMC最常见的突变。Ⅱ型EMC的常见突变包括P53、HER-2及P16突变。研究发现,雌激素在刺激腺体增殖的同时可上调BRCA-1表达,而BRCA-1表达上调可以稳定野生型P53[14]。相反,P53突变累积可导致BRCA-1受体受到抑制[15]。抑癌基因的反馈调节通路研究表明,基因突变对肿瘤的影响广泛且复杂,EMC的发生可能降低了BC遗传易感的阈值。第三,EMC的辅助治疗伴随着毒性反应。治疗肿瘤的电离辐射及一些化学药物具有致癌作用。一般第二肿瘤的发生是放化疗的严重不良反应[16-17]。常规化疗方案会增加第二肿瘤的风险,而联合治疗的致癌风险远高于单药化疗[16]。放射治疗可增加各种癌症的发病风险,且放疗诱导的实体瘤风险需要较长的时间效应[17]。本研究结果显示,随着EMC诊断时间的延长,BC并无明显的发病高峰。因早期EMC的5年生存率超过90%[18],故在EMC患者的临床管理中,至少在10年内需关注BC的发生,加强乳腺肿瘤的筛查。
EMC病史是HR(+) BC特异生存的独立保护因素,而对于HR(-)的BC患者,EMC病史对生存无明显影响,提示其保护作用具有激素依赖性,这可能与EMC患者手术去势相关。Valentini等[19]对397例BRCA1突变的年轻女性乳腺癌患者进行了研究,并在多变量分析中发现,卵巢切除术可使病死率降低80%。Huzarski等[20]对来自波兰的234例BRCA1突变携带者进行了研究,结果发现卵巢切除术可使病死率降低70%。Metcalfe等[21]的研究结果同样提示卵巢切除可降低BC患者的病死率,并且保护作用持续超过50岁。EBC患者生存优势的另一原因可能是免疫激活。肿瘤新抗原提呈-免疫激活-免疫应答是机体免疫系统抗肿瘤效应的重要机制[22],EMC是免疫原性肿瘤,且预后较好[23],较长的生存期使机体免疫系统处于持续的刺激应答状态,为新发BC的抗肿瘤免疫应答提供了基础。
本研究也存在一些不足之处。首先,HER-2是BC重要的预后相关因子,HER-2表达在2012年前无记录数据,因此关于HER-2数据大部分患者是缺失的。其次,缺乏辅助治疗如放疗、化疗的数据,其对BC生存的影响无法进行分析。
总之,EMC患者BC的发病率明显增高,这可能与二者共同的激素依赖性及相似的易感基因有关,对于EMC患者,应当加强BC筛查。EMC病史是HR(+) BC患者的独立保护因素,可能获益于卵巢切除,但该结果尚需更多的研究验证。

