超声波辅助酶法提取花生红衣中白藜芦醇的工艺优化
黄兆翔,庞道睿,王卫飞,邹宇晓,廖森泰
(1.广东省农业科学院蚕业与农产品加工研究所 农业与农村部功能食品重点实验室,广东省农产品加工重点实验室,广州 510610; 2.仲恺农业工程学院 轻工食品学院,广州 510225)
白藜芦醇(Resveratrol)的化学名称为3,5,4′-三羟基芪(3,5,4′-trihydroxystilbene),是一种非黄酮类多酚化合物,已知其天然植物来源包括葡萄、日本虎杖、桑果和花生等[1]。白藜芦醇通常与葡萄糖结合以糖苷的形式存在,少量以游离态的形式存在植物中[2]。白藜芦醇是一种天然的抗氧化剂,具有降低血脂、抗病毒、抗肿瘤等生物活性[3-4]。近年来,市场上出现了以白藜芦醇为活性成分的保健品[3]。
花生是我国重要的油料作物,花生红衣是花生油提取工艺中主要的副产物之一,每年产量约600 t[5]。花生红衣中含有白藜芦醇、原花色素等天然多酚类物质[6]。然而在花生油生产行业中,花生红衣作为一种经济效益很低的副产品一直未得到充分利用。Sanders等[7]报道了成熟可食用花生种子中白藜芦醇含量仅为0.03~0.14 μg/g,而在花生红衣中白藜芦醇含量为0.65 μg/g。由此可见,从花生红衣中提取高附加值的白藜芦醇是提高花生产业综合效益的一种有效途径。
花生红衣中白藜芦醇提取应用较多的是传统的固液萃取技术[8-10],其能耗高、时间长,存在多酚类物质受热降解的风险[11]。目前已有将超声波用于花生根中白黎芦醇的提取中[12],同时酶法作为酚类物质提取的一种方法,具有产物回收率高、溶剂用量少等优点[13]。若将二者结合使用,超声波能更好地促进物料破碎,增大固相和液相之间的表面接触面积[14],同时酶可破坏细胞壁,减少传质阻力[15],从而有利于目标物的提取。目前,Fang等[16]发现超声波辅助酶法提取旱莲草(EcliptaprostrateL.)多酚物质时,总酚含量较有机溶剂提取法提高1.63倍;Ran等[17]提取苹果皮多酚时也得出相似结论。然而关于超声波辅助酶法提取花生红衣中白藜芦醇的报道相对较少。
本研究采用超声波辅助酶法提取花生红衣中的白藜芦醇,通过单因素实验优化了工艺参数,为花生红衣资源高值化利用技术提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
花生红衣,广州市至润油脂食品工业有限公司;无水乙醇、甲醇、乙酸乙酯、丙酮均为分析纯,天津市大茂化学试剂厂;乙腈(色谱纯),Thermo fisher控制设备国际有限公司;纤维素酶(400 U/mg)、β-葡萄糖苷酶(10 U/mg)、半纤维素酶(2 U/mg)、木聚糖酶(6 000 U/mg),上海瑞永生物科技有限公司;白藜芦醇标准品(纯度>95%),四川省维克奇生物科技有限公司。
1.1.2 仪器与设备
1260 Infinity II高效液相色谱仪,美国Agilent科技有限公司;SQP型电子天平,赛多利斯科学仪器有限公司;CR22G-Ⅲ型高速冷冻离心机,株式会社日立制作所;N-110回旋蒸发器,上海爱朗仪器有限公司;OSB-2100水浴锅,上海爱朗仪器有限公司;CS-2000型高速多功能粉碎机,永康市天祺盛世工茂有限公司;FE20实验室pH计,梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 白藜芦醇的提取
白藜芦醇的提取参考Puri等[12]方法,稍作变动。将花生红衣样品进行粉碎,过40目筛,4℃保存备用。准确称取5 g花生红衣粉置于250 mL三角瓶,加入10 mL水,调节pH为5.0,按花生红衣与各类酶质量比为50∶1分别添加纤维素酶、半纤维素酶、木聚糖酶、β-葡萄糖苷酶于三角瓶中,酶解90 min(酶解温度与超声温度相同)。酶解完成后按一定料液比加入一定体积分数的乙醇进行超声提取,经离心后取上层清液减压浓缩,乙醇定容作为样液。
1.2.2 白藜芦醇HPLC定量分析
色谱条件参考Sun等[18]的方法,稍作变动。色谱柱采用Agilent ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm),流动相采用经0.45 μm滤膜过滤的乙腈-水溶液(体积比35∶65),柱温25℃,流速1 mL/min,进样量10 μL,经RP-HPLC分离后,在波长303 nm下通过紫外检测器对白藜芦醇定量分析,重复3次,取平均值。
1.2.3 数据分析
采用Origin 8.5绘图软件绘制单因素实验图,以SPSS 19.0数据处理软件分析样品差异性。
2 结果与讨论
2.1 白藜芦醇的HPLC定量
花生红衣粗提液中白藜芦醇HPLC色谱图如图1所示。

图1 花生红衣粗提液中白藜芦醇HPLC色谱图
由图1可知,样品粗提液在5.872 min处有一白藜芦醇吸收峰。回归方程为Y=67.254X-33.037,R2=0.999 3,式中Y为白藜芦醇的峰面积,X为白藜芦醇的质量浓度。实验结果表明,白藜芦醇在6~60 μg/mL范围内峰面积与质量浓度的线性关系良好。
2.2 白藜芦醇提取工艺的单因素实验
2.2.1 酶种类对白藜芦醇提取的影响
称取4份质量约为5.0 g的花生红衣样品置于锥形瓶中,分别添加100 mg纤维素酶、半纤维素酶、β-葡萄糖苷酶、木聚糖酶,乙醇体积分数为80%,料液比1∶20,超声温度50℃,超声时间30 min,其他操作同1.2.1。考察酶种类对白藜芦醇提取的影响,结果如图2所示。
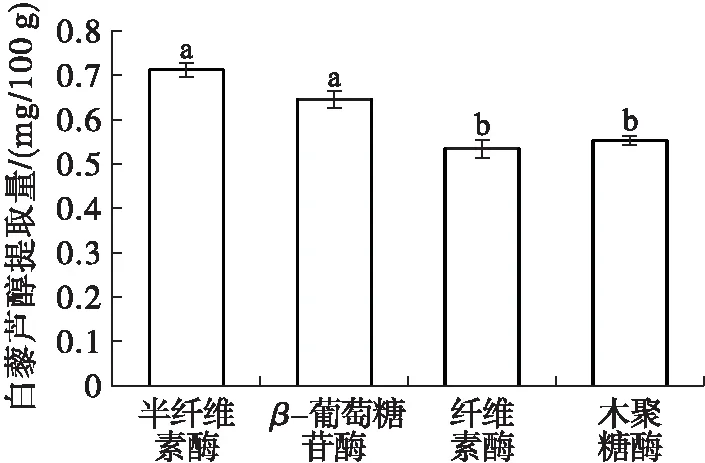
图2 酶种类对白藜芦醇提取的影响
由图2可知,半纤维素酶、β-葡萄糖苷酶对白藜芦醇的提取量显著高于纤维素酶、木聚糖酶(p<0.05)。半纤维素酶、β-葡萄糖苷酶、纤维素酶、木聚糖酶处理花生红衣后白藜芦醇提取量分别为(0.71±0.02)、(0.65±0.02)、(0.53±0.02)、(0.55±0.01) mg/100 g。Lin等[19]采用Pectinex®糖苷酶提取虎杖白藜芦醇时发现,β-葡萄糖苷酶与Pectine®糖苷酶都可催化去糖基化,同时植物中的白藜芦醇常与葡萄糖结合以糖苷的形式存在,即白藜芦醇苷[2]。β-葡萄糖苷酶作用于花生红衣中的白藜芦醇苷导致糖苷键断裂,释放出更多白藜芦醇。半纤维素酶相比纤维素酶具有良好的亲水性,更好地削弱半纤维素、纤维素网络,释放更多多酚物质[20-21]。因此,选择半纤维素酶进行实验。
2.2.2 溶剂种类对白藜芦醇提取的影响
称取4份质量约为5.0 g的花生红衣样品置于锥形瓶中,半纤维素酶添加量100 mg,料液比1∶20,分别添加体积分数为80%的甲醇、乙醇、乙酸乙酯、丙酮4种溶剂于50℃超声30 min,其他操作同1.2.1。考察溶剂种类对白藜芦醇提取的影响,结果如图3所示。

图3 溶剂种类对白藜芦醇提取的影响
由图3可知,不同溶剂对白藜芦醇提取效果具有显著性差异(p<0.05)。甲醇作为提取剂时效果最好,白藜芦醇提取量为(0.74±0.01) mg/100 g;其次为乙醇,白藜芦醇提取量为(0.58±0.01) mg/100 g,而乙酸乙酯与丙酮的提取效果较差。结合溶剂相关成本,同时考虑环境污染及安全性问题,本实验选择乙醇作为提取溶剂。
2.2.3 乙醇体积分数对白藜芦醇提取的影响
称取5份质量约为5.0 g的花生红衣样品置于锥形瓶中,每份样品添加半纤维素酶100 mg,料液比1∶20,超声温度50℃,超声时间30 min,乙醇体积分数分别为60%、70%、80%、90%、100%,其他操作同1.2.1。考察乙醇体积分数对白藜芦醇提取的影响,结果如图4所示。
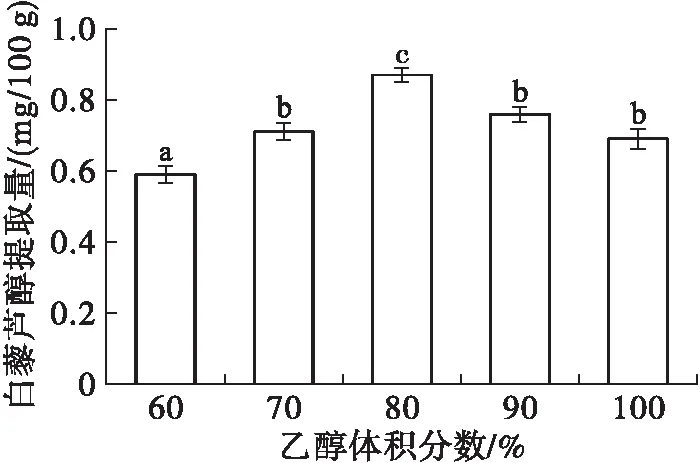
图4 乙醇体积分数对白藜芦醇提取的影响
由图4可知,随着乙醇体积分数的增加,白藜芦醇提取量呈先升后降的趋势。当乙醇体积分数达到80%时,白藜芦醇提取量达到最大,为(0.87±0.02) mg/100 g;当乙醇体积分数超过80%时,白藜芦醇提取量下降。分析其原因可能为:在乙醇体积分数较低时,花生红衣中白藜芦醇溶解度较低导致无法完全溶出;当乙醇体积分数达到80%时,白藜芦醇提取量最大,可能是在一定浓度下溶剂对白藜芦醇的亲和力随着乙醇体积分数的增加而增强;乙醇体积分数过高(>80%)时,一些醇溶性杂质和亲脂性成分溶出,这些成分和白藜芦醇竞争与乙醇-水分子结合,使白藜芦醇提取效率下降[22]。另外,经超声处理的粗提液可能产生自由基,自由基的量与提取液的组成密切相关,无水乙醇更容易产生自由基,导致白藜芦醇损失[23]。因此,选择乙醇体积分数为80%。
2.2.4 料液比对白藜芦醇提取的影响
称取4份质量约为5.0 g的花生红衣样品置于锥形瓶中,每份样品半纤维素酶添加量100 mg,采用80%乙醇提取,超声时间30 min,超声温度50℃,料液比分别为1∶15、1∶20、1∶25、1∶30,其他操作同1.2.1。考察料液比对白藜芦醇提取的影响,结果如图5所示。
由图5可知,在料液比1∶15~1∶30的范围内,白藜芦醇提取量呈先升后降的趋势。当料液比为1∶25时,白藜芦醇提取量最大,为(0.79±0.03) mg/100 g。其原因可能为:一方面,料液比增加可增大花生红衣与提取溶剂接触面,多酚更易与细胞壁的多糖分离;另一方面,在超声波的作用下,料液比过高引起各实验组粗提液产生自由基,且可能存在自由基氧化作用引起白藜芦醇损失,提取率下降[22-23]。因此,选择1∶25为最佳料液比。

图5 料液比对白藜芦醇提取的影响
2.2.5 超声时间对白藜芦醇提取的影响
称取4份质量约为5.0 g的花生红衣样品置于锥形瓶中,每份样品添加半纤维素酶100 mg,在料液比1∶20,乙醇体积分数80%,50℃下分别提取白藜芦醇20、30、40、50 min,其他操作同1.2.1。考察超声时间对白藜芦醇提取的影响,结果如图6所示。
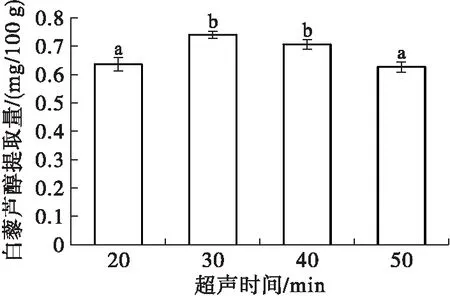
图6 超声时间对白藜芦醇提取的影响
由图6可知,在超声时间20~50 min的范围内,随着超声时间的延长白藜芦醇提取量呈先升后降的趋势。当超声时间在30 min时白藜芦醇提取量达到最大,为(0.75±0.01) mg/100 g;继续延长超声时间至40 min时,白藜芦醇提取量稍微降低,与30 min样品组无显著性差异(p>0.05);此后继续延长超声时间,白藜芦醇提取量持续降低。分析原因可能为:在超声时间20~30 min,由于超声波在溶液中传播时产生空化效应,空化中微小气泡的爆裂产生极大的压力导致细胞壁迅速破裂,白藜芦醇不断地从花生红衣中被释放出来[16];随着超声时间的延长,在40~50 min内,大部分白藜芦醇已经被提取出来,过长时间的超声处理具有破坏活性物质的作用,白藜芦醇分子结构被破坏或发生改变[24];超声波在一定条件下可能会增强多酚氧化酶的活性及产生自由基,多酚类物质被氧化导致白藜芦醇提取率降低[25]。因此,选择超声时间为30 min。
2.2.6 超声温度对白藜芦醇提取的影响
称取4份质量约为5.0 g的花生红衣样品置于锥形瓶中,分别添加100 mg半纤维素酶,超声温度分别为30、40、50、60℃,超声时间30 min,采用80%乙醇作为提取剂,料液比1∶20,其他操作同1.2.1。考察超声温度对白藜芦醇提取的影响,结果如图7所示。
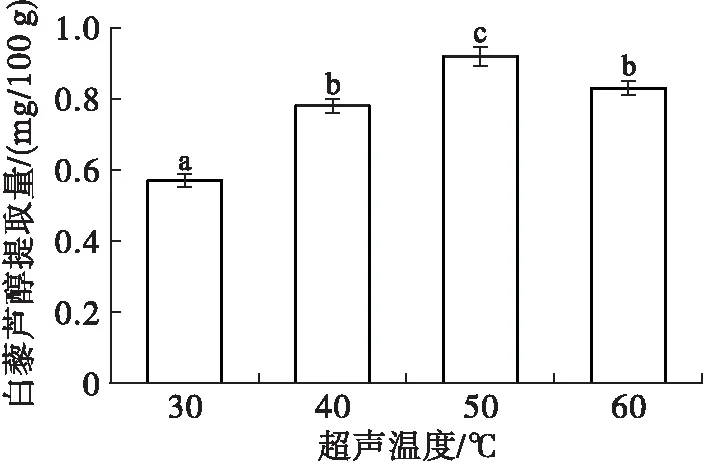
图7 超声温度对白藜芦醇提取的影响
由图7可知,随着超声温度升高,白藜芦醇提取量逐渐增大,且于50℃时达到最大值,为(0.92±0.03)mg/100 g,此后继续升高温度白藜芦醇提取量反而下降。分析原因可能为:一方面,温度升高可能会改变物料的物理状态,同时降低其吸收强度,使白藜芦醇更容易被提取出来;但过高的温度会促进白藜芦醇氧化分解,破坏其分子结构,对提取效率产生不利的影响[26];另一方面,酶解温度与超声温度保持一致,因此当超声温度高于50℃时,即酶解温度高于50℃,可能存在半纤维素酶活性衰减导致白藜芦醇难溶出。因此,选择超声温度为50℃。
综上,超声波辅助酶法提取花生红衣中白藜芦醇的工艺条件为乙醇体积分数80%、料液比1∶25、超声时间30 min、超声温度50℃、半纤维素酶添加量2%,在此条件下进行了3次平行实验,得到白藜芦醇提取量平均值为(0.854±0.025) mg/100 g,相对标准偏差为3.8%,实验结果重现性较好。另外,实验发现最优条件下白藜芦醇的提取量不及图4和图7单因素实验的最大值,这是因为花生红衣中的白藜芦醇含量很低,极易出现检测误差造成的。
3 结 论
本文通过单因素实验对超声波辅助酶法提取花生红衣中白藜芦醇的工艺进行优化,在酶解pH 5.0、酶添加量2%条件下得出最佳提取工艺条件为:采用半纤维素酶提取,乙醇体积分数80%,料液比1∶25,超声温度50℃,超声时间30 min。在最佳工艺条件下白藜芦醇提取量为(0.854±0.025)mg/100 g。后续还将在实验中优化其他因素如酶添加量、提取pH等。

