阿那曲唑与依西美坦在辅助内分泌治疗乳腺癌中的临床疗效
江艳,赵蓉蓉
上海市静安区中心医院药剂科,上海2000400
乳腺癌通常发生于乳房乳腺小叶或乳腺导管上皮,是女性最为常见的一种恶性肿瘤,绝经期前后的女性为高发人群,严重危害女性身心健康及生命安全[1]。目前乳腺癌的病因尚不完全明确,相关研究表明,乳腺癌的发生与体内雌激素水平、遗传因素、生活方式有关[2-6]。内分泌辅助治疗始于1896 年Beatson 的报道中,第3 代芳香化酶抑制剂研制成功后,逐渐取代他莫昔芬用于治疗雌激素受体(estrogen receptor,ER)阳性的乳腺癌患者,成为辅助内分泌治疗的重要环节,目前已广泛应用于临床[7-8]。研究发现,接受内分泌治疗的乳腺癌患者的总生存率并不比接受手术治疗的患者差[9]。依西美坦为第3 代芳香化酶抑制剂甾体类药物,其在临床中主要用于绝经后女性晚期乳腺癌的治疗,通过不可逆地与芳香化酶的活性位点结合,从而使其失活,降低体内雌激素水平,从而达到治疗的目的[10]。另一种代表药物阿那曲唑是强效非甾体类第3 代芳香化酶抑制剂,可抑制体内雌激素的转化,降低血浆内雌激素水平,达到抑制乳腺癌生长的目的[11]。目前已有不少文献对两种药物进行研究,多数探讨其临床疗效、不良反应及对雌二醇(estradiol,E2)水平的影响,较少研究其对患者雌酮(estrone,E1)和孕酮(progesterone,P)水平及无进展生存期(progression-free survival,PFS)的影响[8,10-11]。本研究比较了阿那曲唑与依西美坦在辅助内分泌治疗乳腺癌中的临床疗效、不良反应及对雌激素水平和PFS 的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2016 年4 月至2018 年4 月上海市静安区中心医院收治的乳腺癌患者。乳腺癌的诊断依据《中国抗癌协会乳腺癌诊治指南与规范(2015版)》[12]中的相关标准。纳入标准:①自然绝经或其他方式致绝经;②病理学检查确诊为乳腺癌;③ER 阳性、孕激素受体(progesterone receptor,PR)阳性或不明;④其他内分泌治疗或放化疗结束至少4 周[13];⑤治疗前各项检查等符合治疗标准;⑥肿瘤范围可测量。排除标准:①对本研究中的药物过敏、其他原因不能使用或无效;②出现广泛转移,单一内分泌治疗不能控制病情;③合并不可控制的内科疾病或其他未治愈的肿瘤;④男性。依据纳入和排除标准,本研究共纳入120 例患者。根据治疗方案的不同将患者分为观察组(n=57)和对照组(n=63),观察组患者接受阿那曲唑治疗,对照组患者接受依西美坦治疗。对照组患者的年龄为43~72 岁,平均年龄为(53.42±6.38)岁;TNM 分期:Ⅲ期43 例,Ⅳ期20 例;病理分型:乳头状癌22 例,腺样囊性癌13 例,鳞状细胞癌16 例,黏液腺癌7 例,炎性乳腺癌5 例;接受二线内分泌治疗9 例。观察组患者的年龄为42~69 岁,平均年龄为(53.12±5.71)岁;TNM分期:Ⅲ期40 例,Ⅳ期17 例;病理分型:乳头状癌18 例,鳞状细胞癌11 例,腺样囊性癌8 例,黏液腺癌13 例,顶泌汗腺癌5 例,炎性乳腺癌2 例;接受二线内分泌治疗11 例。两组患者的年龄、TNM 分期、病理分型及接受二线内分泌治疗情况比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组患者接受依西美坦治疗,每日一次,每次25 mg,饭后口服,治疗6 个月。观察组患者接受阿那曲唑治疗,每日一次,每次口服1 mg,饭后半小时服用(上午9 点),治疗6 个月。
1.3 观察指标及评价标准
观察并比较两组患者的临床疗效、雌激素水平、不良反应发生率及PFS。①临床疗效:依据《临床肿瘤内科手册》[14]中的实体瘤疗效评价标准进行评价,完全缓解(complete response,CR),影像学检查显示肿瘤病灶完全消失;部分缓解(partial response,PR),治疗后影像学检查显示肿瘤体积缩小≥50%;病情稳定(stable disease,SD),治疗后影像学检查显示肿瘤体积缩小<50%或增大<25%;病情进展(progressive disease,PD),治疗后影像学检查显示肿瘤体积增大≥25%,或出现新病灶。总缓解率(overall response rate,ORR)=(PR+CR)例数/总例数×100%。于治疗6 个月后复查影像学评价临床疗效。②激素检测:分别于治疗前和治疗4、8、12周后抽取患者的清晨空腹静脉血2 ml,3000 r/min离心10 min,分离血清后,采用化学发光法检测患者的E2、E1、P 水平。③不良反应:记录治疗期间两组患者出现的不良反应及其发生率。④PFS:每隔两个月通过门诊或电话随访的方式记录患者肿瘤是否发生进展(每两个月复查影像学)或出现死亡,随访截止时间为治疗后2 年或肿瘤发生进展,记录患者的一线PFS 和二线PFS。PFS:从治疗开始至肿瘤发生进展或任何原因导致死亡的时间。一线PFS:初次接受内分泌治疗(排除解救化疗)患者的PFS。二线PFS:在一线内分泌治疗失败后患者再次接受其他内分泌治疗的PFS。
1.4 统计学方法
采用SPSS 20.0 软件对数据进行统计分析。符合正态分布且方差齐的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对样本t检验。计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者的ORR 为52.63%(30/57),与对照组患者的52.38%(33/63)比较,差异无统计学意义(χ2=0.001,P=0.978)。(表1)

表1 两组患者的临床疗效[n(%)]
2.2 雌激素水平的比较
治疗前,两组患者的E2、E1、P 水平比较,差异均无统计学意义(P>0.05)。治疗4、8、12 周后,两组患者的E2、E1、P 水平均低于本组治疗前,差异均有统计学意义(P<0.05)。治疗4、8、12 周后,两组患者的E2、E1、P水平比较,差异均无统计学意义(P>0.05)。(表2)
2.3 不良反应发生情况的比较
两组患者均未发生严重不良反应。观察组患者面部潮红、乏力、骨关节痛、腹泻、头痛、恶心的发生率均低于对照组,差异均有统计学意义(P<0.05)。(表3)
2.4 PFS 的比较
两组患者中接受二线内分泌治疗的患者共20例,其中观察组9 例,对照组11 例,两组患者的一线PFS 和二线PFS 比较,差异均无统计学意义(P>0.05)。(表4)
3 讨论
多数乳腺癌为激素依赖性恶性肿瘤,一般而言绝经后女性的卵巢功能开始退化,雌激素分泌功能也相应出现衰退,导致人体内雌激素水平快速下降,处于低水平状态,但经过检测发现乳腺癌患者体内的雌激素水平较高。有研究发现,雌激素与其受体结合后,作用于相应的器官可以产生生物学效应,促进肿瘤细胞增殖,引发乳腺癌[15]。因此,通过药物阻断体内雌激素转化,降低雌激素水平,可在一定时间内有效控制肿瘤进展,达到稳定病情的目的。
阿那曲唑和依西美坦这两种第3 代芳香化酶抑制剂作为用于辅助内分泌治疗的药物在治疗激素受体阳性的乳腺癌中具有重要作用,阿那曲唑为第3 代强效、选择性非甾体类芳香化酶抑制剂,通过抑制细胞色素P-450 依赖的芳香酶,进而阻断雌激素的生物合成,发挥治疗乳腺癌的作用[16]。依西美坦为第3 代甾体类芳香化酶抑制剂,其结构与芳香酶的自然底物类似,通过不可逆地与该酶的活性位点结合而永久灭活,阻断雄烯二酮向E1转化以及睾丸酮向E2转化,达到降低体内雌激素水平的目的。
本研究结果显示,观察组与对照组患者的ORR 比较,差异无统计学意义(P>0.05),说明阿那曲唑与依西美坦辅助内分泌治疗乳腺癌的疗效相当,与相关研究结果相似[17-18]。治疗4、8、12 周后,两组患者的E2、E1、P 水平均低于本组治疗前,差异均有统计学意义(P<0.05)。治疗4、8、12 周后,两组患者的E2、E1、P 水平比较,差异均无统计学意义(P>0.05)。该结果与李丽和左怀全[4]、孙晓寅和荘志刚[5]的研究结果具有一定的相似性,表明降低体内雌激素水平有助于乳腺癌病情稳定。与多数文献主要研究E2不同,本研究将E1、P 指标也纳入分析中,进一步发现,这两种激素与乳腺癌的发生发展也密切相关。治疗后,两组患者的一线PFS 和二线PFS 比较,差异均无统计学意义(P>0.05)。既往研究中较少观察患者的PFS,本研究纳入PFS 后发现,两种药物治疗后患者的PFS 差异较小,表明两种药物在控制肿瘤进展方面无明显差异。在治疗过程中,观察组患者面部潮红、乏力、骨痛、腹泻、头痛、恶心的发生率均低于对照组(P<0.05),与张梦玮等[19]、张竞文[20]、李娜等[21]的研究结果具有一定的相似性。表明阿那曲唑治疗乳腺癌时患者的耐受性较好,不良反应较少,安全性较高,可减少患者因不良反应导致用药依从性差的情况[22]。药代动力学研究发现,阿那曲唑经口服吸收快,体内约40%的阿那曲唑与血浆蛋白结合,多数代谢成无活性的产物经尿液排出,约10%的阿那曲唑直接从尿液排出,在体内代谢速度快且极少出现蓄积,因而不良反应较少[23]。
表2 治疗前后两组患者雌激素水平的比较(×104 pg/L,±s)
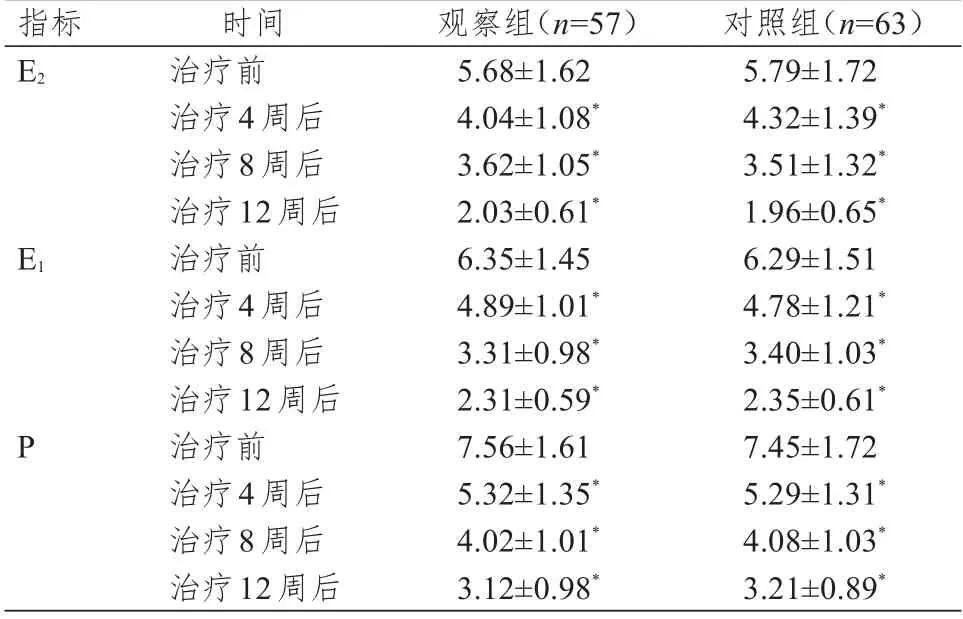
表2 治疗前后两组患者雌激素水平的比较(×104 pg/L,±s)
注:*与本组治疗前比较,P<0.05
指标E2 E1 P时间治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后观察组(n=57)5.68±1.62 4.04±1.08*3.62±1.05*2.03±0.61*6.35±1.45 4.89±1.01*3.31±0.98*2.31±0.59*7.56±1.61 5.32±1.35*4.02±1.01*3.12±0.98*对照组(n=63)5.79±1.72 4.32±1.39*3.51±1.32*1.96±0.65*6.29±1.51 4.78±1.21*3.40±1.03*2.35±0.61*7.45±1.72 5.29±1.31*4.08±1.03*3.21±0.89*
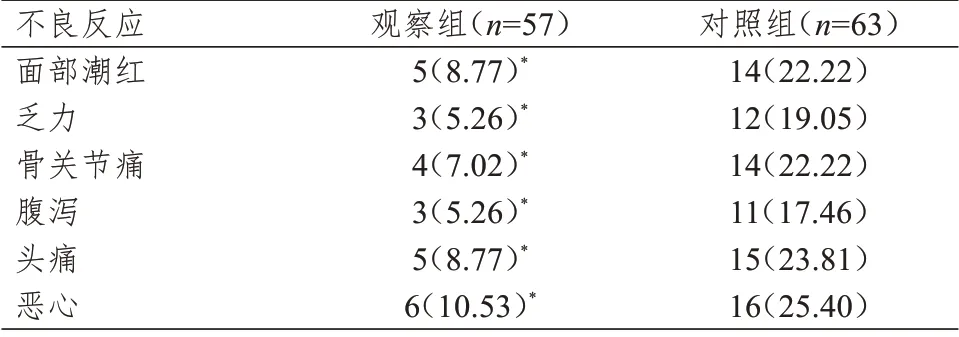
表3 两组患者不良反应发生情况的比较[n(%)]
表4 两组患者的一线PFS 和二线PFS(月,±s)

表4 两组患者的一线PFS 和二线PFS(月,±s)
组别观察组(n=57)对照组(n=63)一线PFS 11.31±1.34 11.06±1.25二线PFS 5.21±1.17 5.41±1.03
综上所述,阿那曲唑与依西美坦辅助内分泌治疗乳腺癌的疗效相当,均可降低患者体内的雌激素水平,延长患者的PFS,达到控制病情的目的。但在用药安全性上,阿那曲唑优于依西美坦,值得临床重视。

