表面展示基因Ⅶ型新城疫病毒F蛋白胞外区细菌样颗粒的构建与鉴定
赵建伟,姜昊妍,杨 锐,张舒博,王建忠,王春凤
(吉林农业大学 动物科学技术学院/吉林省微生态制剂工程研究中心 动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
新城疫 (Newcastle disease,ND) 是由新城疫病毒 (Newcastle disease virus,NDV) 引起的一种高度接触性传染病,世界动物卫生组织(OIE)将ND列为法定报告的传染病,是养鸡业主要预防的禽传染病之一[1]。目前针对该病的防控主要依靠疫苗免疫。持续的监控数据表明,当前我国主要流行的NDV为基因Ⅶ型,而当前我国最广泛使用的疫苗毒株为NDV基因Ⅱ型[2]。虽与流行株同属一个血清型,但在遗传距离上相差较远,并不能提供理想的免疫保护效力,受强毒攻击后排毒现象严重,是导致非典型ND多发的可能原因之一。在非典型ND多发生地区使用基因Ⅶ型疫苗,能有效控制免疫鸡群非典型ND的发生。
因此,研发与当前流行毒株基因型相匹配的新型ND疫苗,是有效防控该病的有效措施。研究表明,F蛋白是NDV感染所必须的蛋白,其在病毒颗粒与宿主融合过程中发挥重要作用,是刺激宿主产生免疫保护反应的主要抗原成分,由于其在致病性和免疫原性中具有重要意义,已成为研究亚单位疫苗、重组疫苗等新型疫苗的首选抗原[3],因此本试验以F蛋白为保护性抗原开发亚单位疫苗。
细菌样颗粒(bacterium-like particles,BLPs)是一种新型非遗传修饰型乳酸菌表面展示技术,外源蛋白可通过乳酸乳球菌肽聚糖锚钩蛋白( protein anchor,PA)锚定于经热酸处理而得的乳酸乳球菌肽聚糖骨架表面,形成空心表面展示颗粒[4]。肽聚糖 PA 为乳球菌主要自溶素AcmA( N-乙酰葡糖胺糖苷酶的一种,N-acetylmuraminidase) 蛋白C-端结构域[5]。BLPs表面展示系统有着高度的安全性、抗原展示密度大和具有佐剂效应等优点,在疫苗研制上有着巨大的发展潜力,尤其是在黏膜疫苗的研发上可望与病毒样颗粒疫苗一道成为最有前景的基因工程亚单位疫苗形式。
本试验以基因Ⅶ型NDV的F蛋白为保护性抗原,立足于大肠杆菌原核表达系统,在体外将PA和F抗原蛋白融合表达后,加入热酸预处理的乳酸乳球菌肽聚糖颗粒中孵育,在PA蛋白的帮助下,即可形成表面展示NDV F蛋白BLPs。
1 材料与方法
1.1 质粒和细胞乳酸乳球菌MG1363购自MOBiTec GmbH,Germany;pEASY克隆载体、BL21( DE3)感受态细胞购自北京全式金生物公司;DH5α感受态细胞购于宝生物工程(大连)有限公司;pET-30a(+)载体购自优宝生物公司;
1.2 主要试剂质粒小提试剂盒、DNA凝胶回收试剂盒均购于康为世纪生物科技有限公司;T4DNA 连接酶购于NEB 公司;限制性内切酶XhoⅠ和EcoRⅠ均购于宝生物工程(大连)有限公司;IPTG、硫酸卡那霉素购自康为世纪生物科技有限公司;抗His标签鼠单克隆抗体、FITC标记山羊抗小鼠 IgG抗体、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG均于购自博奥森生物技术有限责任公司。
1.3 F和PA基因片段的扩增与融合根据 GenBank 数据库中NDV基因Ⅶ型NA-1株(GenBank:DQ659677)F蛋白胞外区序列和乳酸乳球菌MG1363的AcmA 序列(GenBank:U17696),设计特异性PCR引物,F蛋白胞外区上游引物F-PF,下游引物F-PR。PA序列上游引物PA-PF,下游引物PA-PR。PCR引物设计详情见表1,引物由长春库美公司合成。
提取NA-1株RNA,反转录成cDNA,以此为模板进行PCR扩增。以MG1363基因组为模板,进行PCR扩增。PCR反应条件:98℃预变性30 s;98℃变性10 s,50℃退火5 s,72℃延伸10 s,30个循环,72℃再延伸5 min。PCR产物进行8 g/L琼脂糖凝胶电泳检测并进行胶回收。将上述得到的F蛋白胞外区PCR产物和PA蛋白PCR产物为模板,F-PF为上游引物、PA-PR为下游引物,进行融合PCR。将融合PCR产物(F-PA)与pEASY克隆载体室温连接10 min,形成重组质粒pEASY-F-PA,转化到DH5α感受态细胞中,涂于含有氨苄青霉素的LB平板上,次日挑取单克隆菌落扩充培养,提取重组质粒送检测序。
1.4 原核表达质粒pET30a-F-PA的构建待测序结果正确后,将pET-30a载体和重组质粒pEASY-F-PA分别用XhoⅠ和EcoRⅠ限制性内切酶进行双酶切,酶切产物进行8 g/L琼脂糖凝胶电泳检测并进行胶回收。胶回收产物测浓度后,使用T4连接酶16℃连接过夜,产物转化到DH5α感受态细胞中,涂于含有硫酸卡那霉素的LB平板上,过夜培养。挑选单个菌落扩大培养后提取质粒,酶切、PCR鉴定,正确的质粒即为原核表达质粒pET30a-F-PA。

表1 F、PA融合基因引物序列信息
1.5 重组质粒在大肠杆菌中的诱导表达将pET30a-F-PA原核表达质粒,转化到BL21感受态细胞中,涂于含有硫酸卡那霉素的LB平板上,过夜培养。挑选单个菌落,即形成重组菌pET30a-F-PA-BL21,将重组菌置于5 mL含有硫酸卡那霉素的液体LB培养基中,37℃振摇培养过夜,作为母液。次日将母液按照1∶100比例转接到50 mL含有硫酸卡那霉素的液体LB培养基中,37℃,振荡约3 h,加入IPTG至终浓度0.5 mmol/L,37℃诱导4 h,收集细菌,利用Western blot技术鉴定蛋白表达。取50 mL诱导的菌液,8 000 r/min离心收集菌体,用30 mL PBS洗涤3遍。最后用20 mL PBS进行重悬,在冰浴中进行超声破碎细胞。破碎后10 000 r/min,离心10 min收集细胞上清与沉淀。沉淀用1 mL PBS重新悬起。将诱导菌体进行超声波破碎,收集的菌体上清和菌体沉淀进行SDS-PAGE检测其融合蛋白的可溶性。按照Thermo镍柱蛋白纯化说明书进行蛋白纯化。
1.6 BLPs的制备乳酸乳球菌MG1363在GM17培养基中30℃振荡培养16 h,10 000 r/min,离心15 min,室温无菌离心,收集菌体,灭菌水洗涤3次去除培养基,然后用1/5体积的pH=1.0的三氯乙酸重悬,煮沸30 min,10 000 r/min,离心10 min,室温离心去除酸液,PBS洗涤3次后计数,以2.5×109为1 U,将其浓度调整为10 U/mL,-80℃保存备用。
1.7 表面展示F蛋白胞外区BLPs的制备与鉴定从-80℃取出制备好的BLPs,室温融化,将1 U的BLPs离心后用适量纯化后的蛋白重悬,室温缓慢转动孵育30 min,离心收集沉淀和上清,经充分洗涤后制备为表面展示F蛋白胞外区细菌样颗粒F-PA-BLPs,用SDS-PAGE鉴定其结合效果。
1.8 表面展示F蛋白胞外区BLPs间接荧光检测将抗His标签鼠单克隆抗体用PBST按1∶100稀释后与结合F-PA重组蛋白的BLPs在37℃摇床共孵育1.5 h,然后12 000 r/min,离心1 min,弃上清,用PBST洗涤3遍。将FITC标记的山羊抗鼠IgG抗体按1∶500稀释后孵育结合后的BLPs颗粒,避光孵育1 h,然后用PBST洗涤3遍,最后用PBS重悬,取适量的菌液涂抹在载玻片上,用抗荧光衰减剂封片后,置于激光共聚焦显微镜观察。
1.9 重组蛋白与BLPs的结合效率将1 U颗粒与分别于纯化后40,80,120,130,140 μg F-PA蛋白结合,通过Western blot和Image J软件分析其灰度值判断其结合效率。
2 结果
2.1 目的基因F和PA的扩增及融合用特异性引物进行PCR扩增目的基因F和PA,扩增产物经琼脂糖凝胶电泳分析可见在1 680,675 bp处有清晰条带(图1),与预期相符。将F与PA基因进行PCR融合,经电泳分析可见在1 859 bp处有清晰条带(图1),与预期相符。
2.2 重组原核表达质粒pET30a-F-PA的构建采用XhoⅠ和EcoRⅠ对实验室保存的原核表达载体pET30a进行双酶切,经过琼脂糖凝胶电泳分离,在5 388 bp可见一条清晰的线性化载体条带(图2A)。将经过XhoⅠ和EcoRⅠ双酶切的F-PA片段与pET30a载体连接,构建重组质粒pET30a-F-PA,分别用XhoⅠ和EcoRⅠ双酶切后,经琼脂糖凝胶电泳可见5 388,1 859 bp左右条带,与预期大小相符,表明重组质粒已经构建成功。
2.3 重组蛋白Western blot检测重组菌pET30a-F-PA-BL21与空载体对照菌,在IPTG诱导下获得了表达。经过Western blot分析,重组菌比对照菌明显多出一条清晰的带,大小为68 000,与预期相符;诱导后的重组菌pET30a -F-PA-BL21超声破碎后,经过SDS-PAGE分析,破碎细菌沉淀在68 000处有明显的融合蛋白特异性条带(图3泳道4),而破碎细菌上清在68 000处无特异性条带(图3泳道3)表明F-PA蛋白主要以包涵体形式表达。
图1 目的基因的PCR扩增检测 M1,M2.DL2000 DNA Marker;M3.DL5000 Marker;1.F基因的PCR扩增产物;2.PA基因的PCR扩增产物;3.F-PA基因的PCR扩增产物
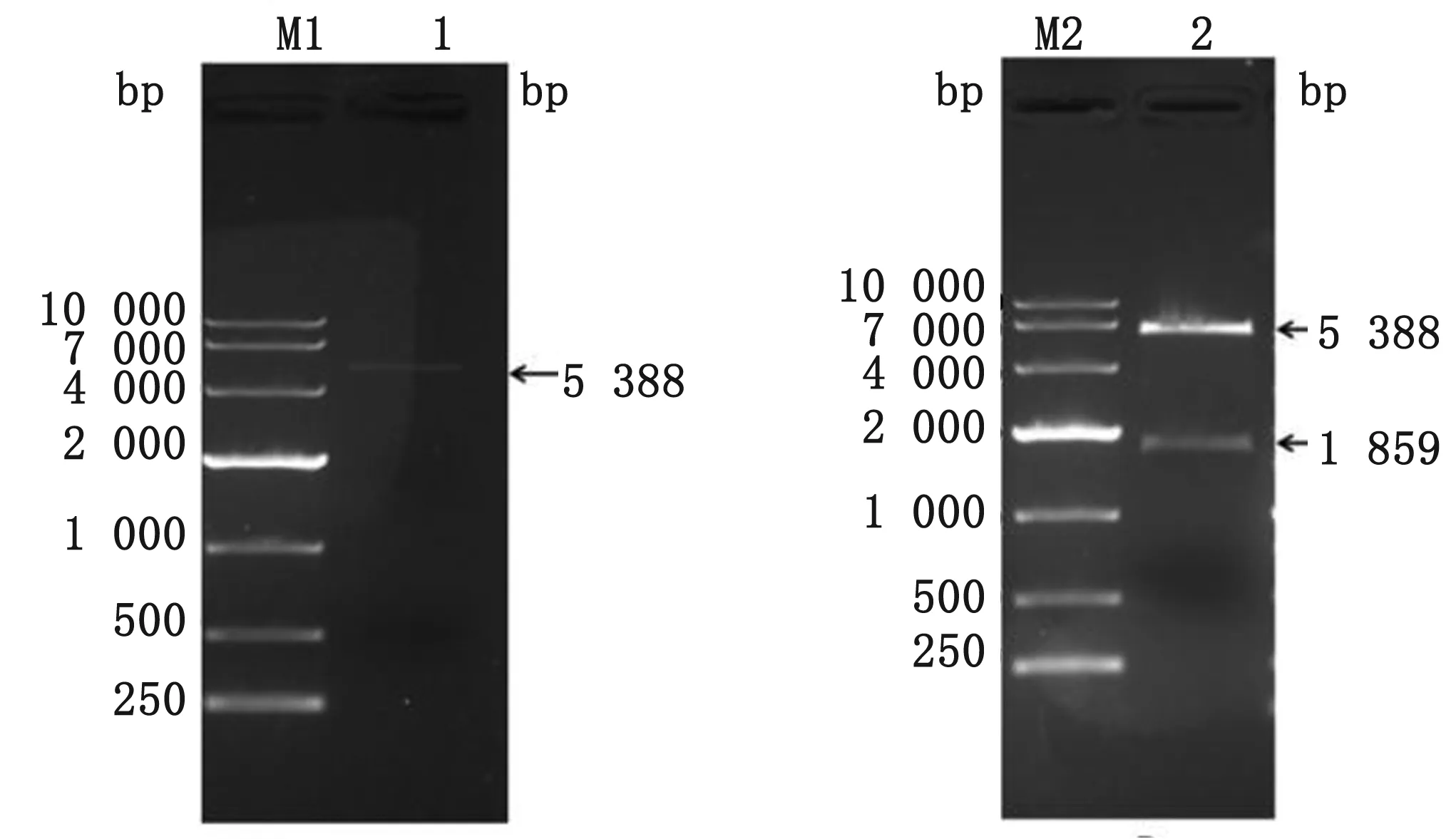
图2 pET30a载体酶切片段 M1.DNA相对分子质量标准;M2.DNA相对分子质量标准;1.pET30a 载体的XhoⅠ+ EcoRⅠ双酶切产物;2.pET30a-F-PA重组质粒的XhoⅠ+EcoRⅠ双酶切鉴定
2.4 目的蛋白的纯化使用Ni2+柱亲和层析法纯化目的蛋白,具体操作按照Thermo蛋白纯化试剂盒说明书进行。纯化后的蛋白进行SDS-PAGE鉴定表明在第3次洗脱后(图4泳道8)在68 000出现单一条带,纯化效果良好。
2.5 裸露BLPs的透射电镜检测经透射电镜观察可见,未经热酸处理的乳酸乳球菌胞质中可见多处深染,并且核区可见大量核酸(图5A);处理后的乳酸乳球菌,即BLPs,可见胞质中大量蛋白和核酸已去除(图5B),表明BLPs制备成功。
2.6 重组蛋白与BLPs结合的SDS-PAGE鉴定纯化后的F-PA蛋白与BLPs室温孵育后收集沉淀,进行SDS-PAGE鉴定发现,裸露的BLPs在68 000大小处未出现特异性条带(图6泳道1),结合F-PA蛋白的BLPs可以在68 000处发现特异性条带(图6泳道3),表明F-PA可以与BLPs颗粒结合。

图3 F-PA蛋白在BL21大肠杆菌中诱导表达产物的Western blot鉴定 M1.蛋白质相对分子质量标准;M2.蛋白质分子质量标准;1.对照菌;2.重组菌pET30aF-PA-BL21;3.破碎细菌后上清;4.破碎细菌后沉淀

图4 F-PA蛋白纯化示意图 M.蛋白质相对分子质量标准;1.IPTG诱导的原菌液;2.加入平衡液超声液体;3.超声后离心上清;4.第1次洗涤;5.第2次洗涤;6.第1次洗脱;7.第2次洗脱;8.第3次洗脱
2.7 重组蛋白F-PA与BLPs结合间接荧光检测由图7可以看出在激光共聚焦荧光显微镜下,可以清晰观察到BLPs表面绿色荧光信号,说面重组蛋白F-PA成功锚定在BLPs上。
2.8 重组蛋白F-PA与BLPs结合率检测由图8A可以看出1 U的BLPs可以与40,80,120,130,140 μg F-PA蛋白发生结合,通过Image J软件分析其灰度(图8B),发现130 μg与140 μg蛋白其灰度值数值相同(图8C),说明1 U的BLPs最大结合量为130 μg F-PA蛋白。
图5 BLPs透射电镜观察(15 000×) A.未经热处理的乳酸乳球菌;B.热处理的乳酸乳球菌
图6 F-PA蛋白与BLPs结合的SDS-PAGE鉴定 M.蛋白质相对分子质量标准; 1.BLPs; 2.纯化后的F-PA蛋白;3.BLPs与纯化后F-PA蛋白结合沉淀
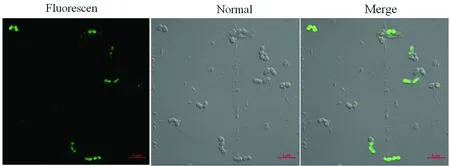
图7 F-PA蛋白在BLPs表面锚定的间接免疫荧光检测
3 讨论
自2000年首次报道了基因Ⅶ型 NDV 在中国大陆的存在以来,基因Ⅶ型NDV逐渐在感染鸡群中处于主导地位,因此,越来越多的科研工作者开始研究针对基因Ⅶ型的NDV疫苗。目前,ND防控主要依靠于弱毒疫苗或灭活疫苗联合防控,虽然能够提供良好的保护力,但也存在着一些弊端。弱毒疫苗虽然能够诱导机体产生持久坚强的免疫力,产生较好的免疫效果,但是存在着持续带毒现象,并常可以引起宿主免疫力低下[6]。灭活疫苗相对安全,但其产生的免疫应答较弱、高效价抗体维持时间较短,并且需要佐剂,疫苗佐剂特别是矿物油佐剂引起的副作用比较大。其他类型的疫苗如DNA疫苗虽然有着稳定性好、制备简单、毒力不会返强等优点,但也存在着目的蛋白表达水平较低风险,动物试验发现其免疫应答较弱[7-8]。袁乾亮等[9]利用昆虫杆状病毒表达系统与病毒样颗粒(VLPs)形成的NDV VLPs亚单位疫苗具有良好的免疫原性,并且相比于商品灭活苗具有更明显的免疫保护效力,可显著降低病毒的组织载量和排毒量,亚单位疫苗在防治ND方面具有很好的应用前景。
图8 F-PA蛋白与BLPs颗粒结合效率检测 A.Western blot(M.蛋白质分子标准;1.纯化后的F-PA蛋白;2.BLPs;3~7.1 U的BLPs分别与40,80,120,130,140 μg纯化后的F-PA蛋白结合后沉淀);B.Image J软件分析其灰度;C.灰度值柱形图
NDV主要通过呼吸道和消化道感染,因此这些器官的黏膜成为抗感染的第一道防线,有效的黏膜免疫可以阻止NDV的吸附和侵入,阻止其进一步感染。此外疫苗通过呼吸道黏膜免疫雏鸡可以不受母源抗体的干扰,能够产生分泌性IgA,如果机体的呼吸道和消化道有一定浓度的分泌性IgA,则可以有效地抵抗NDV的侵袭和感染,因此病毒特异性IgA抗体水平高低也是作为评价机体免疫水平的重要标志。开发ND亚单位黏膜疫苗对ND的防治具有重要意义。选择一个对鸡呼吸道和消化道具有较好的亲和性、能够诱导机体产生较强的黏膜免疫的疫苗至关重要。BLPs大小为1 μm,正好是黏膜表面M细胞摄取外源抗原的理想大小,可被有效的转运至抗原递呈细胞,诱导产生较强的黏膜免疫反应[10]。因此,BLPs是一种理想的黏膜疫苗形式。国外已经有以BLPs为基础研究黏膜疫苗,并取得良好的效果。RIGTER 等[11]用表面展示呼吸道合胞体病毒(RSV)F蛋白的BLP-RSVF通过黏膜免疫小鼠,发现可以诱导出比灭活疫苗更高的中和抗体,受强毒攻击后可以显著降低肺脏病毒载量,具有良好的保护效力,已经成为预防RSV安全而有效的候选疫苗,并获得了英国药物许可。
作为表面展示系统,其表面展示的目的蛋白量是关键。PA作为BLPs重要组成部分,其锚定活性直接决定了外源蛋白与BLPs的结合效率,国外报道大都集中于乳酸乳球菌体内进行表达研究[12]。应用自身的宿主菌表达PA确实能够提高PA活性,但是由于乳酸乳球菌外源基因转化表达困难且蛋白表达产量较低。因此我们选择了操作简单、技术成熟、目的蛋白表达量大的大肠杆菌表达系统进行体外表达F-PA蛋白。此外2016年,沈俊俊等[13]用大肠杆菌原核表达系统成功表达NDV基因Ⅶ型F蛋白,同时将纯化后F蛋白免疫小鼠,发现其表达蛋白有着良好的免疫原性,能够产生较强的免疫应答。因此大肠杆菌原核表达系统成为首选表达系统。BLPs的质量也直接影响着抗原的展示效率。三氯乙酸常用于乳酸菌肽聚糖提纯,它可以较好地去除乳酸菌表面的磷酸壁,磷酸壁可以跨越质膜,穿透肽聚糖层。去除磷酸壁相当于在菌体开孔,可以在保证菌体形态的情况下,使菌体里面的内容物流出。但是从透射电镜观察BLPs发现其蛋白质去除效率不高,可能的原因是其三氯乙酸使菌体蛋白质变性,蛋白质发生聚集[14],随着蛋白质聚集量增大,很难从空洞中流出。因此可以观察到乳酸菌蛋白质残留。据国外报道称,pH值为1.0是BLPs制备成功的关键[15]。我们下一步会在pH为1.0的情况下更换不同类型的酸,来优化BLPs的制备。
综上所述,本试验以目前我国流行的基因Ⅶ型NDV NA-1株为研究对象,用传统的原核表达系统制备含有F主要结构蛋白的BLPs;选择与当前流行株相匹配的基因型,避免了传统疫苗出现的病毒载量高、排毒反应强烈等免疫偏差影响;因此,该NDV F蛋白 BLPs可作为疫苗候选株,为防控ND提供新的策略。

