大黄素通过选择性调节肠道菌群缓解犬慢性肾衰竭
朱道仙 陆江 赵学刚 刘莉 吴双

摘要:為研究大黄素对犬慢性肾衰竭(CRF)的治疗效果与对肠道菌群的调节作用之间的关系,探究大黄素延缓CRF的作用机制,采用34例犬慢性肾衰竭病例,其中大黄素治疗组(RT)22例,常规治疗组(UT)12例。UT组患犬口服复方α-酮酸片+肾脏处方粮;RT组在UT组基础上按100 mg/(kg·d)口服大黄素,治疗期为45 d。定时采集患犬血液,检测尿毒素水平并无菌收集患犬粪便,用于肠道菌群16S rDNA测序及其代谢物检测。将2组治疗前后的患犬粪菌液移植给慢性肾衰竭模型无菌小鼠,验证患犬肠道菌群对CRF的影响。结果显示:RT组患犬的血清肌酐(Scr)、血尿素氮(BUN)、硫酸吲哚酚(IS)和硫酸对甲酚(PCS)含量逐渐降低,肠道菌群丰度增加,与试验前及UT组有显著差异;菌群结构也发生改变,表现为肠杆菌科、假单胞菌科等细菌丰度逐渐降低,而普氏杆菌属、乳杆菌属、丁酸梭菌属和双歧杆菌属等有益菌逐渐成为优势菌群,与UT组有差异。RT组肠道菌群在遗传信息处理、核苷酸代谢、辅助因子和维生素代谢等代谢途径方面表现活跃,患犬粪中代谢物丁酸含量升高,吲哚与H2S含量逐渐降低,与试验前及UT组有显著差异,这些代谢物含量的变化趋势与其生产菌群的变化趋势相一致。慢性肾衰竭无菌小鼠粪菌移植结果表明,RT组试验后的粪菌可以显著降低小鼠血中Scr和BUN含量。以上结果说明,大黄素可以使CRF犬紊乱的肠道菌群重建平衡,改变细菌代谢物水平,从而减少肠道菌群对犬慢性肾衰竭的不良影响。
关键词:大黄素;犬;慢性肾衰竭;肠道菌群;16S rDNA测序
中图分类号:S858.292.659文献标识码:A文章编号:1000-4440(2020)06-1489-09
Abstract:To study the relationship between the therapeutic effect of emodin on chronic renal failure (CRF) and the regulating effect of emodin on gut microbiota in dogs, so as to explore the mechanism of emodin in alleviating CRF, 34 cases of CRF dogs were used, among which emodin treatment group (RT) contained 22 cases and usual treatment group (UT) contained 12 cases. The dogs in the UT group were given prescription diet containing compound α-ketoacid tablets plus kidney, while the dogs in the RT group were given 100 mg/(kg·d) emodin by oral on the basis of the prescription in the UT group, the treatment period was 45 days. Blood of the dogs was collected regularly to detect the level of urotoxin and feces of the dogs were collected aseptically for 16S rDNA sequencing of gut microbiota and related metabolites detection. The fecal bacterial solution of the two groups before and after treatment were transplanted into germ-less CRF mice respectively to verify the effect of gut microbiota on CRF. The results showed that the contents of serum creatinine (Scr), blood urea nitrogen (BUN), indole sulfate (IS) and p-cresol sulfate (PCS) of dogs in RT group decreased gradually and the abundance of gut microbiota increased, which showed significant difference with the group before test and UT group. The microflora structure also changed, presented as the abundance of Enterobacteriaceae, Pseudomonadaceae decreased gradually, while the beneficial bacteria such as Proteus, Lactobacillus, Butyricicoccus and Bifidobacterium gradually became the dominant microflora, which was different from UT group. The gut microbiota of RT group was active in metabolic pathways such as genetic information processing, nucleotide metabolism, cofactor and vitamin metabolism. The content of butyric acid in feces of the dogs from RT group increased, while the content of indole and H2S decreased gradually, which showed significant difference with the group before test and UT group. The change trend of these metabolites was consistent with the change trend of the productional flora. The result of fecal bacteria transplanting of the aseptic CRF mice showed that fecal bacteria from the RT group after experiment could significantly reduce the contents of Scr and BUN. In summary, emodin can restore the disarranged gut microbiota and change the levels of bacterial metabolites in CRF dogs, thus reduce the adverse effects of gut microbiota on CRF.
Key words:emodin;dog;chronic renal failure;gut microbiota;16S rRNA sequencing
近年来,犬的慢性肾衰竭(CRF)发病率逐年上升,治愈率低、成本高,对宠物诊疗业产生了严峻的挑战。慢性肾衰竭与肠道菌群间关系密切,前者可以导致后者发生紊乱,后者紊乱又可加剧CRF的发展,最终恶化病情[1-2]。因此,肠道菌群是一个复杂的微生物生态系统,增加有益菌丰度对动物健康至关重要[3-5],调节肠道菌群有望成为治疗犬慢性肾衰竭的新方式。
大黄素具有抗炎、抗氧化、抗肿瘤等多种药理作用[6],可以通过调节肠道菌群治療多种疾病[7-9]。虽然有报道发现大黄素对CRF具有疗效[10],但是否与调节肠道菌群有关却鲜有报道,而且也有研究结果表明大黄素对猫CRF无治疗价值[11]。大黄素对犬CRF是否具有治疗作用以及是否与调节肠道菌群有关,是一项值得研究的课题。因此,本试验给CRF患犬口服大黄素后,观察尿毒素指标和肠道菌群的动态变化,探讨二者间的因果关系,从肠道菌群调控角度阐释大黄素治疗犬慢性肾衰竭的作用机制,为临床应用提供科学依据。
1材料与方法
1.1病例资料
选取2017年7月至2019年7月期间,到江苏农牧科技职业学院动物医学院教学宠物医院就诊的诊断为慢性肾衰竭的患犬45例,按照纳入标准剔除11例,剩余病例用于研究。研究纳入标准为:①符合国际肾病研究协会(IRIS)犬猫慢性肾病诊断标准[12];②就诊前1个月内未使用抗生素、益生菌或微生态调节剂等;③未伴有其他疾病,如胃肠道疾病,尿路感染、急性肾炎、尿结石等泌尿道疾病,心脏病、糖尿病、肥胖症等可导致肾功能障碍的疾病以及各种感染性疾病。所有研究病例的主人均对本研究计划有详细的了解,并签署知情同意书。
1.2临床治疗试验
按随机数字表法将34例病例随机分成大黄素治疗组(RT组,n=22)和常规治疗组(UT组,n=12)。UT组患犬治疗方案为口服复方α-酮酸片(摩登狗生物科技有限公司产品,1片/次,2次/d)+自由采食肾脏处方粮(上海信元动物药品有限公司生产),RT组在UT组治疗的基础上按100 mg/(kg·d)口服大黄素,自由饮食,治疗期为45 d。并分别于治疗前(0 d)与治疗后15 d、30 d、45 d早晨,空腹采集血液,用酶联免疫吸附测定(ELISA)法检测血清肌酐(Scr)、血尿素氮(BUN)、硫酸吲哚酚(IS)和硫酸对甲酚(PCS)含量。同时,经无菌直肠采集粪便后平分成4份,分别用于短链脂肪酸(SCFA)含量检测(气相色谱/质谱法)、H2S含量检测(亚甲基蓝法)、吲哚含量检测(分光光度计法)和肠道菌群16S rDNA测序。
1.3慢性肾衰竭无菌小鼠粪菌移植试验
1.3.1粪菌液制备试验前收集3例RT组患犬粪便并充分混匀,结束后再次收集相同病例粪便并充分混匀,UT组粪便收集方法同RT组。最终制成4种粪便样本,分别为UT组试验前(U-pre)和试验后(U-post)、RT组试验前(R-pre)和试验后(R-post)。在无氧室中,分别取各个粪便样本0.5 g,加入25 ml无菌Ringers缓冲液稀释,充分搅匀后静置5 min,然后将上清液转移到干净的试管中,并添加等量20%(质量体积比)无菌脱脂乳溶液,制成粪菌液。试验当天制备新鲜粪菌液,其余的保存在-80 ℃备用。
1.3.2慢性肾衰竭无菌小鼠粪菌移植将32只断奶的无菌C57BL/6J雄性小鼠在12 h(日)/12 h(夜)光周期下饲养于柔性薄膜塑料隔离器中,喂食经过消毒的正常食物与水,在粪菌移植前定期收集粪便、食物、水和填料等样本进行细菌学检查来监测细菌污染情况。在7周龄时,随机将小鼠等分为4组(每组单独隔离),参考Michael等[13]的方法,第1周给各组小鼠按250 mg/kg体质量隔天灌服腺嘌呤,后3周按150 mg/kg体质量隔天灌服腺嘌呤。建模成功后,4组小鼠分别口服100 μl下列粪菌液:U-pre、U-post、R-pre和R-post,并于第2 d加强1次。分别于口服粪菌液前和口服后30 d,空腹收集各组小鼠血液用于Scr、BUN、IS和PCS的检测,检测方法同方法1.2,同时采集粪便进行16S rDNA测序。
1.4肠道菌群16S rDNA高通量测序
称取无菌粪便样100 mg,采用Qiagen DNA试剂盒按说明书提取总DNA。再以获得的细菌DNA为模板进行细菌16S rDNA的V3、V4可变区PCR扩增,上游引物(F)序列为5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物(R)序列为5′-GGACTGCACGGGTATCTAAT-3′。扩增程序为:95 ℃预变性 10 min,92 ℃变性45 s,50 ℃退火30 s,72 ℃延伸30 s,6个循环;92 ℃变性45 s,68 ℃退火30 s,72 ℃延伸30 s,30个循环;然后72 ℃扩展延伸10 min,4 ℃保存。采用生工生物工程(上海)股份有限公司的PCR产物纯化试剂盒对所得PCR产物进行纯化后,用NEB Next UltraTM DNA Library Prep Kit for Illumina建库试剂盒进行文库构建, 使用Illumina Miseq PE 300平台进行Paired-end测序。
1.5生物信息学分析
将测序数据经QIIME(version 1.9.1)进行去除接头序列、低复杂度序列和低质量序列的处理,得到高通量原始碱基序列。用贝叶斯分类器将相似性大于97%的序列划分为1个分类操作单元(OTU),与GreenGene数据库进行比对,得到OTU注释结果及丰度。OTU数量差异用Kruskal-Wallis检验,将各样本OTU丰度标准化后进行主成分分析(PCA)。通过LEfSe分析[14]组间差异菌群,并绘制聚类热图,运用PICRUSt软件[15]预测菌群基因组功能,与京都基因与基因组百科全书数据库(KEGG)比对,获得KEGG直系同源基因簇(KO)注释信息及丰度,进而进行KEGG代谢通路的差异分析。
1.6数据处理
血液指标及粪代谢物数据结果用平均值±标准差表示, 采用SPSS 22.0统计软件方差分析(ANOVA)程序单因素方差分析进行组间比较,组内比较采用重复测量资料方差分析,分类资料用Pearson卡方检验。肠道菌群数据比较采用Kruskal-Wallis检验。P<0.05表示差异显著,P<0.01表示差异极显著。
2结果与分析
2.1研究对象的基本特征
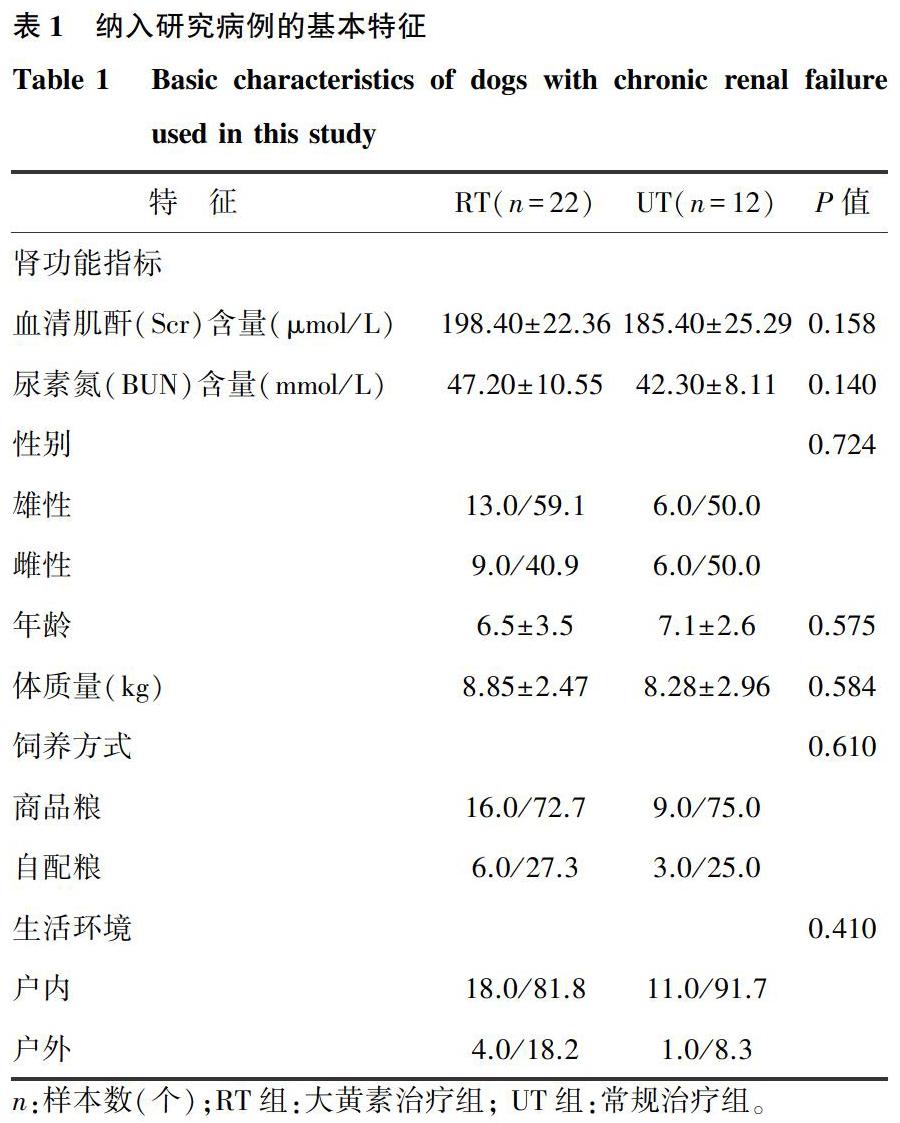
本试验所用犬CRF病例共有34例,其中RT组22例,UT组12例(表1)。与UT组比较,RT组Scr及BUN水平、性别构成、年龄分布、体质量情况、饲养方式和生活环境等均无显著差异(P>0.05)。
2.2大黄素对CRF患犬肾功能的影响
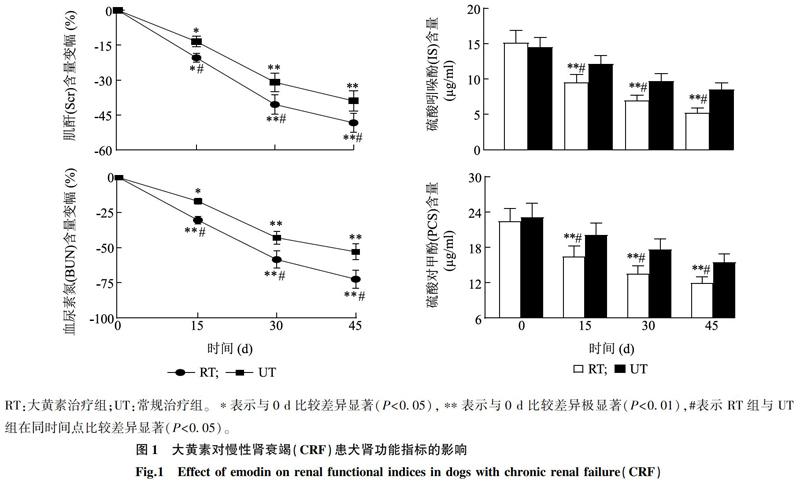
由图1可知:与0 d比较,RT组患犬的Scr、BUN含量呈降低趋势,从15 d开始有显著差异(P<0.05),30 d时差异极显著(P<0.01),45 d时分别降低了48.39%、72.53%;与UT组比较,RT组患犬在15 d、30 d和45 d时的Scr、BUN含量显著降低(P<0.05)。RT组患犬的IS、PCS含量从15 d开始极显著低于0 d时的含量(P<0.01),45 d时达到了最低值(分别为5.26 μg/ml、11.98 μg/ml),并且低于UT组(P<0.05)。
2.3大黄素对CRF患犬肠道菌群的影响
研究发现,RT组患犬肠道菌群OTUs数量随时间推移明显升高,UT组患犬肠道菌群OTUs数量变化不大(图2a)。PCA结果显示,PCA1可解释35.52%样本差异,各样本随着试验时间有沿PCA1轴右移的趋势,试验后RT组样本主要集中于右侧,与其他样本的离散程度较高(图2b)。在比较不同时间点OTUs的差异性时发现,与0 d比较,RT组15 d时患犬肠道菌群有106个OTUs下调,84个OTUs上调(图2c);30 d时有183个OTUs下调,137个OTUs上调(图2d);45 d时共有211个OTUs下调,158个OTUs上调(图2e)。与UT组比较,RT组有74个OTUs下调,54个OTUs上调(图2f)。
2.4CRF患犬肠道菌群的LEfSe差异分析
通过LESfe分析发现,RT组患犬肠道在0 d时富集的细菌主要有肠杆菌科(Enterobacteriaceae)、假单胞菌科(Pseudomonadaceae)、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、埃希氏菌属(Escherichia)和变形杆菌属(Proteus)等;给予大黄素后45 d,优势菌群发生了显著变化,乳杆菌科(Lactobacillaceae)、普氏杆菌属(Prevotella)、乳杆菌属(Lactobacillus)、丁酸梭菌屬(Butyricicoccus)和双歧杆菌属(Bifidobacterium)等有益菌数量显著增加,而瘤胃球菌属(Ruminococcus)、拟杆菌属(Bacteroides)和优杆菌属(Eubacterium)等则富集在UT组(图3a)。将上述各差异菌群不同时期的丰度进行标准化后绘制了聚类热图(图3b)。可以看出,RT组的患犬肠道菌群呈现动态变化过程,表现为原富集的菌群丰度逐渐降低,乳杆菌科等有益菌丰度逐渐升高。
2.5CRF患犬肠道菌群基因功能PICRUSt预测分析
PICRUSt分析结果(图4)显示,与0 d时(pre-RT)比较,45 d时RT组的患犬肠道菌群在遗传信息处理过程中转录(Transcription)、翻译(Translation)、折叠、分类和降解(Folding, sorting and degradation)、复制和修复(Replication and repair)等方面以及核苷酸代谢(Nucleotide metabolism)、辅助因子和维生素代谢(Metabolism of cofactors and vitamins)与细胞运动(Cell motility)等代谢途径方面较活跃,而在碳水化合物代谢(Carbohydrate metabolism)、糖生物合成和代谢(Glycan biosynthesis and metabolism)、氨基酸代谢(Amino acid metabolism)等方面参与度较低,与UT组比较也得到了相似的结果。
2.6大黄素对CRF患犬肠道菌群代谢产物的影响
RT组和UT组患犬粪便的乙酸含量在试验过程中无显著变化,但RT组的产乙酸菌群的比例却从15 d开始显著(P<0.05)高于0 d(图5a、图5e);RT组丁酸含量和产丁酸菌群丰度在15 d、30 d及45 d时均显著(P<0.05)或极显著(P<0.01)高于0 d和UT组同时间点(图5b、图5f)。RT组患犬粪便吲哚含量(图5c)、H2S含量(图5d)均呈降低趋势,15 d、30 d及45 d时均极显著低于0 d(P<0.01)并显著低于同期UT组(P<0.05);RT组产吲哚菌群OTUs相对丰度逐渐降低,与0 d比较,15 d时有显著差异(P<0.05),30 d、45d时有极显著差异(P<0.01,图5g),试验15 d、30 d及45 d时产H2S菌群OTUs相对丰度也显著低于0 d(P<0.05,图5h)。
2.7CRF患犬粪菌移植对慢性肾衰竭无菌小鼠肾功能的影响
将RT组、UT组治疗前与治疗后的患犬肠道菌群分别移植给慢性肾衰竭无菌小鼠后发现,各组小鼠的Scr、BUN含量均低于灌服粪菌液前,IS与PCS含量均高于灌服粪菌液前,R-Post组IS及PCS含量均低于其他3组(P<0.05或P<0.01,图6a)。R-Post组Scr、BUN含量降低幅度较大,低于其他3组(P<0.05,图6b、图6c)。PCA结果显示,各组小鼠样本与供给粪菌液的犬样本较为聚集,与其他犬样本较为分散(图6d),菌群结构也与粪菌液供体相似(图6e)。
3讨论
发生慢性肾衰竭时,由于肾小球滤过能力降低,导致肌酐、尿素氮等物质不能顺利经肾排泄而聚积于血液形成氮质血症。本研究结果表明,大黄素可以降低CTF患犬的Scr和BUN含量,效果优于常规治疗组,证实了大黄素对犬CRF具有治疗价值。
随着高通量测序技术的发展,16S rDNA测序技术已被广泛用于肠道微生物的多样性、物种组成及细菌基因功能预测等方面的定性与定量研究[16-19]。伦恒忠[20]通过16S rDNA测序技术研究了慢性肾病进展中肠道菌群的变化情况,寻找到慢性肾病肠道菌群的生物标记物(Biomarker)。Ye等[21]也利用16S rDNA测序技术找到了肾移植、慢性肾病与健康人的差异菌群。本研究发现,大黄素可以提高CRF犬肠道菌群的丰度,改变菌群结构,说明大黄素对CRF犬肠道菌群具有调节作用;通过LEfSe和PICRUSt分析发现,给予大黄素后,乳杆菌科、普氏杆菌属、乳杆菌属、丁酸梭菌属和双歧杆菌属等有益菌数量显著增加,菌群基因在遗传信息处理过程、核苷酸代谢、辅助因子和维生素代谢等代谢途径方面也较为活跃。进一步分析菌群结构与功能的关系,发现大黄素可以提高细菌代谢物丁酸的水平,且与产丁酸细菌丰度增加有关。而有研究结果表明,肠道菌群产丁酸能力降低,引起肠道黏膜通透性增加,导致代谢性内毒素血症和慢性炎症,从而加剧CRF进展[22]。由此可以推测,产丁酸菌增加可能是大黄素作用机制之一。
IS和PCS是慢性肾脏病及其并发症的独立危险因素,与肾小球滤过率呈负相关[23]。IS可介导肾小管纤维化相关基因的表达,加速肾损伤,PCS是一种促氧化剂,可使肾的抗氧化能力降低,加重肾组织损伤。而这2种物质是某些肠道细菌的代谢产物,经肠道吸收入血后由肾排泄。本研究发现,给予大黄素后,患犬粪便中吲哚含量及产吲哚菌减少,血液中IS和PCS含量也随之降低。慢性肾衰竭无菌小鼠粪菌移植前的Scr、BUN含量均高于移植后,说明肠道菌群对Scr、BUN含量有调节作用,但移植粪菌液后IS、PCS含量急剧升高,可能是由于可以产生吲哚等前体物的菌群增多有关,而给予大黄素后的粪菌液可明显降低IS、PCS水平。研究结果也为大黄素通过选择性调节肠道菌群改善犬CRF提供了有力证据。
由于样本量较少,本研究仅从时间梯度研究了大黄素选择性调节患犬肠道菌群作用的动态过程,未研究大黄素浓度梯度对患犬肠道菌群的影响,今后将进一步扩增样本量,为本研究提供更多的数据资料。此外,由于16S rDNA测序技术对属以上水平的测试精确度较高,而对细菌种水平的测试精确度较低,所以本研究未涉及细菌种水平的研究。
4结论
综上所述,大黄素可以通过提高CRF患犬肠道中乳杆菌科、普氏杆菌属、乳杆菌属、丁酸梭菌属和双歧杆菌属等有益菌的丰度,降低腸杆菌科和假单胞菌科等细菌数量,从而使肠道菌群代谢物丁酸的含量升高,IS和PCS等有害物质含量降低,最终改善CRF症状。这种对菌群的调节作用,可为治疗犬及其他动物的CRF提供一种新的生态途径。
参考文献:
[1]YANG TAO,RICHARDS E M, PEPINE C J, et al. The gut microbiota and the brain–gut–kidney axis in hypertension and chronic kidney disease[J]. Nature Reviews Nephrology, 2018, 4: 442-456.
[2]NISHIYAMA K, AONO K, FUJIMOTO Y, et al. Chronic kidney disease after 5/6 nephrectomy disturbs the intestinal microbiota and alters intestinal motility[J]. Journal of Cellular Physiology, 2019, 234(5): 6667-6678.
[3]ZHAO L. The gut microbiota and obesity: from correlation to causality[J]. Nat Rev Microbiol, 2013, 11(9): 639-647.
[4]KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J].Cell, 2016, 165(6): 1332-1345.
[5]KASUBUCHI M, HASEGAWA S, HIRAMATSU T,et al. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation[J].Nutrients,2015,7(4):2839-2849.
[6]傅兴圣,陈菲,刘训红,等. 大黄化学成分与药理作用研究新进展[J].中国新药杂志,2011,20(16):1534-1538.
[7]李燕,姚萍,邓一芸,等. 大黄对急性坏死性胰腺炎大鼠肠黏膜屏障及肠道菌群的作用研究[J].中华胰腺病杂志,2014,14(2):128-130.
[8]王瑞风,雷海燕,臧璞,等. 大黄酸对糖尿病小鼠肠道菌群影响的初步研究[J].中国微生态学杂志,2016,28(1):21-25.
[9]温如燕.通过肠道菌群和Thl7/Treg细胞探讨大黄牡丹汤治疗炎症性肠病的作用机制[D].广州:广州中医药大学,2016.
[10]DOU F, LIU Y T, LIU L M, et al. Aloe-emodin ameliorates renal fibrosis via inhibiting PI3K/Akt/mTOR signaling pathway in vivo and in vitro[J]. Rejuvenation Research,2019, 22(3): 218-229.
[11]HANZLICEK A S, ROOF C J, SANDERSON M W, et al.The effect of Chinese rhubarb, rheum officinale, with and without benazepril on the progression of naturally occurring chronic kidney disease in cats[J]. Journal of Veterinary Internal Medicine, 2014, 28(4): 1121-1128.
[12]BOYD L M, LANGSTON C, THOMPSON K, et al. Survival in cats with uaturally occurring chronic kidney disease (2000-2002)[J]. J Vet Intern Med, 2008, 22: 1111-1117.
[13]MICHAEL G, STOCKELMAN J N, LORENZ F N, et al. Chronic renal failure in a mouse model of human adenine phosphoribosyltransferase deciency[J]. Am J Physiol Renal Physiol, 1998, 275:154-163.
[14]SEGATA N, IZARD J, WALDRON L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biol, 2011, 12(6): R60. DOI: 10.1186/gb-2011-12-6-r60.
[15]徐帅,林奕岑,周梦佳,等. 基于高通量测定肉鸡回肠微生物多样性及PICRUSt基因预测分析[J]. 动物营养学报, 2016, 28(8): 2581-2588.
[16]ARCHER S D, MCDONALID I R, HERBOLD C W, et al.Benthic microbial communities of coastal terrestrial and ice shelf Antarctic meltwater ponds[J]. Front Microbio, 2015, 6: 485-493.
[17]CHEN Y, YANG F, LU H, et al. Characterization of fecal microbial communities in patients with liver cirrhosis[J]. Hepatology, 2011, 54(2): 562-572.
[18]梁晋刚,刘鹏程,张秀杰. 基于16S rDNA高通量测序技术研究转基因作物对根际细菌群落结构的影响[J].江苏农业科学,2018,46(6):5-8.
[19]刘希华,江丹丹,文欣. 小飞蓬耐铅内生细菌的分离及其16S rDNA鉴定[J].江苏农业科学,2018,46(4):260-262.
[20]伦恒忠. 慢性肾脏病进展中肠道菌群变化及粪菌移植对慢性肾衰小鼠的影响[D].济南:山东大学,2019.
[21]YE G R, ZHOU M J, YU L X, et al. Gut microbiota in renal transplant recipients, patients with chronic kidney disease and healthy subjects[J]. J South Med Univ, 2018, 38(12): 1401-1408.
[22]王璐璇,劉玥宏,朱继开,等.短链脂肪酸在疾病治疗中的研究进展[J].世界华人消化杂志, 2017, 25(13): 1179-1186.
[23]成云,曹学森,邹建洲.肠源性尿毒症毒素硫酸对甲酚和硫酸吲哚酚的研究进展[J].中国临床医学,2015(6): 815-818.
(责任编辑:张震林)

