冻融期巴音布鲁克高寒湿地土壤细菌群落变化及其响应机制
陈 末,朱新萍,蒋靖佰伦,买迪努尔·阿不来孜,孙 涛,贾宏涛,2*
(1.新疆农业大学草业与环境科学学院,乌鲁木齐 830052;2.新疆土壤与植物生态过程重点实验室,乌鲁木齐 830052)
湿地生态系统单位面积储存的碳远高于任何其他生态系统[1],因而引起广泛关注。其中,高寒湿地生态系统因植被类型较为单一而更加脆弱,其有机质含量高且分解比较缓慢对气候变化极为敏感,是温室效应的指示器[2]。土壤微生物作为湿地生态系统功能过程的关键媒介[3],在驱动物质循环和能量流动过程中具有重要作用[4]。
冻融是全球中高纬度和高海拔地区的常见现象,全球气候变暖导致高寒湿地的冻融格局更加多变。相关研究证明湿地土壤微生物的生命活动可以从非生长季持续到冬季[5-6],但其生理活性会受冻融期内土壤温度[7-8]、土壤湿度[9-10]、积雪厚度[11]和土壤养分[12]等因子剧烈变化的影响。尤其在融冻期间,冰雪融化促使地表形成活跃层,进一步加强微生物复活后的生存能力[13]。并且,微生物代谢活动的变化,可能会潜在形成正反馈回路,改良表层土壤的解冻条件[14]。通常在这一阶段,微生物群落会出现呼吸峰值,更多的猜测这可能是一种应激反应[15]。
当前,冻融对土壤微生物的研究多基于时空尺度上微生物生物量[16-18]、土壤养分[19-20]、土壤温室气体排放通量[21]的监测,因地域条件等因素的限制,关于高寒湿地土壤微生物群落的研究极为少见。相较于平原湿地,高寒湿地土壤微生物群落中可能含有较多的嗜冷微生物类群,对气候变化响应更加迅速,群落演替变化更加明显。因此,探明冻融期高寒区土壤微生物群落结构和功能作用的变化以及微生物的耐冷机制显得极为重要。鉴于此,本研究以巴音布鲁克高寒湿地沼泽土壤为研究对象,在野外条件下探究冻融期土壤细菌群落结构和功能作用的变化,同时分析微生物不同影响因子的贡献率。研究结果可为高寒湿地生态系统功能过程提供基础数据,丰富高寒湿地土壤微生物生态学研究,也可为冻融期土壤微生物代谢潜能对环境变化响应机制的解析提供新思路。
1 材料与方法
1.1 采样点概况和样品采集
巴音布鲁克天鹅湖高寒湿地(83°40′~84°40′E,42°35′~43°00′N)位于新疆维吾尔自治区和静县境内,海拔2300~3042 m,面积约为770 km2,年平均气温约4.6℃,年最低气温达-48.1℃[22]。冻融期6~7个月,历史最大冻土深度为4.39 m,是我国气象站记录中的最高值[23]。湿地水分主要来源于高山冰雪融水和自然降水,被誉为中亚干旱区的空中湿岛[2]。湿地沼泽区主要植被为细果苔草(Carex microglochn)、黑花苔草(Carex melanantha)、海韭菜(Triglochin maritimum)和线叶嵩草(Kobresia capillifolia),总盖度大于80%[24]。
2018年9月,在沼泽区苔草群落内完全随机设置24块重复小区(2 m×2 m),相互间隔大于3 m,去除小区内土壤表面0~2 cm的新鲜凋落物[21],并用1 m高的钢质栅栏围护,尽量保证试验一致性。依据土壤温度和土壤湿度的变化,将冻融期分为3个阶段,分别为初冻期(2018年10月)、冻结期(2018年11月—2019年2月)、融冻期(2019年3月—4月)。于3个时期的典型天气采集小区围栏内0~5 cm表层土壤样品:t0(初冻期),t1=140 d(冻结期),t2=185 d(融冻期)。每次随机选择8个小区,小区内采用5点法采集,混合均匀后装入同一根冷存管,编号并储存于液氮罐中,用于提取微生物总DNA进行高通量测序。同位置、同方法另采集2份土壤带回实验室,自然风干后用于土壤理化性质测定。
1.2 实验方法
1.2.1 土壤理化性质测定
试验区内,设置两台15通道的自动气象站(U30-NRC,HOBO,USA)收集0~5 cm土壤温度(ST)、土壤湿度(SM)。积雪厚度(SD)为每日12:00人工测量。土壤样品研磨过筛后,采用元素分析仪(Vario El III,Elementar,Germany)测定土壤全碳(TC)和土壤全氮(TN),TC和TN的比值作为土壤碳氮比(C/N)。
1.2.2 细菌16SrDNA测序
采用微生物Marker基因高通量测序评估细菌群落结构和多样性,使用MN NucleoSpin 96 Soil试剂盒/强力土壤DNA提取试剂盒(PowerMag™Soil DNA iso⁃lation Kit,MOBIO)从样品中提取细菌总DNA。细菌16SrRNA基因的V3~V4区用普通引物对(正向引物338F,5′-ACTCCTAGGGAGGAGCA-3′扩增;反向引物806R,5′-GGACTCHVGGGTWTTAT-3′)结合适配器序列和条形码序列进行扩增。本研究所有样品的测序和生物信息服务均在北京百迈客生物科技有限公司Illumina Hiseq 2500平台完成。
1.3 分析方法
1.3.1 数据分析
基于R(v3.3.2)的agricolae软件包进行正态分布和方差齐性检验(Normal distribution and homogeneity of variance Test)及单因素方差分析(One-way ANO⁃VA),并在5%显著性水平下做LSD(Least significant difference)多重比较。
1.3.2 生物信息学分析
使用FLASH(v1.2.11)对原始数据进行拼接,通过Trimmomatic(v0.33)将拼接得到的序列进行质量过滤,借助UCHIME(v8.1)去除嵌合体,获得高质量Tags序列。使用USEARCH(v10.0)对OTU进行相似度为97%的聚类,以测序所有序列数的0.005%作为阈值过滤OTU。使用RDPClassifier(v2.2)对分类群进行分类,最小可信度估计为80%。
借助Mothur(v1.30)分析细菌群落α多样性,通过ggpubr软件包中Kruskal-Wallis检验比较组间差异,并使用ggplot软件包完成绘图。使用ggalluvial等软件包绘制细菌群落丰度变化冲击图。冗余分析(Reundancy analysis,RDA)环境因子对细菌群落组成的影响,蒙特卡罗置换检验(Monte Carlo permutation,n=999)测试分析结果的显著性。基于KEGG数据库,使用STAMP(v2.1.3)进行细菌功能差异显著性分析及绘图。
2 结果与分析
2.1 冻融期土壤理化性质的变化
依据土壤温度、土壤湿度的变化,将冻融期分为初冻期、冻结期和融冻期(图1)。在t0(初冻期)采样7 d后,试验阶段内首次降雪。一个月后进入冻结期,土壤湿度迅速降低至25%左右。t0(初冻期)至t1(冻结期)的大部分时间里,样地内土壤温度在0℃以下,积雪厚度超过25 cm。t1(冻结期)采样后,积雪融化,土壤温度和土壤湿度均开始升高。最终取样t2(融冻期),在研究区域内所有积雪融化后一周进行。冻融期内,土壤TC和TN均呈先显著下降后显著升高的趋势,而C/N则相反(表1)。
2.2 冻融期土壤细菌群落物种多样性的变化
所有测序文库的覆盖度均在99.5%以上,绝大部分细菌的序列可以被测出。3个时期土壤细菌群落α多样性差异显著(图2)。OTU数量(OTUs)在t1(冻结期)细菌群落中显著减少,并在t2(融冻期)细菌群落中显著增加(图2a);可观察到的物种数目也具有相似趋势(图2d),且t0(初冻期)细菌群落中物种数量显著高于t2(融冻期)。从香农指数和辛普森指数来看(图2b和图2c),t2(融冻期)细菌群落的物种多样性略优于t0(初冻期),远高于t1(冻结期)。而比较ACE指数和Chao1指数可以看出,t0(初冻期)细菌群落丰富度优于t2(融冻期),远高于t1(冻结期)(图2e和图2f)。
2.3 冻融期土壤细菌群落结构的变化
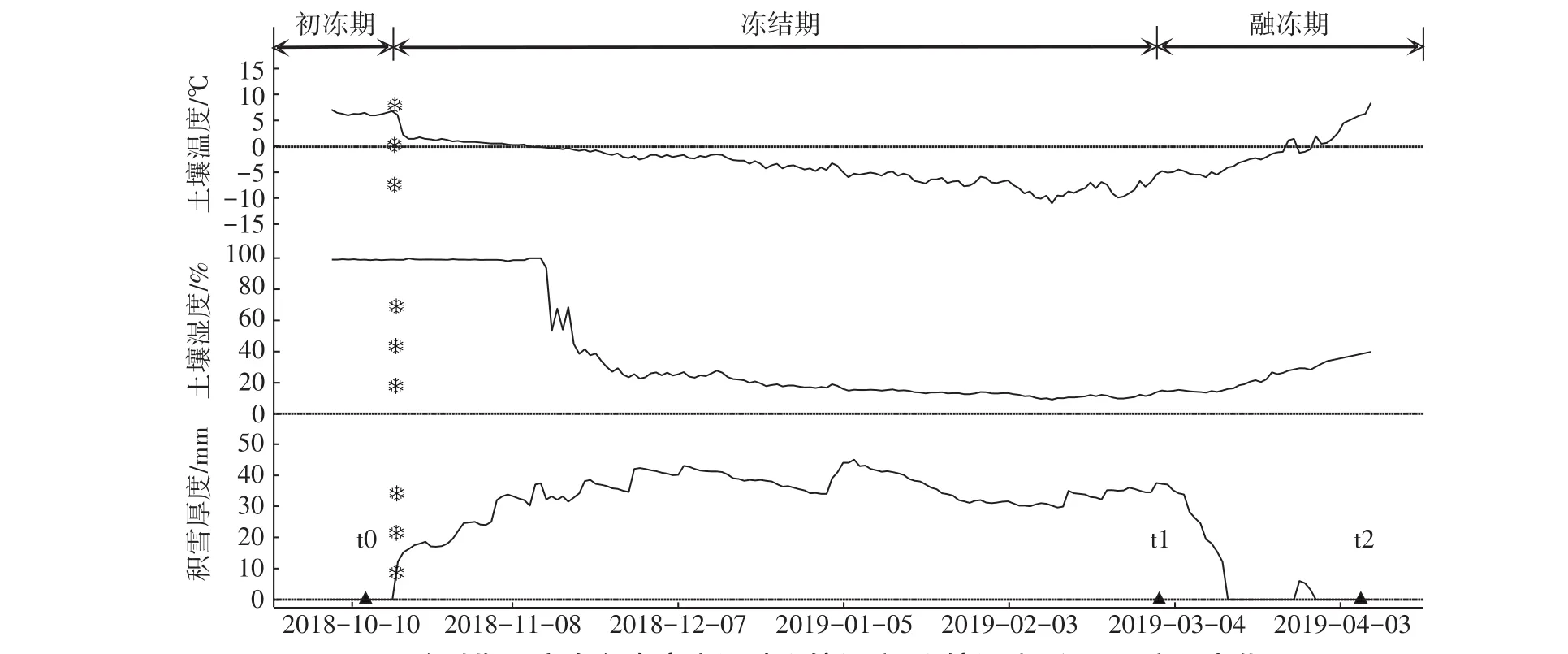
图1 冻融期巴音布鲁克高寒湿地土壤温度、土壤湿度、积雪厚度日变化Figure 1 Daily changes of soil temperature,soil moisture and snow depth in Bayinbuluk alpine wetland during freeze-thaw period

表1 冻融期巴音布鲁克高寒湿地土壤(0~5 cm)基本特征Table 1 Basic characteristics of soil(0~5 cm)in Bayinbuluk alpine wetland during freeze-thaw period
虽然细菌群落结构在生物复制中具有很大差异,但总体变化趋势显而易见。在各个水平上,随时间推移,优势菌类群演替明显。在门水平上(图3a),t0(初冻期)和t1(冻结期)样品细菌群落更相似,均以Pro⁃teobacteria(变形菌门)为主(12.8%~45.7%),而t2(融冻期)样品中可以看到Chloroflexi(绿弯菌门)丰度的增加。在纲一级(图3b),3个时期均以嗜酸性变形杆菌为主。t0(初冻期)样品中以Alphaproteobacteria(α-变形杆菌纲)丰度较高;t1(冻结期)和t2(融冻期)样品中Gammaproteobacteria(γ-变形杆菌纲)丰度较高,同时,Betaproteobacteria(β-变形杆菌纲)仅存在于t0(初冻期)细菌群落中。更多的变化在目水平中可见(图3c),例如,Anaerolineales(厌氧绳菌目)和Rhodospirillales(红螺菌目)在t0(初冻期)细菌群落中丰度最高,而在t1(冻结期)和t2(融冻期)细菌群落中骤减;t1(冻结期)细菌群落中含有更多的Bacteroida⁃les(拟杆菌目)。在属一级也发现了相同的模式(图3d),同时各时期稀有分类群水平升高。Brevundimonas(短波单胞菌属)是t0(初冻期)的代表,Ilumatobacter属、Luteolibacter属和Tabrizicola属在t2(融冻期)中丰度较高。然而,由于检测出更多的稀有类群,超过70%的reads不能够被准确分类到该水平。
2.4 冻融期土壤环境和养分对细菌群落结构变化的影响
冗余分析表明,两个维度共同解释了冻融期土壤细菌群落结构变化(门水平)的87.29%(图4),揭示了土壤环境对细菌群落β多样性的影响。其中,环境因子解释的变量为84.74%,土壤养分因子解释量为73.91%,两组变量的共同解释量为71.36%。蒙特卡罗置换检验结果显示,该排序模型在P=0.001时显著,所有影响因子均与细菌群落分布极显著相关。冻融期土壤环境的剧烈变化,对土壤细菌群落结构组成产生显著影响。t0(初冻期)细菌群落主要受土壤湿度的影响较大;t1(冻结期)细菌群落受控于积雪厚度,经受t0(初冻期)~t1(冻结期)阶段土壤环境的选择作用,Bacteroidetes(拟杆菌门)成为t1(冻结期)细菌群落的优势菌群;而Tenericutes(软壁菌门)是t2(融冻期)细菌群落的特征物种。同时,土壤温度和C、N含量在t0(初冻期)和t2(融冻期)采样时期较为相似,与t1(冻结期)具有很大差异。
2.5 冻融期土壤细菌群落功能作用的变化
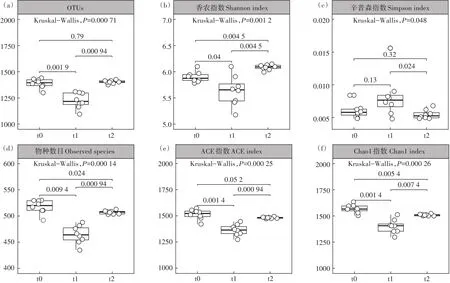
图2 冻融期巴音布鲁克高寒湿地土壤细菌群落α多样性Figure 2 Alpha diversity of soil bacterial communities in Bayinbuluk alpine wetland during freeze-thaw period
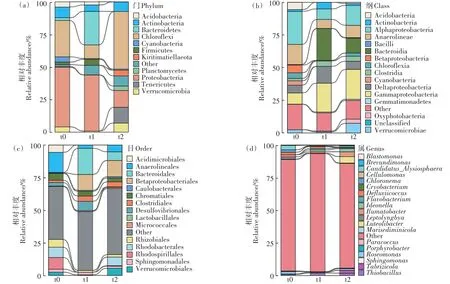
图3 细菌群落中门(a)、纲(b)、目(c)和属(d)成员的结构和相对丰度Figure 3 Structure and relative abundance of members of phylum(a),class(b),order(c)and genus(d)in bacterial community
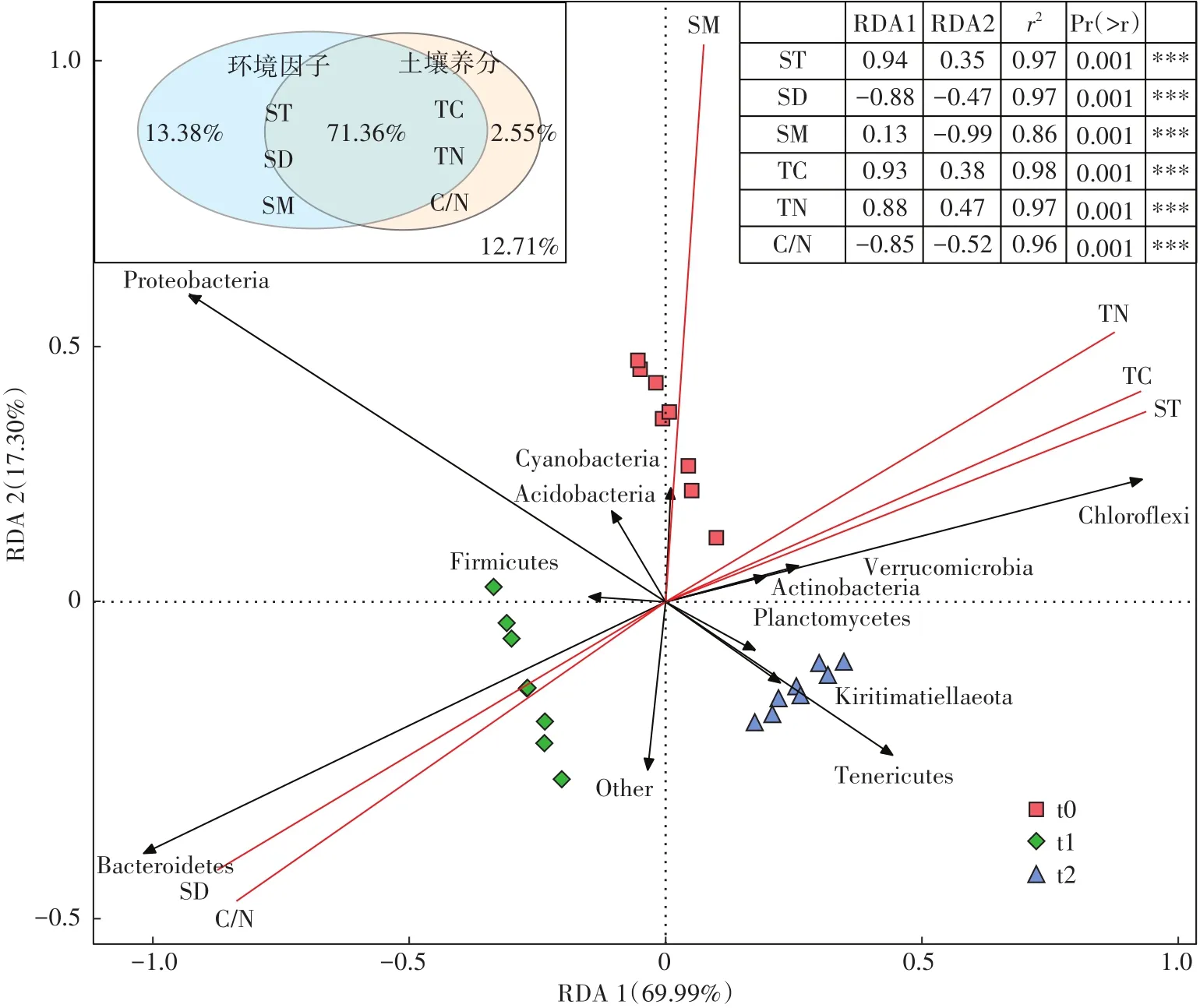
图4 冻融期土壤环境和养分对细菌群落结构变化影响的冗余分析Figure 4 RDA analysis of effects of soil environment and nutrientson changes of bacterial community structure during freeze-thaw period
通过PICRUSt功能注释软件将测序所得细菌群落组成“映射”到Greengenes数据库中,基于基因功能谱预测细菌基因组的潜在功能。3个时期,细菌群落包含的功能基因组成不同,通路类型差异显著,表现出群落功能作用的多样性和阶段性。
“代谢”是最主要的通路类型(图5a)。t0(初冻期)和t2(融冻期)细菌群落中包含更多氨基酸、脂类、能量和与异生素代谢相关的功能基因。而相比于t2(融冻期)细菌群落,萜类化合物和聚酮化合物的代谢功能在t0(初冻期)和t1(冻结期)细菌群落中更多的被表达。同时,聚糖合成与代谢相关的功能作用在t1(冻结期)和t2(融冻期)细菌群落中得到了加强。“分子信号转导”是另一组通路类型,在细菌群落的功能预测中具有重要意义。相比于t0(初冻期)细菌群落,“转录”“翻译”和“信号转导”功能基因在t1(冻结期)和t2(融冻期)细菌群落中的表达更显著(图5b)。同时,细菌群落的“环境适应性”“细胞活性”和“细胞生长和死亡”也是3个时期细菌群落功能显著差异的一类通路类型(图5c)。t1(冻结期)和t2(融冻期)时期,细菌群落需要更高的细胞活性来适应冻融期的环境变化,但是仍然无法避免部分细菌类群在冻结期的消亡。
3 讨论
3.1 冻融对高寒湿地土壤细菌群落结构的影响
冻融期内,高寒湿地土壤细菌群落的α多样性指数变化趋势明显。t1(冻结期)细菌群落的多样性、丰富度及均匀度远低于t0(初冻期)和t2(融冻期)。t0(初冻期)土壤细菌群落复杂而稳定,生存环境适宜,物种数量最高。t1(冻结期)土壤温度和土壤湿度对细菌群落具有较为强烈的选择作用,大量细菌死亡,导致群落物种多样性骤降。随着t2(融冻期)的到来,土壤环境转良,群落中优势菌种加速繁殖。但由于冻融期环境因子的影响贡献率较大,以致于细菌群落从冰冻中恢复后,大部分细菌类群活动表达存在潜在的时间延迟,这与我国东北沼泽土壤细菌冻融前后群落变化趋势基本一致,差别主要表现在细菌类群丰度上的差异[25],后者细菌类群中Acidobacteria(酸杆菌门)、Firmicutes(厚壁菌门)丰度较高。这些差异可能是由地域气候、土壤养分及地上植被组成的不同造成的。
细菌群落结构对冻融期土壤环境变化响应敏感。高寒湿地土壤细菌群落进化出一系列复杂的适应能力,以抵消低动能环境和冰水转化的潜在不利影响。冻融期土壤温度、土壤湿度及积雪厚度的变化是影响细菌群落结构变化的主要因素。生长活跃的细菌类群,通常受冻融的影响更为严重。本试验中,Chloro⁃flexi(绿弯菌门)在t1(冻结期)阶段丰度骤降,Acido⁃bacteria(酸杆菌纲)和Betaproteobacteria(β-变形菌纲)甚至出现了消亡殆尽的现象。土壤碳氮养分的利用也被证明与异养细菌数量呈线性关系,而温度和水分的有效性同样也是影响异养细菌活性的重要因素[7]。短期冻融过程,C/N较低的细菌群落占比更大,部分类群仍保持较高活性,增强了土壤中无机氮的固持。具体的研究结果更依赖于冻融对微生物群落的影响强度以及微生物群落的恢复能力[26]。冗余分析结果显示,冻融期t0(初冻期)和t2(融冻期)细菌群落中细菌群落结构与土壤TC、土壤TN关系更密切,而t1(冻结期)细菌群落则相反。同时,土壤TC和土壤TN在t1(冻结期)土壤细菌群落中含量最低,这可能是在t0(初冻期)~t1(冻结期)的前期阶段,细菌群落活性较高,消耗了更多的土壤氮素的结果。对冻融期东北沼泽湿地土壤细菌群落的研究,通过主坐标分析(PCoA)同样证实了细菌群落结构在冻融前后发生了明显变化[25],并通过冗余分析说明温度和溶解性碳是湿地土壤细菌群落短期冻融前后发生变化的主要影响因子,综合分析与本研究整体保持一致。总体来说,冻融期内土壤细菌群落中细菌群落结构差异明显,演替频繁,证明了细菌群落对环境变化的响应是迅速的。冻融期后,细菌群落多样性和丰富度、均匀度均有所增加,也体现出不同的细菌类群在应对冻融期环境变化时具有不同的生存策略。
3.2 冻融对高寒湿地土壤细菌群落功能的影响
为更好地理解高寒湿地土壤微生物生态学,应将微生物群落功能与环境因子结合分析。细菌类群进化多种生理适应机制应对冻融环境变化,这使得它们可以在环境胁迫下生存甚至保持活跃。细菌群落的抗寒机制主要体现在膜流动性的调控、应答因子的产生、冷适应性基因的响应等方面。细菌群落矿化分解生态系统中的碳氮养分以支持自身面对压力的生理反应及抗逆能力[27]。
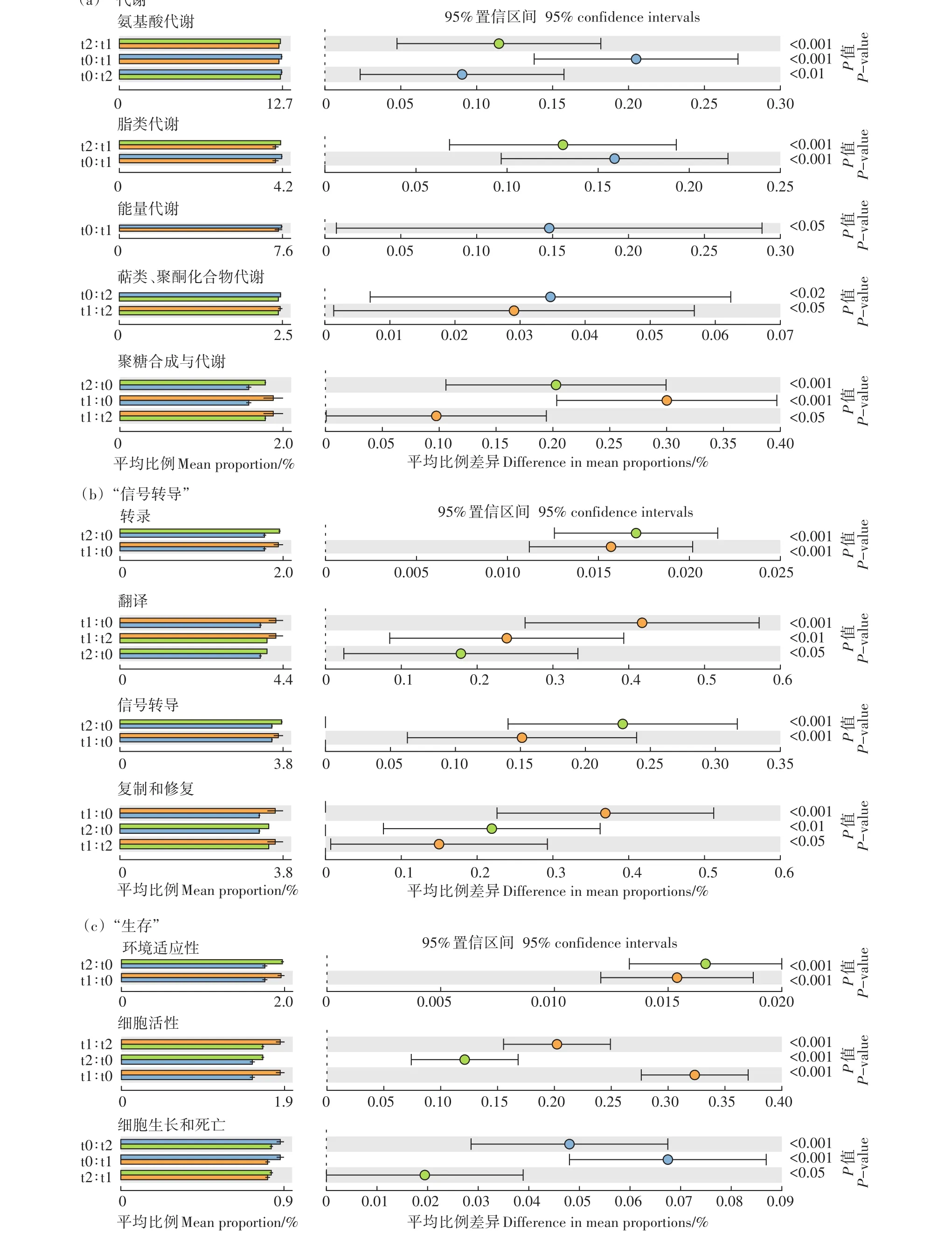
图5 冻融期巴音布鲁克高寒湿地土壤细菌功能作用差异显著性分析Figure 5 Significant difference analysis of soil bacterial functions in Bayinbuluk alpine wetland during freeze-thaw period
在t0(初冻期)和t2(融冻期)的土壤细菌群落中,“代谢”组功能基因通路被显著表达。氨基酸代谢是涉及大量代谢产物的复杂过程,也是脂类、碳水化合物、核酸和信号分子合成的前体,在能量的生产中被用作底物。而细菌进行能量代谢,完成三羧酸循环和氧化磷酸化过程与土壤中碳氮养分保持紧密关系。脂类作为生物体维持正常生命活动不可缺少的四大基本物质之一,其合成代谢在能量存储中起直接作用,同时因其影响细胞膜构成而对物质运输起到一定的间接作用。通过初级代谢,细菌群落可以将营养物质转化为结构物质、具有生理活性的物质或为生长提供能量。初级代谢的产物,都是机体生存的必备基础,因此极为重要。初级代谢紊乱,可以导致细菌的生长障碍甚至突变或死亡。同时,在一定的生长阶段会出现次级代谢类型,其对环境条件极为敏感。如萜类化合物、聚酮类化合物代谢等,在抗生素、激素的产生及抗逆性的增强方面具有重要意义[28]。t0(初冻期)和t2(融冻期)细菌群落中,Proteobacteria(变形菌门)和Chloroflexi(绿弯菌门)占比较大,遗传多样性极为丰富,生理代谢类型更为广泛,且具有纤维素的降解作用。Cyanobacteria(蓝藻门)作为t0(初冻期)细菌群落的代表类群,可直接固氮提高土壤肥力。Acido⁃bacteria(酸杆菌门)作为t0(初冻期)细菌群落的又一代表类群,在降解植物残体多聚物方面具有重要作用。t0(初冻期)土壤环境温和稳定,新鲜的凋落物对细菌群落可能具有一定的刺激作用。
在t0(初冻期)~t1(冻结期)阶段的后期,土壤环境的剧烈变化对细菌群落具有胁迫作用。当细菌群落受到如碳氮养分匮乏、冷激或热激过程以及渗透压失常等胁迫时,RNA聚合酶依靠大量Rpos识别启动子,调节基因表达,促进生存所必需基因的转录表达,这一系列的复杂过程可以发生在转录和翻译阶段或者降解过程中,以及活性调节方面[29]。t1(冻结期)土壤细菌群落中含有更多的“分子信号转导”功能基因,同时,对应着典型常见嗜冷菌类Bacteroidetes(拟杆菌门)、Firmicutes(厚壁菌门)丰度的增加。嗜冷菌tRNA转录后被修饰的程度较低,从而降低结构稳定性,细胞膜含有大量不饱和脂肪酸,防止细胞膜从液晶态转变为凝胶态,保证膜具有良好柔性和流动性[30],这也是长时间低温环境驯化的结果。土壤环境温度的骤降,促使细菌相应诱导表达多种冷激蛋白,从而协助低温胁迫条件下RNA的转录以及DNA的复制,维持DNA和RNA二次结构低温下的可变性,如转录、翻译、蛋白质折叠以及细胞膜透性调控等。
环境因子的强烈筛选作用,导致t1(冻结期)土壤细菌群落结构的变化,部分嗜冷菌类群成为优势菌群。与此同时,“生存”是微生物所有功能作用的基本,在t0(初冻期)群落中表达最频繁的是“细胞的生长和死亡”功能基因,演替是细菌群落的常态。而在t1(冻结期)和t2(融冻期)细菌群落中,更多被表达的功能基因是“环境适应性”和“细胞活性”,以增加自身的抗寒性,适应高寒湿地的低温环境。
高寒湿地土壤微生物生态学一直是湿地科学研究的薄弱环节,亟需更多关注。人类对微生物活动的了解远滞后于环境变化,更多的科学问题不断涌现。微生物群落的功能组成对气候变化的适应机制如何?冻土区或冻融区土壤养分的有效性及其对微生物功能群落及酶活性的影响如何?未来应开展增加系统研究,综合运用多种技术方法来度量微生物生理活动,为厘清和预测未来气候变化条件下微生物在地球化学循环过程中的功能作用提供科学信息。
4 结论
(1)冻融期对巴音布鲁克高寒湿地土壤细菌群落物种多样性产生较大影响。冻结期,细菌群落物种多样性、丰富度以及均匀度均显著降低。
(2)冻融期内,细菌群落受土壤环境和养分的显著影响,群落结构对微生境变化响应迅速,优势菌群演替过程明显。
(3)细菌群落功能发生显著变化,整体趋势表现为:冻融期前期,通过“代谢”供能和“信号转导”调控来增强群落的“环境适应性”(抗寒性),从而维持冻结期和融冻期的“生存”及“细胞活性”。

