蒙古黄芪多糖通过调控Nrf-2信号通路缓解地塞米松诱导的糖脂代谢紊乱①
颜 妍 肖伟利 钟明月 黄 建 李欣益 吴学梅 王玉珍
(内蒙古农业大学生命科学学院制药工程系,呼和浩特 010018)
蒙古黄芪(Astragalus mongholicus Bunge)是豆科黄芪属植物,是一味补益类中药,其在保护心肌、调节血压和提高免疫力等方面有很好的疗效。蒙古黄芪多糖(astragalus polysacharin,APS)是蒙古黄芪中含量最多的主要活性成分之一,包括杂多糖、葡聚糖、中性多糖和酸性多糖,而且蒙古黄芪多糖具有抗病毒、抗肿瘤、抗氧化和抗衰老等药理作用[1,2]。除此之外,现有研究显示蒙古黄芪多糖还具有调节血糖和血脂的作用[3]。随着人们生活水平的提高,糖脂代谢紊乱的发生率也在增加,但蒙古黄芪多糖对其的影响及其机制研究还很缺乏。
地塞米松(dexamethasone,DEX)是一类具有抗炎、抗内毒素,抑制免疫等药理作用的糖皮质激素,但当长期或大剂量使用时则会出现诸多副作用,当前已有实验表明过量地塞米松会导致血脂异常[4]。近年来,代谢综合征的患病率和发病率呈逐年上升趋势,严重危害全球公众健康,而糖脂代谢紊乱是代谢综合征的重要组成部分。能够诱发糖脂代谢紊乱的诱因有许多,比如昼夜失调、菌群失调、长期的高脂饮食以及胰岛素抵抗等[5]。而且肝脏是糖代谢过程中起关键作用的器官,它是糖酵解、糖异生以及糖原合成与分解的重要脏器,因此肝脏损害会导致血糖调节的严重失衡[6]。在此次研究中,我们采用地塞米松诱导构建大鼠糖脂代谢紊乱模型。氧化应激是诸多肝脏疾病共同的发病机制,Nrf2-ARE是体内一条极为重要的抗氧化应激信号通路,在肝脏疾病的发生发展中起着重要作用[7]。CAT是过氧化物酶,也是氧化应激里的重要成员之一。由于蒙古黄芪多糖具有抗氧化作用,但其发挥抗氧化作用是否与Nrf2-ARE和CAT有关,并且对地塞米松诱导的糖脂代谢紊乱是否有作用尚不明确。因此,此次实验采用地塞米松诱导构建大鼠糖脂代谢紊乱模型,研究蒙古黄芪多糖是否通过Nrf2-ARE和CAT对其有所缓解,为糖脂代谢紊乱的缓解和治疗奠定基础。
1 材料与方法
1.1材料 实验用黄芪为蒙古黄芪,蒙古黄芪多糖由本实验室分离提取,SD雄性大鼠购自北京维通利华实验动物有限公司。地塞米松磷酸钠注射液购自国药集团容生制药有限公司;组织蛋白提取液购自康为世纪生物有限公司;BCA蛋白质定量检测试剂盒购自上海生物工程有限公司;总RNA抽提试剂Trizol和反转录试剂盒均购自日本TaKaRa生物公司;胰岛素ELISA检测试剂盒购自EMD Millipore corporation;GCLC抗体购自爱博泰克生物科技有限公司;β-actin抗体购自Proteintech公司;Western blot 二抗购自LI-COR公司。
1.2方法
1.2.1动物实验方法 50只雄性SD大鼠,体质量(180±20)g随机分为5组,即空白组(Control)、地塞米松组(DEX)、蒙古黄芪多糖低剂量组(DEX+APS50)、蒙古黄芪多糖中剂量组(DEX+APS100)和蒙古黄芪多糖高剂量组(DEX+APS200)。实验鼠给予普通维持饲料,自由饮用水,实验前适应两周。2周后,DEX组、DEX+APS50组、DEX+APS100组和DEX+APS200组分别给予1 mg/kg的地塞米松磷酸钠注射液,空白组给予等体积的无菌水,腹腔注射给药。DEX+APS50组、DEX+APS100组和DEX+APS200组分别给予50 mg/kg、100 mg/kg和200 mg/kg的蒙古黄芪多糖灌胃,空白组和DEX组给予等体积无菌水。实验期间每3 d测一次空腹血糖,并且密切关注大鼠的生活状态,14 d后禁食不禁水,腹主动脉取血,处死大鼠,收集血液和肝脏,部分肝脏置于4%中性甲醛中固定,用于HE染色,其余-80℃冻存以备后续实验。然后进行血清的GLU、FINS、ALT、AST、TG和CHOL等生化指标的检测。
1.2.2血清中FINS、ALT、AST和TG等生化指标的检测 采集的血液静置4 h凝固后,4℃,3 000 r/min离心10 min,分离血清,立即检测。血清中的FINS含量通过胰岛素ELISA检测试剂盒检测;血清中ALT、AST和TG等指标含量通过全自动生化分析仪测定,测定结果由内蒙古自治区人民医院检验科提供。
1.2.3肝脏组织病理形态学检测 4%中性甲醛固定的肝脏组织,经石蜡包埋切片后,用苏木素-伊红染色(HE),最后置于200倍光学显微镜下观察肝脏组织形态。
1.2.4Real-time PCR分析 肝脏组织采用Triol法提取RNA,然后以500 ng RNA为模板进行反转录,然后进行后续的RT-PCR检测,采用2-ΔΔCT方法分析数据。引物序列见表1。
1.2.5Western blot检测肝脏组织中GCLC的表达情况 肝脏组织按照重量∶体积=1∶9的比例加入组织蛋白抽提液,经破碎后12 000 r/min离心10 min得到10%的肝脏匀浆。利用BCA试剂盒方法检测蛋白含量。经SDS-PAGE电泳分离所需蛋白,半干法转膜到聚偏二氟乙烯膜(PVDF)。5%脱脂奶粉封闭3 h后,按1∶1 000分别加入GCLC和β-actin抗体,4℃孵育过夜。第二天经TBST洗膜5次后,按1∶10 000加入Goat anti-Rabbit IRDye®800 CW 二抗室温孵育90 min,再次洗膜后用Odyssey红外激光扫描成像仪分别检测GCLC的表达量,并分析其变化。

2 结果
2.1蒙古黄芪多糖对血清中ALT、AST和ALP水平的影响 血清中的ALT、AST和ALP一般作为肝脏功能是否正常的主要指标。如图1所示,给予地塞米松后,DEX组ALT、AST和ALP水平显著比Control组升高(P<0.01,P<0.05);但给予蒙古黄芪多糖后,与DEX组相比,APS给药组均显著降低了ALT、AST和ALP水平(P<0.01),说明蒙古黄芪多糖可能通过下调ALT、AST和ALP水平来缓解地塞米松诱导的肝损伤,其中当蒙古黄芪多糖给予200 mg/kg 时效果相对最好。
表1 Real-time PCR引物序列
Tab.1 Primer sequences of Real-time PCR

Primer namePrimer sequence(5'-3')β-actin sense CGCGAGTACAACCTTCTTGCβ-actin antisenseATACCCACCATCACACCCTGGNrf-2 sense CCCAGCAGGACATGGATTTGNrf-2 antisense TTTGGGAATGTGGGCAACCTGCLC sense GCACATCTACCACGCAGTCAAGCLC antisense ATCGCCGCCATTCAGTAACAACHO-1 senseGGTCCTGAAGAAGATTGCGHO-1 antisenseAAGACAGCCCTACTTGGTTCAT sense GTACAGGCCGGCTCTCACACAT antisense AACCCGTGCTTTACAGGTTAGC

图1 蒙古黄芪多糖对血清中ALT、AST和ALP的影响
2.2蒙古黄芪多糖对肝脏组织病理形态的影响 如图2所示,Control组肝细胞绝大多数正常,部分细胞有轻微的脂肪变性,肝组织结构完整;给予地塞米松后,DEX组肝脏细胞普遍存在轻度到中度甚至重度的颗粒变性、水泡变性和脂肪变性。但当给予蒙古黄芪多糖后,肝脏病变程度有所恢复,DEX+APS50组和DEX+APS100组中央颗粒变性相对较轻,可见多数肝细胞轻度脂肪变性;DEX+APS200组少量肝细胞出现轻度的颗粒变性和脂肪变性。由此可见蒙古黄芪多糖对地塞米松引起的肝脏病变具有一定的缓解作用,其中给予200 mg/kg的时候缓解效果比较明显。
2.3蒙古黄芪多糖对血清中糖脂指标的影响 糖脂指标是糖脂代谢紊乱中最为重要的指标,因此我们对血清中的GLU、FINS、TG和CHOL指标进行检测并分析。如图3所示,给予地塞米松后,DEX组的GLU、FINS、TG和CHOL水平均显著高于Control组(P<0.01),说明模型是建立成功的。而给予蒙古黄芪多糖后,与DEX组相比,APS给药组均显著降低了GLU和CHOL水平(P<0.01);在FINS和TG水平,DEX+APS50组均显著降低了其含量(P<0.05),DEX+APS100组和DEX+APS200组也有所降低。在TG水平,DEX+APS50组和DEX+APS200组显著降低了其含量(P<0.01,P<0.05),DEX+APS100组也有所降低。由此可知,蒙古黄芪多糖对地塞米松诱导的糖脂代谢紊乱有很好的缓解作用。
2.4蒙古黄芪多糖对Nrf-2信号通路的影响 蒙古黄芪多糖具有很好的抗氧化作用,因此对抗氧化通路Nrf-2及其下游基因进行检测。如图4所示,给予地塞米松后,DEX组GCLC、HO-1和CAT的mRNA水平均显著下降(P<0.01)。蒙古黄芪多糖作用后,GCLC和CAT的mRNA水平均显著升高(P<0.01);DEX+APS50组和DEX+APS100组Nrf-2和HO-1的mRNA水平均显著升高(P<0.01,P<0.05),DEX+APS200组也有所升高。说明蒙古黄芪多糖可能是通过抗氧化作用来缓解地塞米松诱导的糖脂代谢紊乱。
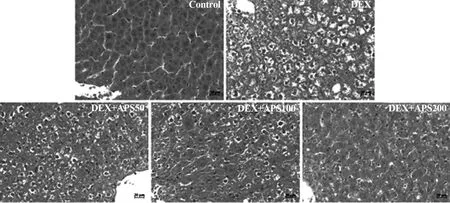
图2 蒙古黄芪多糖对肝脏组织病理形态的影响

图3 蒙古黄芪多糖对血清中糖脂指标的影响
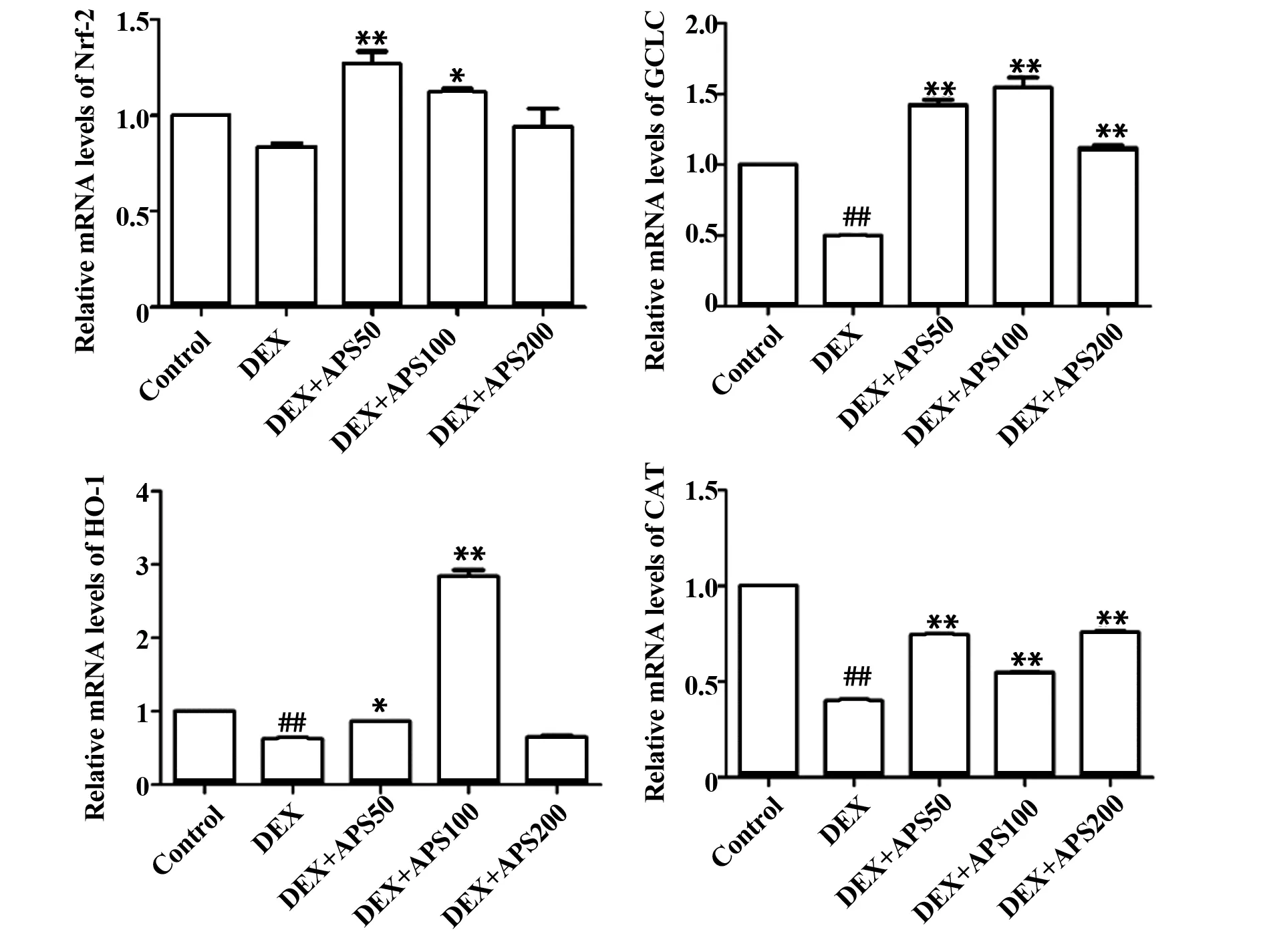
图4 蒙古黄芪多糖对抗氧化指标的影响
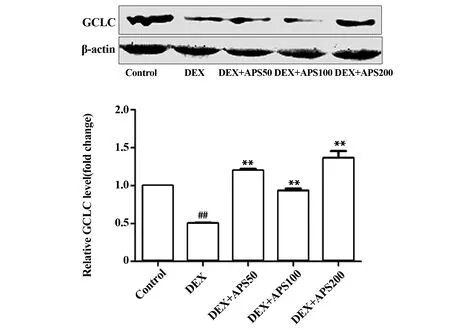
图5 Western blot检测蒙古黄芪多糖对GCLC的影响
2.5蒙古黄芪多糖对肝脏中GCLC表达的影响 如图5所示,DEX组与Control组相比,GCLC蛋白表达量降低;蒙古黄芪多糖作用后,DEX+APS50组、DEX+APS100组和DEX+APS200组均显著提高了GCLC的蛋白表达量,灰度扫描分析结果与之相符。说明蒙古黄芪多糖能够提高GCLC的蛋白表达量,缓解地塞米松诱导的糖脂代谢紊乱。
3 讨论
肝脏是人体葡萄糖和脂质代谢的主要器官,在维持血糖稳定和脂质代谢正常中具有关键作用,因此当肝脏损伤时极易发生糖脂代谢紊乱[8]。除此之外,肝脏对胰岛素极其敏感,而当肝脏发生胰岛素抵抗时会导致肝脏糖脂代谢出现紊乱,肝脏葡萄糖过量生成,脂质异常累积[9]。现有研究表明,地塞米松可以诱导发生胰岛素抵抗以及肝损伤[10,11]。因此,此次实验选用地塞米松诱导大鼠糖脂代谢紊乱模型。通过检测血清中肝脏功能主要指标和糖脂指标,结合HE染色结果进一步探究蒙古黄芪多糖对糖脂代谢紊乱的影响作用,并且根据蒙古黄芪多糖的抗氧化作用,通过Nrf2-ARE和CAT抗氧化通路进一步揭示APS对糖脂代谢紊乱的缓解机制。
由上述结果可知,地塞米松作用于大鼠后,ALT、AST和ALP水平均显著高于空白组;HE染色结果显示DEX组有明显的脂肪沉积;糖脂指标GLU、FINS、TG和CHOL也均显著高于空白组。说明此次糖脂代谢紊乱模型建立成功。而在给予蒙古黄芪多糖后,APS显著降低了ALT、AST和ALP水平;从肝脏病理组织形态学中也可以看出,APS对肝脏组织的脂肪沉积具有很好的缓解作用;而且APS还显著降低了GLU、FINS、TG和CHOL含量。除此之外,DEX作用后,Nrf-2、GCLC、HO-1和CAT的含量均明显降低;而在给予APS后,Nrf-2、GCLC、HO-1和CAT的含量均显著升高。由此可以说明,蒙古黄芪多糖可以缓解糖脂代谢紊乱。
综上所述,可以认为蒙古黄芪多糖是通过升高Nrf-2、GCLC、HO-1和CAT的含量发挥抗氧化作用,以此缓解地塞米松诱导的糖脂代谢紊乱。此外,对蒙古黄芪多糖与地塞米松诱导糖脂代谢紊乱的深入研究,有助于更全面的解释蒙古黄芪多糖对糖脂代谢紊乱的影响机制,也为蒙古黄芪多糖有望成为代谢性疾病的治疗药奠定了基础。