银北盐碱区植物根际土壤酶活性及微生物群落特征*
田平雅,沈 聪,赵 辉,张 莹,代金霞
银北盐碱区植物根际土壤酶活性及微生物群落特征*
田平雅,沈 聪,赵 辉,张 莹,代金霞†
(宁夏大学生命科学学院,西部特色生物资源保护与利用教育部重点实验室,银川 750021)
开展盐碱区耐盐植物根际微生物群落多样性研究,对于盐碱土壤的植被恢复和生态修复具有重要意义。运用Biolog 微平板技术,对宁夏银北盐碱区6种耐盐植物根际土壤酶活性及微生物群落代谢功能多样性进行研究。结果表明:不同植物根际土壤理化性质和酶活性存在一定的差异。与裸地相比,6种植物能显著提高盐碱地土壤酶活性,苜蓿根际土壤三种酶活性显著高于其他植物。土壤平均颜色变化率(AWCD)随培养时间的延长而逐渐增加,大小顺序依次为苜蓿(MX)、芨芨草(JJC)、柽柳(CL)、柳枝稷(LZJ)、苦豆子(KDZ)、枸杞(GQ)和裸地土壤(CK),根际土壤与盐碱裸地土壤之间差异显著(<0.05)。土壤微生物群落香农指数、辛普森指数和麦金塔指数均以苜蓿根际土壤最高,芨芨草次之,二者较其他土壤差异显著(<0.05)。不同植物根际土壤微生物碳源利用能力存在差异,苜蓿根际土壤微生物的利用率显著高于其他土壤(<0.05),碳水化合物类是根际土壤微生物的主要碳源,其次为氨基酸类和羧酸类,胺类的利用率最小。主成分分析显示,对PC1 和PC2 起分异作用的主要碳源为碳水化合物类和羧酸类。综合各项指标,均表现为植物根际土壤优于盐碱裸地,其中苜蓿和芨芨草能显著提高土壤微生物群落功能多样性,对盐碱地根际微环境的养分循环具有积极意义。
盐渍化土壤;根际微生物;土壤酶活性;群落多样性;Biolog 法
土壤微生物在生态系统的物质循环和能量转化中占有特别地位,在土壤形成和肥力积累过程中起着极为重要的作用[1]。根际是土壤-植物生态系统物质交换的活跃界面。根际微生物作为重要的物质转化调节器,其生物活性、种类特征能反映土壤的肥力和植物的营养状况,是对包括植物、土壤和气候在内的环境因素综合影响的响应[2-3]。研究表明,地上植被通过其凋落物和根系分泌物显著影响着土壤微生物的群落特征。因此,研究根际微生物群落特征有助于从植被-土壤-微生物三者的互作关系了解植被恢复对土壤环境生物学方面的改善状况[4]。
土壤盐碱化通常与荒漠化过程相伴而生,造成环境资源的破坏和农业生产的巨大损失,是目前全球最严重的环境问题之一。开发和利用盐碱地资源已成为广大盐碱地区进一步挖掘农业现有发展潜力的一条重要出路。位于宁夏银川北部的盐碱区属我国5大盐碱土区的西北半干旱盐碱土区,蒸发量远高于降水量,土壤盐碱化已成为影响宁夏农业生产和经济发展的限制性因素之一,改良银北地区的盐碱土壤对宁夏农牧业发展以及生态环境的保护具有重要意义。
盐渍化土壤中各种微生物类群的数量和分布,是土壤成分和不同植被类型共同作用的结果,目前国内关于盐渍化土壤和改良后土壤微生物多样性的基础研究很多,从耐盐植物根际微生物的角度去分析土壤盐渍化发生的改变及植物根际土壤微生物群落变化的研究却很少[5]。微生物群落功能多样性作为土壤微生物生态学特征的关键指标之一,广泛应用于评价土壤中微生物的群落状态和土壤的肥力特征。其中Biolog 分析法是一种以微孔板碳源利用为基础的定量分析方法,通过揭示不同土壤微生物群落对碳源利用的差异性,来反映群落功能多样性。开展盐碱区植物根际土壤微生物的群落功能多样性,对于盐碱土壤的植被恢复和生态重建具有重要意义。本研究以宁夏银北盐碱地中的6种耐盐植物根际土壤为研究对象,通过比较分析其土壤性质、相关酶活性和土壤微生物群落功能多样性特征,科学评价不同植物对盐碱土壤的改良效果,以期为加速该区盐碱地的植物修复和生态重建奠定基础。
1 材料与方法
1.1 研究区概况
研究区位于银川北部盐碱区平罗县西大滩农场(38°50′23.8″ N,106°23′54.1″ E),该地区常年干旱少雨,蒸发量大,富水性差,主要土壤为盐碱土,气候为中温干旱气候,植被类型以耐盐碱植物为主,主要有苜蓿()、枸杞()、柳枝稷()、芨芨草()、苦豆子()、柽柳()等。
1.2 样品采集与分析
于2017年6月采集6种植物根际土壤,其中苜蓿(MX)、枸杞(GQ)、柳枝稷(LZJ)采集的是人工种植4年的植被下土壤,芨芨草(JJC)、苦豆子(KDZ)、柽柳(CL)采集的为野生植被下土壤,同时以裸地土壤为对照(CK)。
用五点取样法采集植物根际土壤。去除土壤表层杂草和凋落物后在植株的根部一侧小心挖掘,待该侧植株根系露出后,用毛刷刷取黏附在根表面的土壤,或用剪刀直接剪取带有浮土的须根刷取根表土壤。各样点土样混匀,封入灭菌的离心管,置于冰盒带回实验室。部分新鲜土样用于土壤微生物群落功能多样性测定; 剩余部分风干磨细过0.25 mm筛用于土壤理化性质及酶活性测定。
用梅特勒-托利多pH计测定土壤pH(土水比1︰2.5); 用DDS-307型电导率仪测定土壤的电导率以反映土壤全盐含量; 用重铬酸钾(K2Cr2O7)氧化法测定土壤有机质含量; 采用凯氏定氮法、钼锑抗比色法和氢氧化钠碱熔—火焰分光光度法测定土壤全氮、全磷和全钾含量; 采用碱解扩散法、NaHCO3浸提法和醋酸铵浸提—火焰光度法测定土壤速效氮、有效磷和速效钾含量。采用苯酚钠—次氯酸钠比色法、磷酸苯二钠比色法、3,5-二硝基水杨酸比色法测定土壤脲酶、碱性磷酸酶和蔗糖酶活性[6]。
1.3 土壤微生物群落功能多样性测定
土壤微生物功能多样性用Biolog 方法进行测定[7-8]:称取5.0 g土壤样品加入装有45 mL无菌生理盐水的三角瓶中,150 r·min–1振荡30 min,冰浴2 min后静置15 min,获得土壤样品表面和内部的微生物悬浮液。将土壤悬液梯度稀释为10–3g·mL–1,在超净工作台中用移液枪将制备好的土壤悬液接种至Biolog 微平板(美国Biolog 公司)的各孔中,每孔150 μL,盖好盖子置于28℃培养箱中避光培养7 d,每隔24 h用酶标仪读取在590 nm波长的数值。
1.4 数据分析
平均颜色变化率(average well color development,AWCD)可以评判微生物群落的整体活性,即对碳源利用的总能力:

式中,为各反应孔在590 nm的吸光度值,为对照孔的吸光度值,为Biolog 微孔板反应孔数,为31,–小于零的孔,计算中记为零,即C–≥0。
采用培养168 h的数据计算微生物群落的多样性指数。香农指数用于评估丰富度:

式中,P为第孔的相对吸光值与整个平板相对吸光值总和的比率。
辛普森指数是用于评估常见种优势度的指数:

式中,P为第孔的相对吸光值与整个平板相对吸光值总和的比率。
麦金塔指数用于评估群落均一度:

式中,n为第孔的相对吸光值。
采用Excel 和SPSS 19.0 软件进行数据处理、方差分析和主成分分析(PCA)。
2 结 果
2.1 不同植物根际土壤理化性质和酶活性
由表1可知,不同植物种类对土壤理化性质的影响有显著的根际效应。相较于裸地土壤而言,6种植物根际土壤的电导率显著降低,除柳枝稷根际外,其余土壤pH均有所降低,表明植物的生长能够有效降低土壤的盐渍化程度。根际土壤的全氮、全磷、全钾和速效氮含量大多显著高于裸地土壤,而有效磷含量则显著较低,速效钾含量在各根际土壤中由高到低依次为芨芨草、柳枝稷、裸地、苦豆子、枸杞、柽柳和苜蓿。
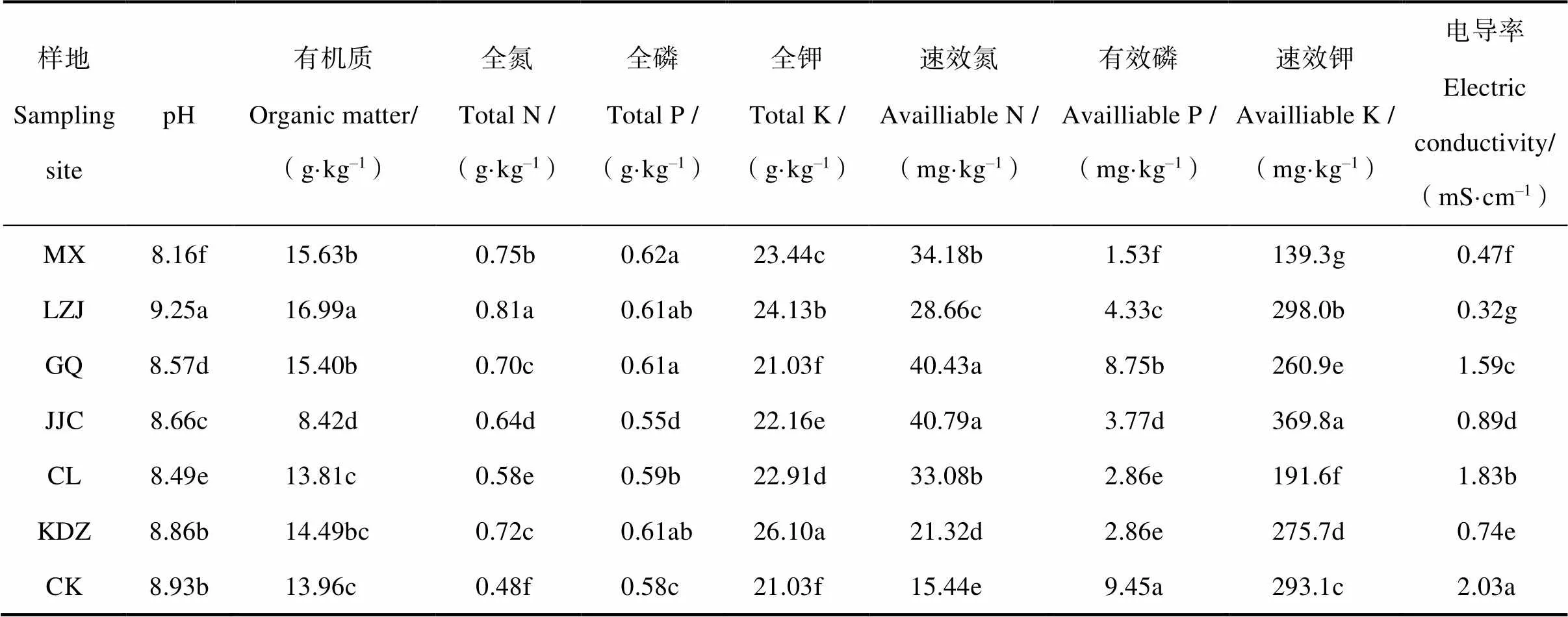
表1 不同耐盐植物根际土壤理化性质
注:同一列数据不同字母表示处理之间差异达5%显著水平; MX:苜蓿,LZJ:柳枝稷,GQ:枸杞,KDZ:苦豆子,JJC:芨芨草,CL:柽柳,CK:裸地,下同。Note:Different letters in the same row mean significant difference at 5% level; MX:LZJ:GQ:KDZ:JJC:CL:CK:bare soil. The same below.
由表2可以看出,与裸地相比,6种植物能显著提高盐碱地土壤酶活性,其根际土壤蔗糖酶活性由高到低为:枸杞、苜蓿、柳枝稷、芨芨草、柽柳、苦豆子和裸地; 脲酶活性依次为:苜蓿、柳枝稷、枸杞、苦豆子、柽柳、芨芨草和裸地; 碱性磷酸酶酶活性依次为:柳枝稷、苜蓿、苦豆子、枸杞、芨芨草、裸地和柽柳。总体而言,3种土壤酶活性表现出共同的特征,即人工种植的苜蓿、枸杞和柳枝稷根际土壤酶活性高于野生的苦豆子、柽柳和芨芨草,裸地土壤最低,说明人工种植3种耐盐植物提高了土壤肥力,有效促进了盐渍化土壤的改良。

表2 不同耐盐植物根际土壤酶活性
2.2 土壤微生物群落总碳源利用的动力特征
土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映土壤中微生物的生态特征[9]。利用不同植物根际土壤AWCD的3次重复平均值,绘制AWCD随时间动态变化曲线(图1)。土壤微生物利用碳源的总体变化趋势:随着培养时间的延长,其利用碳源的量也随之增加,不同植物根际土壤平均颜色变化率存在较大差异。在48 h之前,AWCD为0.008~0.141,说明土壤微生物在刚开始阶段对碳源利用率不高。48 h以后,不同根际土壤的AWCD出现变化,苜蓿根际土壤的AWCD增速明显,表明其土壤微生物利用碳源的能力加强,生物活性增加。168 h之前,苜蓿和芨芨草根际土壤的AWCD较高,其他4种植物根际土壤的AWCD非常接近,说明此时苜蓿和芨芨草对碳源的利用率远远高于其他植物和裸地。168 h之后,6种植物根际土壤的AWCD均高于裸地土壤,并逐渐趋于平缓。对168 h时AWCD值的显著性分析表明(表3),6种根际土壤与裸地之间差异显著(<0.05),苜蓿和芨芨根际土壤的AWCD显著高于其他植物,说明二者根际微生物对碳源消耗量最多,微生物活性最高,其次为柽柳和柳枝稷,与苦豆子和枸杞之间均无显著差异,表明其根际土壤微生物对碳源的利用程度相当,微生物活性较相似。

图1 不同植物根际土壤微生物群落 AWCD 随时间的变化
2.3 土壤微生物群落多样性指数
碳源代谢的多样性指数分析可以准确地反映微生物群落功能多样性的变化,多样性指数值越大表明土壤微生物群落功能多样性越高,反之亦然。香农指数()、辛普森指数()和麦金塔指数()是表征群落多样性的常用指数,是研究群落物种数及其个体数和分布均匀程度的综合指标。本实验采用Biolog 微平板培养168 h的数据进行微生物代谢多样性分析(表3)。结果表明不同植物根际土壤微生物群落多样性存在差异。香农指数、辛普森指数和麦金塔指数均以苜蓿根际土壤最高,芨芨草次之,二者较其他土壤差异显著(<0.05)。香农指数在各植物根际土壤的大小顺序是苜蓿、芨芨草、枸杞、裸地、柳枝稷、柽柳和苦豆子;辛普森指数为苜蓿、芨芨草、枸杞、柳枝稷、柽柳、裸地和苦豆子;麦金塔指数为苜蓿、芨芨草、柽柳、苦豆子、柳枝稷、枸杞和裸地。土壤微生物群落功能多样性在一定程度上受到植被类型的影响,总体上看苜蓿和芨芨草根际土壤微生物群落种类最多且较均匀,优势菌生长旺盛,碳源利用程度较高。苦豆子根际土壤微生物种类少且分布不均匀。
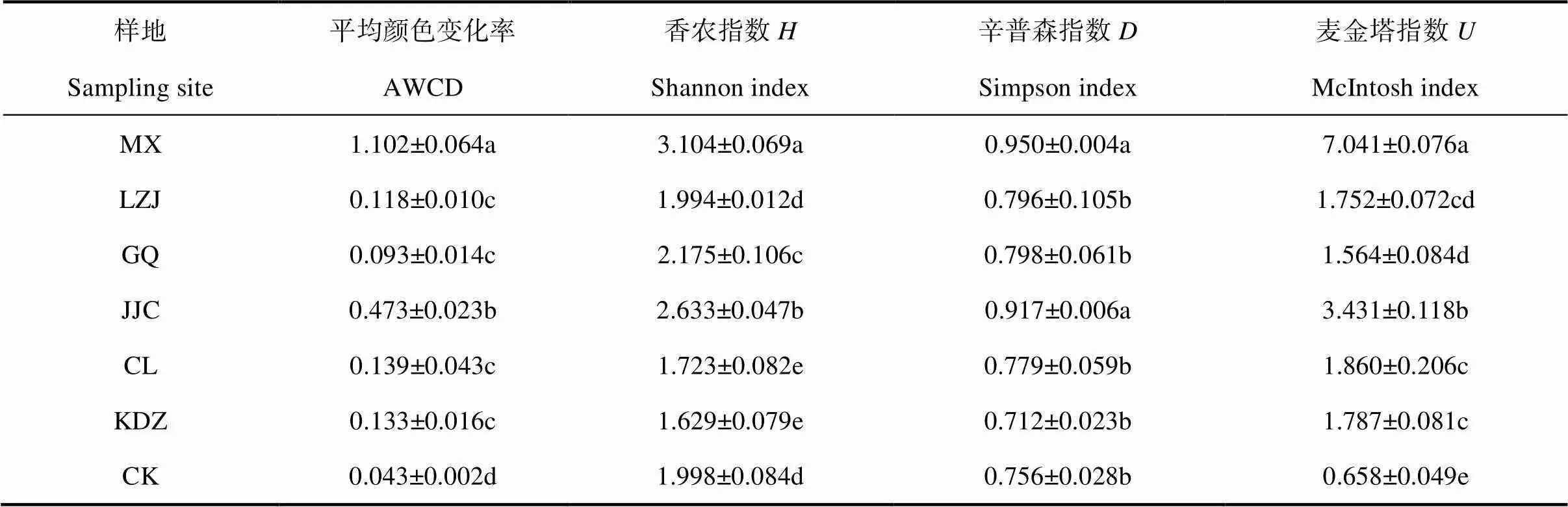
表3 不同植物根际土壤微生物群落多样性指数
2.4 土壤微生物群落利用碳源的类型
本研究中所用的31种碳源按化学基团的性质可以分为6类,分别是碳水化合物类、氨基酸类、羧酸类、胺类、酚酸类和聚合物类。随着培养时间的延长,微生物对6类碳源的利用率也在逐渐增加。选取培养168 h时的碳源利用率进行分析,不同植物根际微生物对6类碳源利用能力的大小存在差异(图2)。苜蓿根际微生物对6类碳源的利用率显著高于其他土壤,芨芨草对胺类和酚酸类的利用很小,但对另外4类碳源的利用率显著高于柳枝稷、柽柳、苦豆子和枸杞。总体而言,碳水化合物类是银北盐碱土壤中微生物的主要碳源,其次为羧酸类和氨基酸类,胺类的利用率最小。
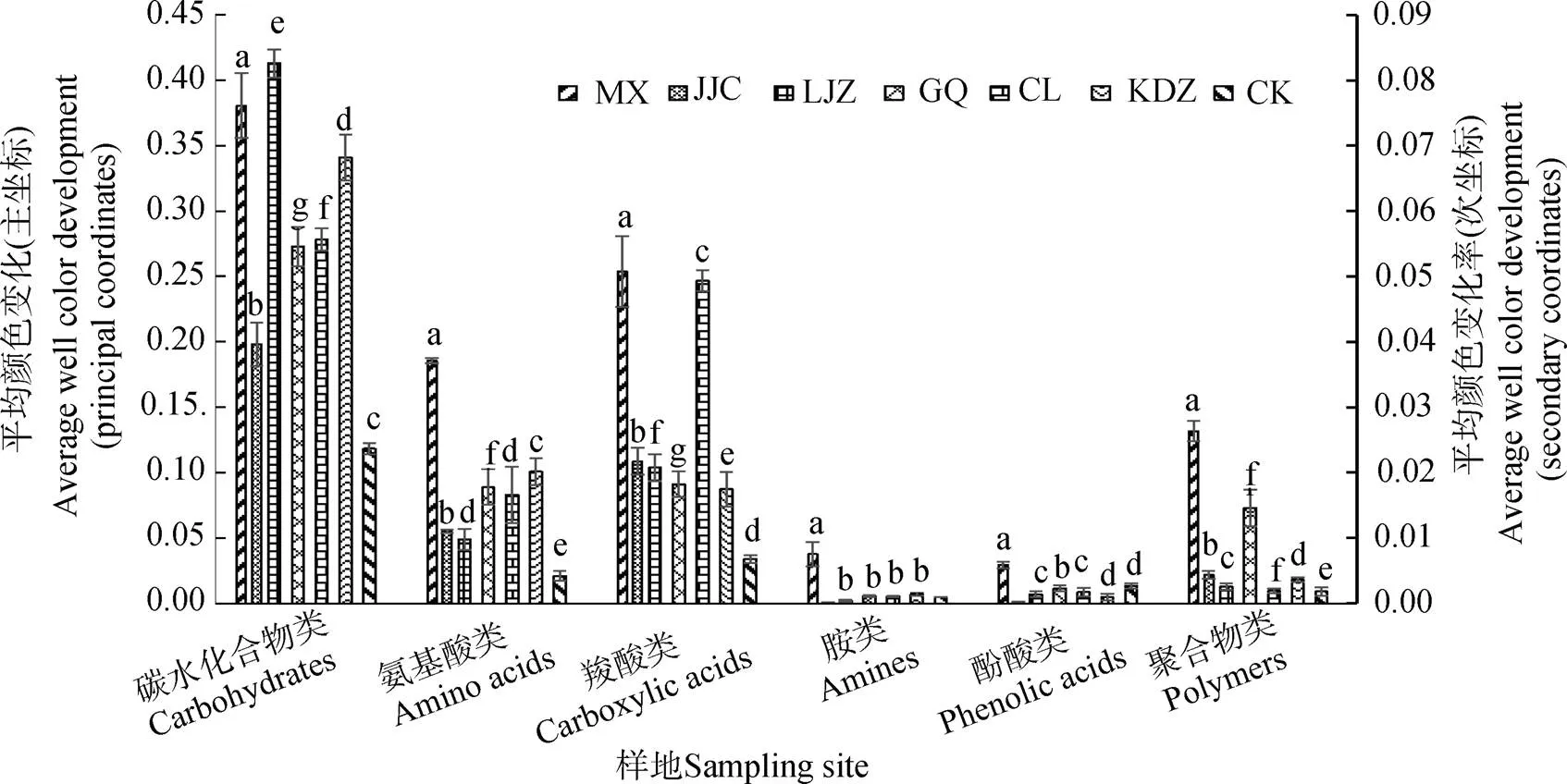
注:主坐标表示苜蓿(MX)和芨芨草(JJC)土样的AWCD值,次坐标表示柳枝稷(LZJ)、枸杞(GQ)、柽柳(CL)、苦豆子(KDZ)和裸地(CK)土样的AWCD值。Note:The principal coordinates represent average well color development of the soils in the rhizosphere of M.sativa (MX) and A. splendens (JJC); the secondaryaverage well color development of the soils in the rhizosphere soil of P. virgatum (LZJ),L. barbarum (GQ),T. chinensis (CL),S. alopecuroides (KDZ) andin bare soil (CK).
2.5 土壤微生物群落代谢功能主成分
利用培养168 h的AWCD值,对不同植物根际土壤微生物利用单一碳源特性进行主成分分析(Principal component analysis,PCA),同时提取特征值大于1的主成分的特征根及方差贡献率,揭示不同根际土壤微生物群落对碳源利用模式的差别。本研究共提取出4个主成分,累计贡献率达95.38%。其中第1主成分(PC1)的特征根为23.01,方差贡献率为74.23%; 第2主成分(PC2)的特征根为3.41,方差贡献率为11%; 其余2个主成分贡献率小于10%。从中提取可以聚集单一碳源变量的数据变异(累积方差贡献率)为85.23%的前2个主成分PC1,PC2来分析微生物群落功能多样性。
由图3可见,在PC1轴上,苜蓿和芨芨草分布在正方向,苦豆子、柽柳、柳枝稷、枸杞和裸地土分布在负方向; 在PC2轴上,苜蓿、枸杞、苦豆子分布在正方向,柳枝稷、芨芨草和裸地土分布在负方向,柽柳在坐标轴左右。表明苜蓿、芨芨草、枸杞和柳枝稷的根际土壤微生物群落有各自独特的碳源利用模式,苦豆子和柽柳与裸地土分布较近,说明这两种植物根际土壤与裸地土壤微生物群落具有相似的碳源利用特征。初始因子载荷反映了主成分与碳源利用的相关程度,因子载荷绝对值越接近于1,表示该碳源对主成分的影响越大。如表4所示,与第一主成分相关性较高(因子载荷>0.5)的碳源有27个,主要包括碳水化合物类(9个)、氨基酸类(6个)、羧酸类(6个)、酚酸类(2个)、胺类(1个)、聚合物类(3个),可见影响PC1的主要为碳水化合物类、氨基酸类和羧酸类; 与第二主成分相关性较高的碳源有6个,主要包括碳水化合物类(1个)、羧酸类(2个)、酚酸类(1个)、胺类(1个)、聚合物类(1个)。因此可以认为对于本实验土壤样品,对土壤微生物群落功能多样性差异贡献较大的碳源是碳水化合物类和羧酸类。

图3 不同耐盐植物根际土壤微生物群落代谢功能主成分
3 讨 论
根际微生物在土壤形成和肥力积累过程中起着极为重要的作用,是生态环境变化的敏感指标[10-11]。根际微生物的分布与活动,一方面反映环境、植物对微生物的分布习性、群落组成、种群演替及其功能的影响,另一方面说明对植物生长、土壤肥力及物质循环和能量转化现状和趋势的相关性[12-13]。已有的研究表明,不同的植被类型通过根系分泌物的种类、凋落物的数量和组成影响土壤理化性质和酶活性[14-15]。宁夏银北盐渍化土壤中6种植物根际土壤的电导率和pH与裸地相比多有显著下降,全氮、全磷、全钾和速效氮含量则明显增加,3种土壤酶活性也显著高于裸地,说明耐盐碱植物能够有效降低土壤的盐渍化程度,提高根际土壤肥力,反映了土壤肥力状况与植物营养的密切关系。而6种根际土壤中速效磷的含量显著低于裸地,速效钾含量在盐碱裸地中也高于苦豆子、枸杞、柽柳和苜蓿根际。微生物群落功能特征与土壤理化性质紧密相关[16]。植物与土壤微生物之间通过凋落物和根系分泌物建立起密切的联系,植物种类的不同会直接影响根际微生物的功能类群,这些功能类群又会通过解磷、固氮、分泌代谢产物等促进土壤中有机物的分解和营养元素的矿化。根际土壤中解磷解钾菌通过产生酸性物质增加土壤中可溶性磷钾的含量,这些可溶性磷钾又被植物吸收利用,从而使6种根际土壤有效磷钾的含量低于裸地土壤。

表4 PC1、PC2的碳源载荷因子
土壤微生物群落多样性反映了群落总体的动态变化,它可以通过检测微生物碳源利用程度来反映。从不同植物根际土壤微生物碳源利用的AWCD的变化情况,可以看出6种耐盐植物根际土壤微生物群落对碳源底物的利用能力明显强于盐碱裸地。苜蓿根际微生物对碳源利用能力最强,芨芨草次之,其他4种植物根际土壤碳源利用能力相近。碳源代谢的多样性指数也表明苜蓿和芨芨草根际功能微生物群落多样,碳源利用程度较高。在六类碳源中,碳水化合物类和羧酸类是6种植物根际土壤微生物的主要碳源,其次为氨基酸类、酚酸类和聚合物类,胺类碳源的利用率最小,说明碳水化合物类和羧酸类是6种耐盐植物土壤微生物群落变化的敏感碳源。这与吴则焰等[17]的研究结果一致。
微生物的群落组成存在生境异质性,土壤微环境和植被状况是影响土壤微生物群落种类和分布的关键因素。滕应等[18]认为植物向根际土壤分泌的碳水化合物类越多,根际微生物对碳底物利用的能力越强。杜滢鑫等[19]的结果表明,同一科的植物根际微生物对碳源的代谢特征比较相似,不同科植物根际微生物对碳源的代谢特征存在着一定的差异。本研究并未得出相同的结果,如苜蓿和苦豆子同为豆科植物,芨芨草和柳枝稷同为禾本科植物,无论从碳源利用的多样性水平上,还是利用程度上,同科植物间都存在显著差异。这是因为植物生长过程中会向根部土壤释放大量的碳源,碳源在不同根系土壤中的有效性不一样,同时植被凋落物的分解又增加了土壤有机质及养分的含量,加之不同植物根系分泌物的种类和性质不同,这些差异打破了原有根际微环境中的生态平衡,资源的异质性影响了根际微生物的群落结构组成[20-21]。不同的微生物群落由于种群的竞争机制,或者对各类底物的适应性不同,表现出对不同碳源的利用强度存在一定的差异[22]。因此,尽管在立地条件基本一致的情况下,不同植物根际土壤微生物碳源利用的程度和种类也会有差异。此外,土壤微生物群落多样性也与土壤盐碱度有关,研究结果显示苜蓿和芨芨草根际土壤的pH和电导率明显低于苦豆子和柳枝稷,微生物活性显著增高,表明较高盐碱环境对土壤微生物的生长有抑制作用,这与李凤霞等[23]研究结果一致。
土壤微生物活性、数量以及丰富的多样性代表着微生物群落的稳定性,对植物的生长发育和群落结构的演替都具有重要作用。土壤微生物和地上植被是相辅相成、不可分割的整体。它们互相影响、互相制约,为生态系统的多样性和稳定性提供有利条件[24]。一般在盐渍化土壤中,微生物活性增高说明土壤的盐碱性状况得到了改善,微生物类群及数量愈趋平衡,土壤生态系统更为持续稳定[25]。研究表明,不同耐盐植物根际土壤微生物活性显著高于空裸地,说明耐盐植物能够改善土壤环境,抑制土壤返盐,改善土壤肥力,是干旱荒漠区进行生物改良盐碱土的宝贵植物资源。
4 结 论
宁夏银北地区土壤盐渍化严重,不同耐盐植物根际土壤不论是土壤理化性质、酶活性,还是反映土壤微生物代谢功能多样性的平均颜色变化率、功能多样性指数和碳源利用程度上,多表现为植物根际土壤优于盐碱裸地,且6种耐盐植物根际土壤微生物群落多样性存在差异,其中苜蓿和芨芨草能显著提高土壤微生物群落功能多样性,对盐碱地根际微环境的养分循环有积极意义。
[1] Raaijmakers J M,Mazzola M. Soil immune responses. Science,2016,352:1392—1393.
[2] Hayat R,Ali S,Amara U,et al. Soil beneficial bacteria and their role in plant growth promotion:A review. Annals of MicroBioloy,2010,60(4):579—598.
[3] Zhou X G,Gao D M,Liu J,et al. Changes in rhizosphere soil microbial communities in a continuously monocropped cucumber(L.)system. European Journal of Soil Biology,2014,60:1—8.
[4] Xiang Z Y,Zhang L,Zhang Q F,et al. Soil nutrients and microbial functional diversity of different stand types in Qinghai. Scientia Silvae Sinicae,2014,50(4):22—31. [向泽宇,张莉,张全发,等. 青海不同林分类型土壤养分与微生物功能多样性. 林业科学,2014,50(4):22—31.]
[5] Li M,Sun Z J,Chen W M,et al. Summary of microbial community and the effects of the biological amelioration on saline soil in Ningxia. Journal of Anhui Agricultural Sciences,2014,42(4):1042—1046. [李明,孙兆军,陈卫民,等. 宁夏地区盐渍化土壤微生物群落的研究现状及生物改良对其的影响. 安徽农业科学,2014,42(4):1042—1046.]
[6] Wang X J,Zhou Y M,Wang X X,et al. Responses of soil enzymes in activity and soil microbes in biomass to warming in tundra ecosystem on Changbai Mountains. Acta Pedologica Sinica,2014,51(1):166—175. [王学娟,周玉梅,王秀秀,等. 长白山苔原生态系统土壤酶活性及微生物生物量对增温的响应. 土壤学报,2014,51(1):166—175.]
[7] Zhao Z T,Zheng J,Wu Z Y,et al. Features of mangrove soil microbial community withinvaded. Journal of Forest and Environment,2017,37(2):169—173. [赵紫檀,郑洁,吴则焰,等. 互花米草入侵下红树林土壤微生物群落特征. 森林与环境学报2017,37(2):169—173.]
[8] Zhang H,Lü J L,Cao Y F,et al. Decomposition characteristics of different plant straws and soil microbial functional diversity. Acta Pedologica Sinica,2014,51(4):743—752. [张红,吕家珑,曹莹菲,等. 不同植物秸秆腐解特性与土壤微生物功能多样性研究. 土壤学报,2014,51(4):743—752.]
[9] Cao Y C,Tan X P,He W X,et al. The metabolism characteristics of microbial community in different forest soil in Qinling Mountains Area. Acta Ecologica Sinica,2016,36(10):2978—2986. [曹永昌,谭向平,和文祥,等. 秦岭地区不同林分土壤微生物群落代谢特征. 生态学报,2016,36(10):2978—2986.]
[10] Yi H Y,Gong Y B,Chen L W,et al. Soil nutrient status and microbiological properties in the mountain forests/arid valley ecotone in the upper reaches of Minjiang River after converting farmland to forest. Research of Soil and Water Conservation,2010,17(2):130—135. [易海燕,宫渊波,陈林武,等. 岷江上游山地森林/干旱河谷交错带退耕还林后土壤养分变化和微生物分布特征. 水土保持研究,2010,17(2):130—135.]
[11] Li X Z,Rui J P,Mao Y J,et al. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar. Soil Biology & Biochemistry,2014,68:392—401.
[12] Pii Y,Penn A,Terzano R,et al. Plant-microorganism-soil interactions influence the Fe availability in the rhizosphere of cucumber plants. Plant Physiology and Biochemistry,2015,87:45—52.
[13] Velasco A G V,Kowalchuk G A,Mañero F J G,et al. Increased microbial activity and nitrogen mineralization coupled to changes in microbial community structure in the rhizosphere of Bt corn. Applied Soil Ecology,2013,68:46—56.
[14] Luo Q,Huang B L,Tang Z X,et al. Carbon source utilization of microbes in saline soil of three vegetation types in Xinjiang. Chinese Journal of Applied & Environmental Biology,2013,19(1):96—104. [罗倩,黄宝灵,唐治喜,等. 新疆盐渍土3种植被类型土壤微生物碳源利用. 应用与环境生物学报,2013,19(1):96—104.]
[15] Li J,Yu X Y,Tang M. Effects of different plants on soil microbial biomass and enzyme activities in Zhifanggou Watershed of Loess Plateau. Acta Botanica Boreali-Occidentalia Sinica,2013,33(2):387—393. [李静,蔚晓燕,唐明. 黄土高原纸坊沟流域不同植物对土壤微生物生物量和土壤酶活性的影响. 西北植物学报,2013,33(2):387—393.]
[16] Hoogmoed M,Cunningham S C,Baker P,et al. N-fixing trees in restoration plantings:Effects on nitrogen supply and soil microbial communities. Soil Biology & Biochemistry,2014,77(7):203—212.
[17] Wu Z Y,Lin W X,Chen Z F,et al. Characteristics of soil microbial community under different vegetation types in Wuyishan National Nature Reserve,East China. Chinese Journal of Applied Ecology,2013,24(8):2301—2309. [吴则焰,林文雄,陈志芳,等. 武夷山国家自然保护区不同植被类型土壤微生物群落特征. 应用生态学报,2013,24(8):2301—2309.]
[18] Teng Y,Huang C Y,Long J,et al. Functional diversity of microbial community in herbage rhizosphere of reclaimed red soils. China Environmental Science,2003,23(3):72—76. [滕应,黄昌勇,龙健,等. 复垦红壤中牧草根际微生物群落功能多样性. 中国环境科学,2003,23(3):72—76.]
[19] Du Y X,Xie B M,Cai H S,et al. Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing Saline-alkali soil region. Acta Ecologica Sinica,2016,36(3):740—747. [杜滢鑫,谢宝明,蔡洪生,等. 大庆盐碱地九种植物根际土壤微生物群落结构及功能多样性. 生态学报,2016,36(3):740—747.]
[20] Caracciolo A B,Bustamante M A,Nogues I,et al. Changes in microbial community structure and functioning of a semiarid soil due to the use of anaerobic digestate derived composts and rosemary plants. Geoderma,2015,245/246:89—97.
[21] Sulkava P,Huhta V. Habitat patchiness affects decomposition and faunal diversity:Amicro cosm experiment on forest floor. Oecologia,1998,116(3):390—396.
[22] Grayston S J,Wang S Q,Campbell C D,et al. Selective influence of plant species on microbial diversity in the rhizosphere. Soil Biology & Biochemistry,1998,30(3):369—378.
[23] Li F X,Wang X Q,Guo Y Z,et al. Microbial flora and diversity in different types of saline-alkali soil in Ningxia. Journal of Soil and Water Conservation,2011,25(5):107—111. [李凤霞,王学琴,郭永忠,等. 宁夏不同类型盐渍化土壤微生物区系及多样性. 水土保持学报,2011,25(5):107—111.]
[24] Liu Z F,Fu B J,Zheng X X,et al. Plant biomass,soil water content and soil N:P ratio regulating soil microbial functional diversity in a temperate steppe:A regional scale study. Soil Biology & Biochemistry,2010,42:445—450.
[25] Cao G D,Chen J H,Wang S M,et al. Study on soil microbial properties under different halophytes types. Xinjiang Agricultural Sciences,2012,49(3):523—530. [曹国栋,陈接华,王邵明,等. 不同盐生植被类型下土壤微生物特性研究. 新疆农业科学,2012,49(3):523—530.]
Enzyme Activities and Microbial Communities in Rhizospheres of Plants in Salinized Soil in North Yinchuan, China
TIAN Pingya, SHEN Cong, ZHAO Hui, ZHANG Ying, DAI Jinxia†
(School of Life Science, Ningxia University, Key Lab of Ministry of Education for Protection and Utilization of Special Biological Resources in the Western, Yinchuan 750021, China)
It is of great significance to vegetation restoration in and eco-remediation of saline-alkali soils to unfold researches on microbial community diversity in the rhizospheres of salt-tolerant plants in saline-alkali soils.In this research, the biolog ecoplate technology was used to study soil enzyme activities and metabolic function diversity of the microbial communities in the rhizospheres of six salt-tolerant species of plants species in saline-alkali soils North Yinchuan.Results showed physical and chemical properties and enzyme activity of the rhizosphere varied somewhat with species of the plant. Compared with bare soil, rhizosphere soils of the salt-tolerant plants were significantly higher in soil enzyme activity, especially the rhizosphere soil ofin the activity of three kinds of soil enzymes. In general, the average well color development (AWCD) of the rhizosphere soils increased with the processing of culture and in terms of AWCD, the five species of plants followed an order of(MX),(JJC),(CL),(LZJ),(KDZ),(GQ), all being much higher than that in the bare soil (CK) (<0.05). The soil microbial community in the rhizosphere soil ofwas the highest in Simpson index, Shannon index and McIntosh index, and followed by that of, and the two differed significantly from that of the others (<0.05). Soil microbial community in the rhizosphere soil varied with species of the plant in ability to utilize carbon resources. The one in the rhizosphere soil ofwas significantly higher than that of the others in carbon utilization ability (<0.05). Carbohydrates were the main carbon source for soil microbes in rhizosphere soil, and followed by amino acids and carboxylic acids, and amines the last. Principal component analysis demonstrates that the main carbon sources that differentiated between PC1 and PC2 were carbohydrates and carboxylic acids.All the findings demonstrate that all the indices are higher in the rhizosphere soil than in the bulk soil or soil of the bare saline-alkali field, particularly in theandfields, which demonstrates that the plants significantly improve functional diversity of the soil microbial community, thus contributing positively to nutrient recycling in the rhizosphere micro-environment in saline-alkali lands.
Saline-alkali soil; Rhizosphere microbial; soil enzyme activities; Community diversity; Biolog method
S154.36
A
10.11766/trxb201807050359
田平雅,沈聪,赵辉,张莹,代金霞. 银北盐碱区植物根际土壤酶活性及微生物群落特征[J].土壤学报,2020,57(1):217–226.
TIAN Pingya,SHEN Cong,ZHAO Hui,ZHANG Ying,DAI Jinxia. Enzyme Activities and Microbial Communities in Rhizospheres of Plants in Salinized Soil in North Yinchuan,China[J]. Acta Pedologica Sinica,2020,57(1):217–226.
* 国家自然科学基金项目(31760027)、宁夏自然科学基金项目(NZ16001)、国家重点研发计划项目(2016YFC0501307)和宁夏高校项目(NGY2016009)资助Supported by the National Natural Science Foundation of China(No. 31760027), the Natural Science Foundation of Ningxia(No. NZ16001),the National Key R&D Program of China(No. 2016YFC0501307)and the Project for Colleges and Universities of Ningxia(No. NGY2016009)
,E-mail:daijx05@163.com
田平雅(1993—),女,宁夏中卫人,硕士研究生,主要从事微生物资源与利用研究。E-mail:564967039@qq.com
2018–07–05;
2018–10–29;
2018–11–28
(责任编辑:卢 萍)

