胺碘酮对心房肌细胞L型钙通道电流变化研究
王增夏,解金红,王 贺,赵亚楠,曹英杰,关怀敏
心房颤动(房颤)是临床上最常见的心律失常之一,房颤可导致心房内血栓及脑卒中等多种并发症,严重影响生活质量,并且会给患者带来沉重的经济负担[1]。房颤发病机制尚不完全清楚,电重构、氧化应激在房颤的发病机制中发挥着重要作用[2],L型钙通道(L-type calcium channel, ICa-L)[3]是心脏电活动中的重要离子通道之一,是构成动作电位二期平台期的重要离子流。胺碘酮是经典的Ⅲ类抗心律失常药物,对多种离子通道,如钠通道、钾通道、钙通道均有阻滞作用。该研究在于明确H2O2介导的氧化应激及胺碘酮对大鼠心房肌细胞L型钙通道电流(L-type calcium channel current,ICaL)的影响,为阐明房颤机制提供细胞分子水平的依据。
1 材料与方法
1.1 动物与溶液、试剂动物选取清洁级成年雄性SD大鼠由郑州大学实验动物中心提供,体质量280~320 g,动物实验方法通过我国动物伦理学的规定。胺碘酮、10 mol/L H2O2、TEA-Cl、二甲基亚砜(DMSO)购于美国Sigma公司;胶原酶Ⅱ购于美国Gibco公司;NaH2PO4、HEPES、L-谷氨酸(L-Glutamic Acid)、牛磺酸(Taurine)、EGTA、Mg-ATP、CsCl购于北京索莱宝科技有限公司;CaCl2购于上海阿拉丁生化科技股份有限公司;其余试剂均为国产分析纯。
无钙台式液成分:NaCl 136 mmol/L、KCl 5.4 mmol/L、NaH2PO4·2H2O 0.33 mmol/L、MgCl2·6H2O 1 mmol/L、Glucose 10 mmol/L、HEPES 10 mmol/L,用NaOH将pH值调至7.4。
KB液成分:KOH 80 mmol/L 、KCl 30 mmol/L、L-Glutamic Acid 50 mmol/L、MgCl2·6H2O 1 mmol/L、HEPES 10 mmol/L、Glucose 10 mmol/L、KH2PO420 mmol/L、Taurine 20 mmol/L、EGTA 0.5 mmol/L,用KOH将pH值调至7.4。
酶液:20 mgⅡ型胶原酶、10 μl 0.1 mol/L CaCl2加入到无钙台式液中,定容至50 ml。
记录ICaL的细胞内液成分:CsCl 130 mmol/L、MgCl2·6H2O 2 mmol/L、HEPES 10 mmol/L、EGTA 15 mmol/L、Mg-ATP 3 mmol/L、Glucose 10 mmol/L,用CsOH将pH值调至7.2。
记录ICaL的细胞外液成分:TEA-Cl 136 mmol/L、CaCl22 mmol/L、MgCl2·6H2O 1 mmol/L、HEPES 10 mmol/L、Glucose 10 mmol/L,用CsOH将pH值调至7.4。
1.2 成年SD大鼠单个心房肌细胞的分离采用酶解法分离并制备单个心房肌细胞[4]。提前将无钙台式液、KB液、酶液100%充氧30 min。SD大鼠腹腔注射肝素(200 IU/ml)0.3 ml后,10%水合氯醛(0.30 mg/kg)腹腔注射麻醉。SD大鼠麻醉后,开胸,迅速取出心脏,置于冰无钙台式液的培养皿里,用无齿眼科镊夹住主动脉上缘,逆行插管至主动脉根部,使插管的下缘于肺动脉的起始部在同一水平面上。使用Langendorff恒流灌流装置[5],灌流速度5.4 ml/min,在恒温状态下(温度保持在37.5 ℃),首先用无钙台式液灌流2~3 min,待心脏内血液冲洗干净后,换用酶液灌流,待无钙台式液冲洗干净约2 min后,结扎上下腔静脉、肺静脉,继续酶液灌流9~10 min,用眼科镊轻轻牵拉心房肌,心房肌组织变得松软,轻轻牵拉没有阻力时,沿房室间沟将左右心房剪掉,放入KB液中,剪碎成1 mm×1 mm×1 mm的小组织块,用吸管轻轻吹打约3~5 min,可以看到组织块拉成丝状,分离出单个心房肌细胞,用200目的细胞筛网过滤此KB液,过滤后的细胞悬液用小烧杯定容至10 ml,为细胞复钙做准备。用含有对应CaCl2浓度的KB液,分次逐步加入到10 ml细胞悬液中,使其恢复至生理浓度,具体复钙方法如下:10 ml细胞悬液,第1次2 ml KB液+12 μl 0.1 mol/L CaCl2反复吹打混匀后缓慢加到细胞悬液中;每间隔5 min,用同样方法分别加入16、35、79、94 μl 0.1 mol/L CaCl2于2 ml KB液中,混匀后加入细胞悬液中。复钙结束后在细胞培养板中用心肌细胞培养液铺板,置于37 ℃、5%CO2孵箱中孵育,以备后续膜片钳实验使用。
1.3 药物配制胺碘酮单体用DMSO溶解(DMSO的终浓度不超过0.1%),加超纯水制备成母液,敷药时稀释成5 μmol/L的工作液。10 μmol/L H2O2敷药时稀释成100 μmol/L工作液[6]。
1.4 心房肌细胞的处理和药物的使用细胞共分为3组:① 对照组:细胞不经过处理直接进行膜片钳实验,记录钙电流(n=15);② H2O2组:细胞经100 μmol/L的H2O2培养0.5 h后进行膜片钳实验并记录电流(n=15);③胺碘酮组:细胞预先经100 μmol/L H2O2培养0.5 h后加入5 μmol/L胺碘酮培养0.5 h进行膜片钳实验并记录电流(n=18)。
1.5 排除电流干扰为了确保记录到的钙电流是纯净钙电流,在电极内液和细胞外液里均不含有Na+,故排除了Na+电流干扰,并且在上述两种液体里分别加入CsCl、TEA-Cl故排除了K+电流干扰。心房肌细胞膜分布了两种钙通道,分别为ICa-L和T型钙通道,该实验将电压钳制在-40 mV,以致T型钙通道失活,综上,记录到的钙电流是ICaL。
1.6 膜片钳全细胞记录使用全细胞膜片钳技术[7],在电压钳制下记录ICaL。将HEKA EPC-10放大器(德国HEKA公司)与计算机相连接。电压输入信号和刺激信号的采集均有软件PatchMaster控制。玻璃电极(美国Sutter公司)经P-97微电极拉制仪(美国Sutter公司)拉制成电阻为2.0~5.0 MΩ的电极[8]。在显微镜下挑选外观完整规则,边界清晰,表面光滑无颗粒,立体感强,横纹清楚,不收缩的梭型细胞。将玻璃电极充灌好电极内液,在玻璃电极插入浴液前,给予轻微的正压,用三维操纵仪(MP-225,Sutter公司)调节玻璃电极的位置使其入液,入液后进行液接电位补偿,继续调节电极尖端的位置使其接触到细胞表面,轻压细胞,撤除正压,在电极尖端施加小的负压,形成高阻封接,待封接电阻达到2 GΩ以上,进行电极电容补偿,继续负压吸引使其破膜形成全细胞记录模式,并对全细胞膜电容进行补偿。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波,采样频率为10 kHz。
1.7 ICaL刺激参数ICa-L的I-V曲线:钳制电位-70 mV,给予250 ms,阶跃10 mV,-60 mV~+60 mV的系列刺激,用每个细胞的膜电容(Cm)求电流密度(pA/pF),用电流密度与相应测试电压作图,得I-V曲线。ICa-L失活曲线刺激程序:钳制电位-70 mV,给予1 000 ms,阶跃10 mV,-60 mV~+40 mV的系列脉冲,每一条件脉冲后再紧跟+10 mV、250 ms的测试脉冲。阶跃电压下相应电流标准化后用Boltzmann方程拟合出失活曲线。ICa-L失活后恢复曲线刺激程序:钳制电位-70 mV,给予+10 mV、250 ms的刺激,间隔8、12、18、26、39、58、87、130、195、293、439、658、986、1 479 ms后,再给予+10 mV、250 ms的刺激,记录相应电流除以完全恢复后的最大电流与相应的恢复时间作图得出恢复曲线,用单指数方程拟合[9]。见图1。
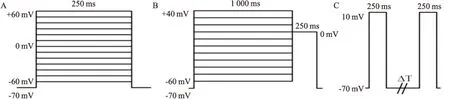
图1 ICa-L的刺激程序
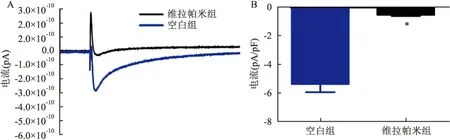
图2 SD大鼠心房肌细胞ICaL的验证
A:空白组和维拉帕米组(100 μmol/L)去极化到0 mV时的原始电流图;B:空白组和维拉帕米组电流密度直方图;与空白组比较:*P<0.05
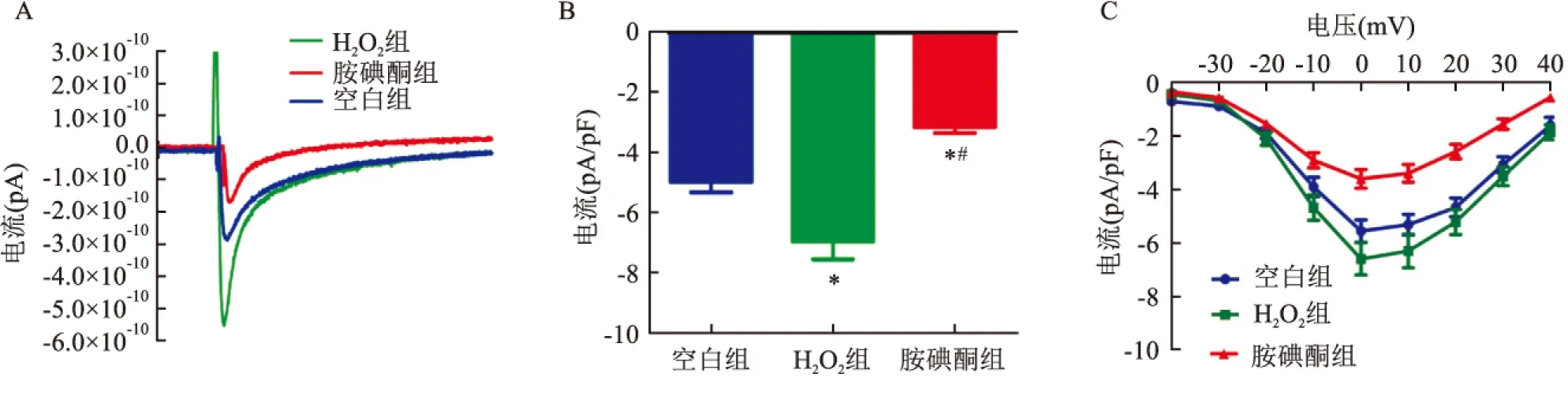
图3 各组原始电流图、直方图及I-V曲线图
1.8 统计学处理使用Igor、Origin软件进行数据处理,采用SPSS 21.0软件进行数据分析,实验数据以均数±标准误表示,组间比较采用单因素方差分析,Leven检验方差齐性,P<0.05时,组间比较采用Dunnett's T3法;反之采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 ICaL的验证SD大鼠心房肌细胞ICaL是通过稳态激活刺激程序刺激记录出来的,维拉帕米是ICaL的阻断剂,维拉帕米100 μmol/L几乎可以完全阻断该电流,从而确定此电流是ICaL。见图2。
2.2 各组大鼠心房肌细胞ICaL密度的比较单因素方差分析F=23.32,P<0.000 1,按α=0.05检验水准,可认为各组总体均数总的有差别;组间的多重比较结果如下:与空白组比较,H2O2组ICaL密度升高[(-4.99±0.35) pA/pFvs(-6.97±0.60) pA/pF,P<0.05],H2O2可以使ICaL增加;与H2O2组比较,胺碘酮组ICa-L密度降低[(-6.97±0.60) pA/pFvs(-3.16±0.20) pA/pF,P<0.05],胺碘酮使ICaL降低。见图3B。
2.3 各组大鼠心房肌细胞ICa-LI-V曲线变化的比较与空白组比较,H2O2组细胞在各电压下电流密度均增大,胺碘酮组细胞在各电压下电流密度均减小。说明胺碘酮对ICaL有抑制作用。见图3C。
2.4 各组大鼠心房肌细胞ICa-L稳态激活曲线变化的比较与空白组比较,H2O2组ICa-L稳态激活曲线左移,半激活电压V1/2从(-11.92±0.68) mV移动到(-14.48±0.65) mV,P<0.05;与H2O2组比较,胺碘酮组ICa-L稳态激活曲线向左移动,半激活电压V1/2从(-14.48±0.65) mV移动到(-16.74±0.70) mV,P<0.05。H2O2、胺碘酮均可以使ICa-L激活加快。见图4。

图4 各组ICa-L的稳态激活曲线图
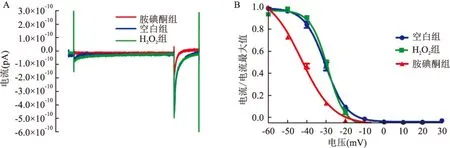
图5 各组ICa-L的稳态失活曲线图
A:空白组、H2O2组和胺碘酮组通道失活50%时条件脉冲电压下失活曲线的原始电流图;B:空白组、H2O2组和胺碘酮组失活曲线
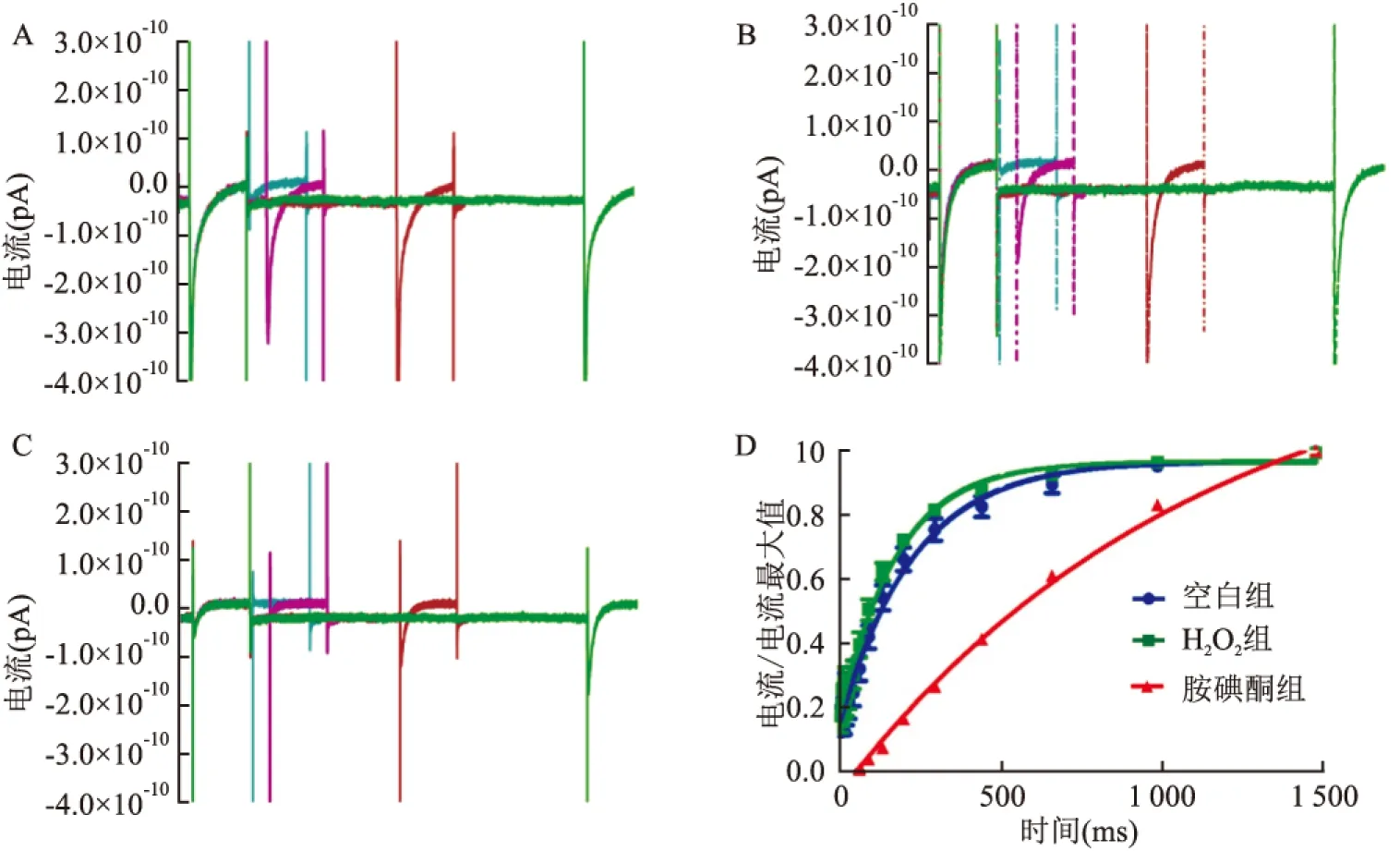
图6 各组恢复曲线原始图及ICa-L的失活后恢复曲线图
A:空白组恢复曲线的部分原始电流图;B:H2O2组恢复曲线的部分原始电流图;C:胺碘酮组恢复曲线的部分原始电流图;D:空白组、H2O2组和胺碘酮组失活后恢复曲线图
2.5 各组大鼠心房肌细胞ICa-L稳态失活曲线变化的比较与空白组比较,H2O2组ICa-L稳态失活曲线变化不明显,半失活电压V1/2从(-29.42±0.49) mV移动到(-29.12±0.76) mV,P>0.05,说明H2O2对ICa-L的失活影响不大;与H2O2组比较,胺碘酮组ICa-L稳态失活曲线明显向左移动,半失活电压V1/2从(-29.12±0.76) mV移动到(-42.19±0.65) mV,P<0.05,胺碘酮可以使ICaL失活加快。见图5。
2.6 各组大鼠心房肌细胞ICa-L失活后恢复曲线变化的比较与空白组比较,H2O2组失活后恢复曲线左移,ICa-L恢复时间常数Tau值从(215.0±19.76) ms减少至(164.9±11.51) ms,P>0.05,H2O2对ICa-L的恢复影响差异无统计学意义;与H2O2组比较,胺碘酮组恢复曲线明显右移,ICa-L恢复曲线的时间常数从(164.9±11.51) ms增加至(1 199±42.67) ms,P<0.05,胺碘酮使ICa-L的恢复时间延长,恢复变慢。见图6。
3 讨论
氧化应激在心血管疾病的病理生理过程中发挥了重要的作用[10],H2O2可能与缺血、炎症、心力衰竭的病理过程有关,炎症、缺血、心力衰竭与房颤的发生也有关系。氧化应激不仅导致心房重构,也会引起心房电生理的改变。通过用H2O2对心房肌细胞进行干预,建立氧化应激模型,采用临床上典型的Ⅲ类抗心律失常药物胺碘酮对建立的氧化应激模型的心房肌细胞进行干预,观察其对心房肌细胞电流的影响,从而进一步研究胺碘酮对心房肌细胞ICa-L活性的影响以及其抗心律失常的作用机制。全细胞膜片钳技术能直接观察细胞膜的离子通道电流,是研究抗心律失常药物作用靶点的重要手段。ICa-L是心肌细胞膜上钙离子内流的重要通道,其在心房电重构中发挥重要作用。本实验中,H2O2使ICaL变大,胺碘酮使ICaL变小,胺碘酮对通道的激活、失活、恢复动力学特性均有影响。胺碘酮可以影响钙通道电流从而逆转心房肌细胞的电重构[11],房颤患者口服胺碘酮后不仅可以有效阻止重构的发生,还可逆转已经形成的重构。因此,胺碘酮发挥抗房颤作用很可能是通过影响心房肌细胞电重构实现的。胺碘酮的临床价值受到副作用的限制。阻止重构发生在胺碘酮抗房颤特性中具有潜在的重要价值,这可能为开发通过预防房颤相关重构而对抗房颤的新型化合物提供一个有用的范例。

