桑沟湾浮游植物粒径结构及其与环境因子的关系*
李凤雪 蒋增杰 高亚平 杜美荣 王晓芹 李文豪 侯 兴 董世鹏 王军威 张义涛
桑沟湾浮游植物粒径结构及其与环境因子的关系*
李凤雪1,2蒋增杰2,3①高亚平2杜美荣2王晓芹2李文豪1,2侯 兴1,2董世鹏1,2王军威4张义涛4
(1. 上海海洋大学水产与生命学院 上海 201306;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青 岛 266071;3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;4. 荣成楮岛水产有限公司 荣成 264312)
于2017年4、7、11月和2018年1月4个航次调查了桑沟湾浮游植物粒径结构的时空分布,并分析了粒径结构与主要环境因子的关系。结果显示,桑沟湾海域表、底层Chl浓度的年变化范围分别为0.74~3.27和0.81~3.66 µg/L,平均值分别为(1.90±1.28)和(2.01±1.29) µg/L,存在极显著的季节差异(<0.01)和空间分布的不均匀性。从粒径结构来看,小型浮游植物是春季表、底层浮游植物的主要贡献者,贡献率分别为54.05%和58.08%,夏、秋和冬季均是微型浮游植物占优势地位。冬季和春季微微型浮游植物的贡献率较小,但夏季和秋季的贡献率显著增多,夏季表、底层贡献率分别达24.46%和20.70%;秋季表、底层贡献率分别达35.88%和40.77%。冗余分析(Redundancy analysis, RDA)结果表明,温度(T)是影响浮游植物粒径结构的主要环境因子。溶解氧(DO)对微微型浮游植物占总浮游植物的比例有显著影响;微型浮游植物所占比例受亚硝酸盐(NO2-)、铵盐(NH4+)等影响显著;小型浮游植物对总浮游植物的贡献主要受温度影响,呈正相关。研究结果为深入认识桑沟湾养殖生态系统浮游植物的粒径结构、准确评估滤食性贝类的养殖容量提供了基础数据。
叶绿素;粒径结构;冗余分析;桑沟湾
浮游植物作为海洋初级生产力的主要贡献者,是海水养殖滤食性贝类的主要食物来源(吴文广等, 2016)。养殖容量评估是保障贝类养殖可持续发展的重要举措,目前,针对滤食性贝类养殖容量的评估多数基于浮游植物的现存量(张继红, 2008; 陈辰, 2012; 陈伟洲等, 2012)。但是研究表明,并非所有的浮游植物都可以被滤食性贝类摄食,在自然海水中,紫贻贝()、长牡蛎()及栉孔扇贝()对粒径2 μm的颗粒的截留效率仅为19%、17%和8%,对2 μm以下的颗粒物截留效率更低(张继红, 2008)。据报道,在海洋中50%以上的初级生产力来源于粒径小于3 μm的浮游植物(Glover, 1986; Li, 1983; Platt, 1983),但这部分的浮游植物并不能被滤食性贝类有效利用,所以,仅仅基于浮游植物总量进行养殖容量评估易造成评估结果的过高估计。
桑沟湾位于山东半岛东端,面积约133.3 km2。北、西、南三面为陆地环抱,东面与黄海相连,湾口宽约11.5 km,口门北到青鱼嘴(37°08¢49²N, 122°34¢32²E),南至楮岛(37°02¢32²N, 122°34¢14²E)。潮汐类型为不规则半日潮,湾内最大水深为15 m,平均水深为7~8 m,入湾的河流主要有崖头河、沽河和桑沟河等(宋云利等, 1996)。独特的地理位置和水文条件极大地推动了桑沟湾海水贝藻类养殖业的发展,长牡蛎、栉孔扇贝等滤食性贝类是该湾主要的贝类养殖品种。经过多年的扩大与发展形成了它特有的多元养殖模式:由湾内向湾外依次为贝类养殖区、海带()与牡蛎混养区和海带养殖区,并且海带的养殖已经扩展到了湾口外的大片海域(方建光等, 1996b; 郝林华等, 2012)。近些年来,多位学者对该湾的贝类养殖容量进行了评估(Ge, 2008; Ferreira, 1997; 方建光等, 1996a),但涉及饵料可获得性的关键参数均是基于总叶绿素含量,对不同粒径浮游植物组成研究的相对较少。浮游植物粒径与其能够被贝类滤食利用有直接关系,细化研究浮游植物的粒径结构对于准确评估贝类养殖容量、保证贝类养殖业的健康可持续发展具有重要的理论价值和指导意义。本研究于2017~2018年对桑沟湾海域开展了4次大面调查,获取了桑沟湾海域浮游植物生物量(Chl)的时空分布、粒级结构以及它们与环境因子间的相关关系,旨在揭示该海域不同粒级浮游植物的时空分布规律及其环境调节机制,从而为准确评估滤食性贝类的养殖容量提供基础数据。
1 材料与方法
1.1 站位设置和样品采集
本次调查共布设了21个采样站位,站位分布见图1。分别于2017年4、7、11月和2018年1月连续4个航次采样。站位水深小于10 m仅取表层水,超过10 m取表、底层水,水样4℃保存、备用。表、底层水温()、pH、盐度()和溶解氧(DO)等水质参数利用便携式水质分析仪(YSI公司,Professional Plus, 美国)现场测定。透明度的测定使用透明度盘。
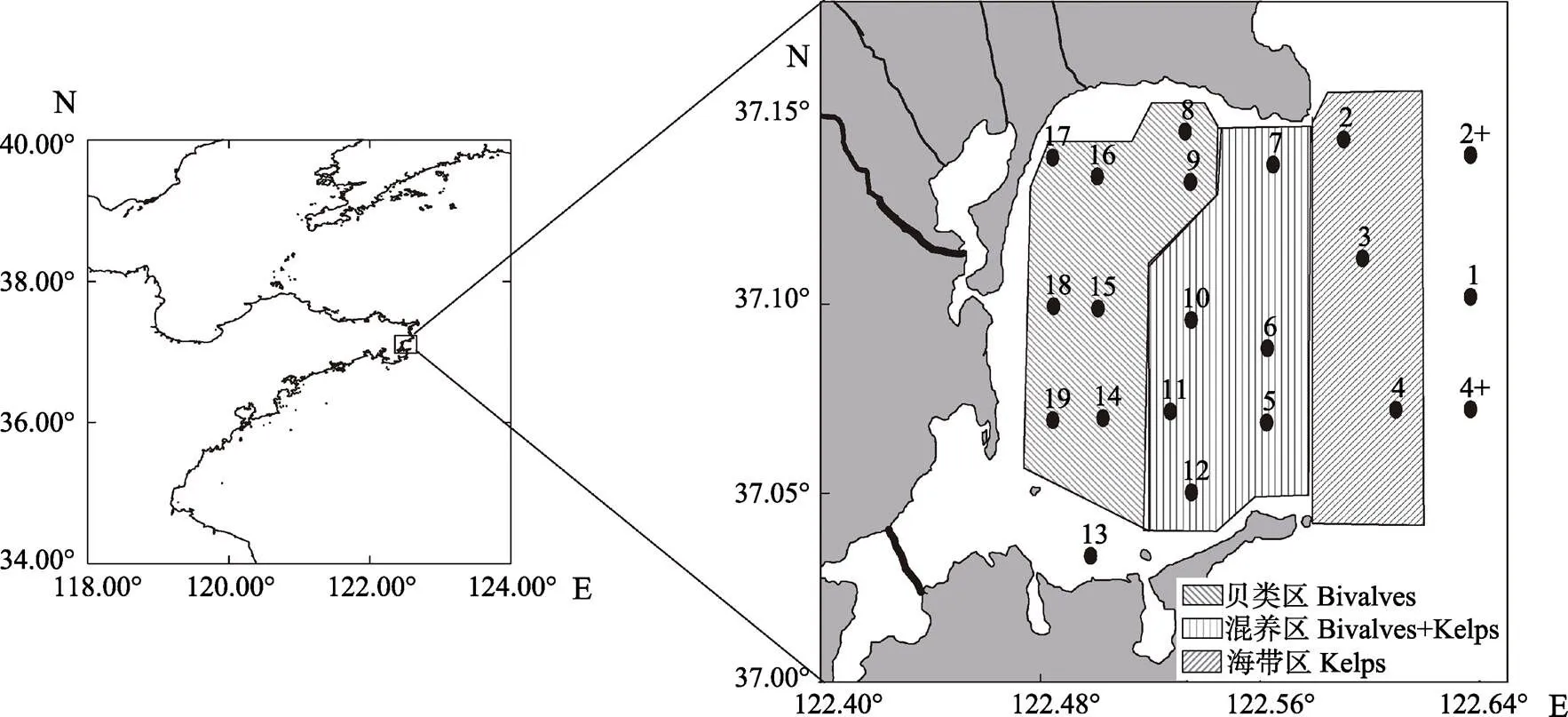
图1 桑沟湾海域调查站位
1.2 样品分析方法
每个站位取2 L水样,加入3 ml碳酸镁悬浊液,然后,准确量取水样800 ml过滤到0.45 μm的醋酸纤维素滤膜上,用于测定各站位浮游植物Chl总浓度;另取800 ml水样依次过滤到孔径为20 μm筛绢、2 μm及0.45 μm的醋酸纤维素膜上,用于测定3个不同粒级浮游植物的Chl浓度,滤膜用锡纸包裹后冷冻保存。低温避光条件下,用90%的丙酮萃取24 h,用多波长分光光度计测定Chl浓度。其中,大于20 μm为小型浮游植物,2~20 μm为微型浮游植物,0.45~2 μm为微微型浮游植物。营养盐的测定参照《海洋调查规范》(GB12763.4-2007)中的测定方法:磷酸(PO43-)采用抗坏血酸还原磷钼蓝法、亚硝酸盐(NO2-)采用重氮偶氮法、铵盐(NH4+)采用次溴酸钠氧化法、硝酸盐(NO3-)采用锌镉还原法。
1.3 数据处理与统计分析
浮游植物的平面分布图采用Golden software Surfer 11生成。不同季节浮游植物的差异比较采用单因素方差分析(One-way ANOVA),统计过程使用SPSS 19.0软件完成。粒径分级Chl含量与主要环境因子间的关系采用冗余分析(Redundancy analysis, RDA),分析过程使用Canoco for windows 4.5按照国际通用标准完成。先对粒径结构数据进行去趋势对应分析(Detrended correspondence analysis, DCA),发现第一轴的大小<3,所以,RDA分析适合本研究。
2 结果与分析
2.1 桑沟湾养殖水域Chl-a的时空分布特征
桑沟湾海域表、底层Chl浓度的时空变化特征见图2。从季节变化来看,桑沟湾海域表、底层Chl浓度的年变化范围分别为0.74~3.27和0.81~3.66 µg/L,平均值分别为(1.90±1.28) µg/L和(2.01±1.29) µg/L,季节差异极显著(<0.01)。

图2 桑沟湾海域表、底层Chl-a浓度的平面分布特征
表层:a: 春季; c: 夏季; e:秋季; g: 冬季; 底层:b: 春季; d: 夏季; f: 秋季; h: 冬季
Surface: a: Spring; c: Summer; e: Autumn; g: Winter; Bottom: b: Spring; d: Summer; f: Autumn; h: Winter
从平面分布来看,春季表层Chl浓度高值区出现在湾口的东北部和东部,形成一大一小2个高值区;夏季表层高值区出现在湾口北部靠近蔡家庄村附近;秋、冬季的高值区均出现在近岸海域。春季底层Chl主要分布于湾外北部海域;夏、秋季浮游植物主要分布于近岸海域,呈现从湾内向湾外递减的趋势;冬季底层Chl高值区出现在桑沟湾东部偏北海域。从垂直分布来看,春季表层Chl浓度低于底层,差异显著(<0.05);夏季表层Chl浓度虽高于底层,但差异不显著(>0.05);秋、冬季表、底层Chl浓度相近。
2.2 桑沟湾养殖水域浮游植物的粒径结构及时空变化特征
不同季节浮游植物的粒径结构分布见图3。从不同季节浮游植物的粒径结构来看,春季,表层小型和微型浮游植物的贡献率相当,分别占54.05%和46.71%;底层分别为58.08%和41.50%;微微型浮游植物表、底层贡献率均极低,分别为0.72%和0.42%。夏季,表、底层均以微型浮游植物为主,贡献率分别为50.04%和54.69%;小型和微微型浮游植物的贡献率相当。秋季,表层主要以微型浮游植物为主,贡献率为56.77%;微微型浮游植物次之,贡献率为35.88%;小型浮游植物仅占7.35%,底层浮游植物粒径结构组成与表层相似。冬季仍是微型浮游植物占优势地位,表、底层贡献率分别为53.46%和61.67%;小型浮游植物贡献率居于第二,表、底层分别为37.83%和36.47%;微微型浮游植物表、底层贡献率分别为8.71%和1.85%。
桑沟湾海域表层春、夏、秋、冬季不同粒径浮游植物Chl的时空变化特征见图4。从图4可以看出,春季,小型浮游植物Chl含量的变化范围为0.02~2.43 µg/L,在湾口的东部偏北和正东部形成一大一小2个高值区;微型浮游植物Chl含量的变化范围为0.16~0.62 µg/L,主要分布于湾西北、南部、东南和东部外海区域;微微型浮游植物Chl含量的变化范围是0~0.06 µg/L,分布呈现四周高、中间低的趋势。夏季,小型浮游植物的变化范围为0.41~1.99 µg/L,总体呈现从北向南依次递减的趋势;微型浮游植物Chl含量的变化范围为1.17~2.04 µg/L,主要分布于湾中部偏南,其次是北部沿岸,湾正西部和湾口东部浓度较低,呈“漏斗状”分布;微微型浮游植物Chl含量的变化范围为0.61~1.16 µg/L,高值区出现在湾中部偏南海域,浓度达到了1.16 µg/L,以11站位为中心形成1个三角区域。秋季,小型浮游植物的变化范围为0.10~0.46 µg/L,主要分布于西部沿岸海域;微浮游植物的变化范围为0.66~2.94 µg/L,高值区出现在海湾南部近岸处,湾口处浓度较低;微微型浮游植物的变化范围为0.19~2.18 µg/L,微微型浮游植物主要分布于桑沟湾东南部海域,以5号站位为中心呈“漩涡状”分布。冬季,小型浮游植物的变化范围为0.10~0.78 µg/L,在湾西部偏南海域的19号站位和北部海域的9号站位形成2个高值区;微型浮游植物的变化范围为0.22~1.19 µg/L,主要分布于西部近岸,其次是湾外,核心区域Chl含量较低,浓度仅为0.23 µg/L;微微型浮游植物的变化范围为0~0.22 µg/L,呈现四周高、中部低的趋势。
2.3 桑沟湾浮游植物的粒径结构与环境因子的关系
从表1可以看出,RDA前2轴对物种–环境关系的解释比率达100%,轴1的特征值大于轴2的特征值,但是物种与环境间关系累计百分比中轴1小于轴2。另外,轴1中浮游植物与环境因子的相关性为0.493,轴2为0.416。蒙特卡洛检验表明,所有典范轴均极显著(<0.01),说明RDA排序结果可信,可以较好地解释粒径结构与环境因子间的关系。从浮游植物的粒径结构在双轴空间上的分布来看(图5),第一轴主要反映了温度和溶解氧的变化,第二轴主要反映了盐度和N、P等营养盐的变化。小型浮游植物占总浮游植物的比例受温度和盐度影响显著,呈正相关,与N、P等营养盐呈负相关。微型浮游植物所占比例与温度和营养盐具有正相关关系,其中,亚硝酸盐(NO2-)、铵盐(NH4+)对其影响巨大。微微型浮游植物所占比例受溶解氧和温度的影响较大,与溶解氧呈正相关,温度呈负相关。从总体来看,温度是影响浮游植物粒径结构的主要环境因子。各个环境因子之间也存在相关性,温度与N、P等营养盐呈正相关,与溶解氧、盐度之间呈负相关。

图3 桑沟湾海域表、底层不同粒径浮游植物Chl-a占总Chl-a的比例
A:表层;B:底层
A: Surface; B: Bottom
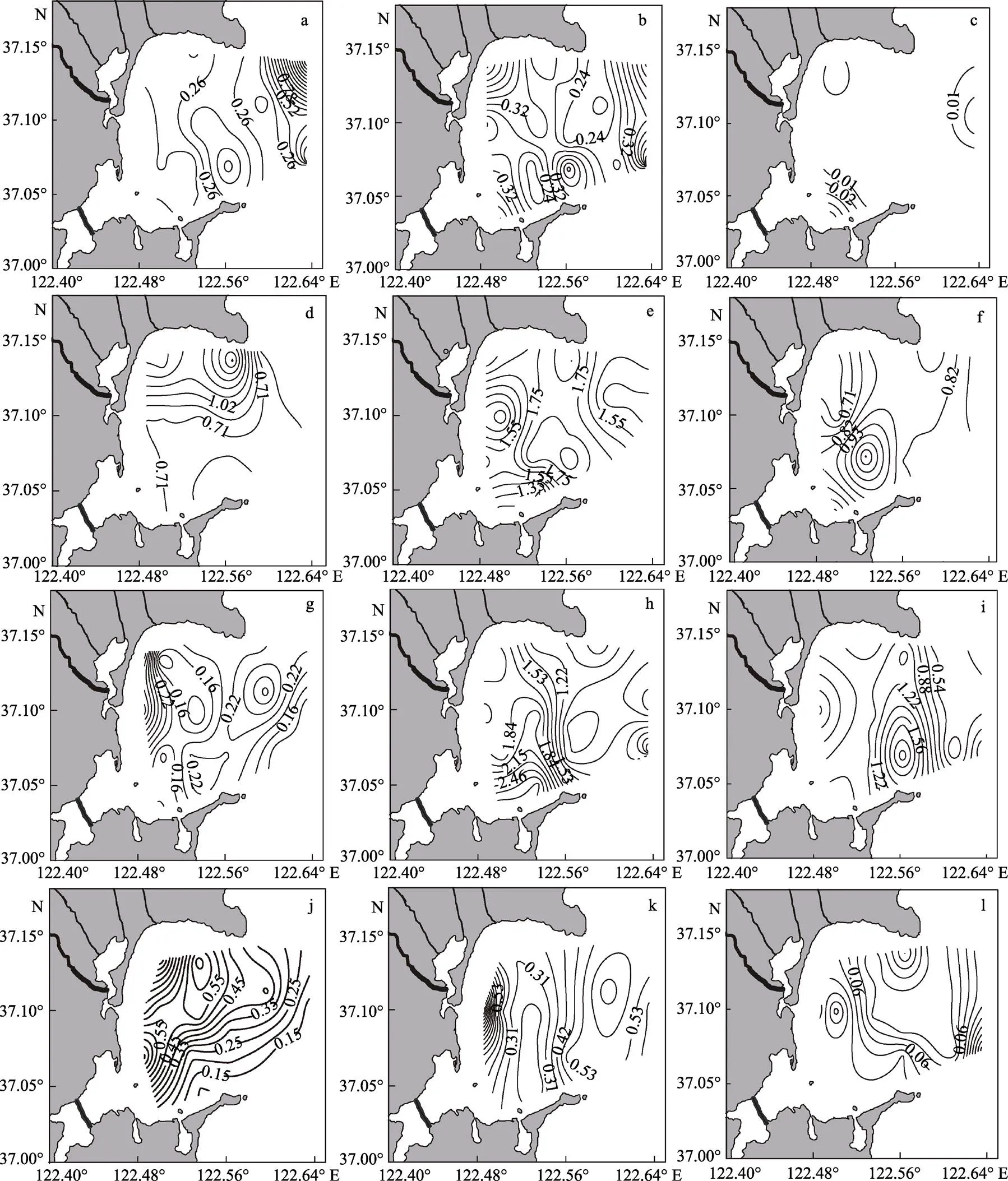
图4 桑沟湾海域表层不同粒径的浮游植物Chl-a的时空变化特征
春季:a: 小型; b: 微型; c: 微微型; 夏季:d: 小型; e: 微型; f: 微微型; 秋季:g: 小型; h: 微型; i: 微微型; 冬季:j: 小型; k: 微型; l: 微微型
Spring: a: Micro-; b: Nano-; c: Pico-; Summer: d: Micro-; e: Nano-; f: Pico-; Autumn: g: Micro-; h: Nano-; i: Pico-; Winter: j: Micro-; k: Nano-; l: Pico-

图5 桑沟湾海域表层浮游植物粒径与主要环境因子的冗余分析(RDA)
实心箭头:粒径结构;空心箭头:环境因子
Solid arrow: Size-fractionated phytoplankton; Hollow arrow: Environmental variables
表1 桑沟湾冗余分析(RDA)前两轴的统计特征
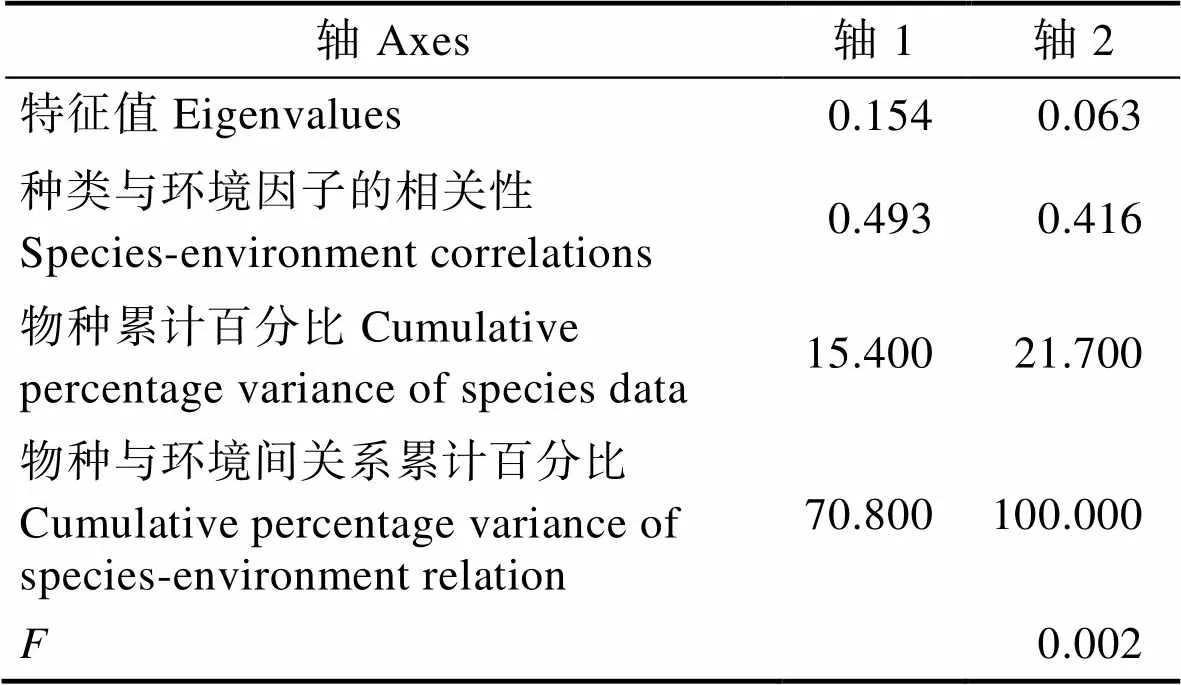
Tab.1 Statistical characteristics of the first two axes of the RDA analysis from Sanggou Bay
3 讨论
从季节变化来说,桑沟湾海域不同养殖区浮游植物呈现相似的变化规律(史洁等, 2010a)。高峰出现在夏季(2017年7月),这与郝林华等(2012)的研究结果相一致,低谷出现在春季(2017年4月)。春季,水温开始回升,光照增强,浮游植物进入快速生长期,但4月同样是海带的快速生长期,一方面,海带的快速生长消耗大量营养盐,与浮游植物形成营养盐竞争;另一方面,海带养殖影响海水的透光率,因此,春季浮游植物生长易受海带养殖影响(李超伦等, 2010),导致Chl的浓度偏低。夏季,温度升高,光照、营养盐充足,浮游植物迅速增殖;此外,夏季又是海带收获的季节,海带的大量减少使其对营养盐的竞争变小,从另一方面使浮游植物生物量显著增加;夏季降雨量大,地表径流带来大量营养盐,可直接刺激浮游植物生长繁殖,使种群数量增加。所以,一年之中Chl质量浓度的最高值出现在夏季。秋季,海带全部收获,湾内与外海水交换情况好转,使湾内的营养盐得到补充。但是,秋季水温开始降低,再加之10月是贝类的快速生长时期,贝类摄食压力抑制了秋季浮游植物高峰的形成(方建光等, 1996a),所以,此季节虽然湾内的营养盐的水平不低于夏季,但浮游植物开始逐渐减少,导致Chl质量浓度比夏季的低。冬季,温度、光照都处于一年中的最低水平,营养盐的含量也较低,所以浮游植物的生长较为缓慢。相关分析表明,底层浮游植物Chl含量与表层没有显著性差异,季节变化也与表层相同,表现为夏季>秋季>冬季>春季。
桑沟湾独特的养殖模式对浮游植物的平面分布也产生了巨大的影响。春季,Chl的高值区出现在湾口外的大片海域,营养盐的分布也出现此现象,这与吴文广等(2015)和郝林华等(2012)的研究结果相反。原因可能是湾内三面环陆海流较小,加之牡蛎和海带的养殖明显降低了海水的流速影响海水交换(Jackson, 1983; Boyd, 1998; 曾静, 2013),营养盐得不到补充,最终使得湾外浮游植物的浓度大于湾内。夏季,Chl的高值区出现在海带和牡蛎混养区,尤其是湾东北部近岸浓度最高,造成此现象的原因主要是7月(采样时期)海带大量收获,光照、营养盐有所改善,叶绿素浓度也逐渐上升,并且混养区除了海水本身的营养盐外,牡蛎的代谢也会为其提供一部分营养盐(王俊等, 2001)。大量的研究表明,贝床沉积物释放氨、Si及P等营养盐(Dame, 1989)。虽然,牡蛎会对浮游植物进行摄食,但7月不是牡蛎的快速生长期,其对浮游植物的下行控制有限。Smaal等(1986)和Prins等(1995)研究表明,滤食性贝类的滤食不仅给浮游植物造成摄食压力,也刺激了初级生产,加快浮游植物的生长速度。近岸海域,水深较浅,温度较高,营养盐充足时,温度越高浮游植物浓度越大(廖一波等, 2008),这也是近岸叶绿素浓度高的原因之一。秋季,浮游植物主要分布于湾内近岸海域,越靠近外海浓度越低,主要是秋季海带等藻类已全部收获,湾内水交换状况好转(史洁等, 2010b),且黄河沿岸流对湾内的影响开始加强(曾静, 2013),沿岸河流丰水期径流水携带大量的含N化合物进入湾内(郝林华等, 2012),使湾内营养盐得到大量补充,致使沿岸叶绿素浓度较高。冬季,从总体来看,湾西部近岸牡蛎养殖区浮游植物浓度较高,中部的混养区和湾口处的海带区浮游植物浓度较低,主要是因为此季节海带开始生长,海带对营养盐的竞争使湾中部的混养区和湾口处的海带区营养盐含量降低,致使Chl的质量浓度降低。滤食性贝类对食物具有选择性,贝类不能全部利用其滤食的食物,其中,大部分以粪和假粪的形式形成生物沉积(秦培兵等, 2001)。大量的沉积物构成了丰富的营养库,经矿化作用和重悬浮后又可重新进入水体营养盐循环(Peterson, 1999),这也是夏、秋、冬季贝类养殖区浮游植物浓度高于其他海区的重要原因。因此,桑沟湾海域浮游植物Chl的时空分布不仅受复杂多变的海洋环境如温度、光照和海流等因素影响,还与养殖环境状况有关。
除浮游植物的平面分布随着养殖活动呈现一定的规律外,其群落结构也受到一定的影响。有研究表明,浮游植物的群落结构受营养盐等因素的上行控制和滤食性贝类摄食的下行控制的影响(Prins, 1995; 董双林等, 1999; Souchu, 2001)。光照、营养盐等充足条件下,粒径较大的浮游植物在群落中具有竞争优势(Cermeño, 2005),光照、营养盐等匮乏条件下,粒径较小的浮游植物由于具有较大的比表面积,在寡营养海域表现出竞争优势(Chen, 2000; 黄邦钦等, 2006)。桑沟湾海域属于贫营养型(孙丕喜等, 2007; 徐东会等, 2017),从浮游植物的粒径结构特点来看,除春季小型和微型浮游植物的贡献相当外,夏、秋、冬季均是微型浮游植物为主要贡献者,这符合学者们普遍认为的浮游植物粒径结构特征。张继红(2008)研究表明,长牡蛎对于2 μm的颗粒物截留效率为19%,在一定范围内,颗粒物越大,截留效率越高,而对于2 μm以下的颗粒物截留效率极低。由于牡蛎的摄食机制,长期养殖牡蛎的海域容易出现浮游植物小型化的趋势,个体较大的优势种类逐渐被个体较小的种类代替(Frau, 2016; Nakamura, 2000)。张玲等(2015a、b)对大鹏澳牡蛎养殖区和郝彦菊等(2010)、丘耀文等(2005)对大亚湾海域的研究也验证了这点。在调查期间发现,桑沟湾牡蛎养殖区和混养区也出现了此现象。从同一季节不同养殖区域各粒径浮游植物的占比来看,春、秋和冬季微微型浮游植物占总浮游植物的比例,牡蛎区和贝藻混养区高于海带区,牡蛎养殖区和混养区出现了小型化的趋势。这与徐文琦等(2016)对桑沟湾的研究结果一致。夏季整个海区各粒径浮游植物的占比基本相同,这可能是因为夏季海带已全部收获,湾内水交换状况良好,良好的水交换使整个海湾温度、盐度和营养盐等基本一致,这些理化因子对浮游植物的上行控制大于牡蛎摄食对其的下行控制,从而导致夏季3个养殖区浮游植物的粒径结构一致。此研究仅从粒径结构方面分析了滤食性贝类(牡蛎)对浮游植物的影响,具体对浮游植物种群结构的影响有待进一步研究。
滤食性贝类通常被认为是植食性的,硅藻(Diatom)是其主要的食物来源(陆家昌, 2017)。但在桑沟湾这样一个贫营养型的海区,浮游植物的丰度和产量经常不足以满足贝类的能量需求,并且滤食性贝类对食物颗粒的大小具有选择性,大部分贝类需要借助鳃丝表面的前纤毛、前侧纤毛和侧纤毛来完成摄食(鄢灵兰, 2009)。诸多的研究结果表明,滤食性贝类不能有效截留微微型浮游生物(Kreeger, 1996; Riisgård, 1988; Yukihira, 1999),但是,较之小型和微型浮游植物、微微型浮游植物有着更高的生产力(Glover, 1986; Li, 1983; Platt, 1983)。从粒径结构来看,纤毛虫()可以被牡蛎截留,并且在牡蛎的假粪中没有发现纤毛虫的壳,这说明纤毛虫的壳和柔软部分都能被贝类利用(陆家昌, 2017)。N15标记的结果也表明,牡蛎不仅可以截留,还可以消化、吸收和利用纤毛虫(Gall, 1997)。这就说明滤食性贝类的食物来源不仅是浮游植物,其还能利用鞭毛虫()、纤毛虫等原生动物来补充当地浮游植物的不足。桑沟湾夏、秋2季微微型浮游植物的含量很多,秋季对总浮游植物的贡献率达到了35.88%。这部分的浮游植物虽然不能被滤食性贝类直接摄食,但可以通过鞭毛虫、纤毛虫等原生动物实现对其的间接利用,微微型浮游植物通过这种“打包”作用进入经典食物链(黄邦钦等, 2003),在这个过程中,鞭毛虫或者纤毛虫起到一个重要的营养连接的作用(Gall, 1997)。以微微型浮游植物为起点的微型生物食物网在浅海贝类养殖生态系统中占有十分重要的地位。
Boyd AJ, Heasman KG. Shellfish mariculture in the Benguela system: Water flow patterns within a mussel farm in Saldanha Bay, South Africa. Journal of Shellfish Research, 1998, 17(1): 25–32
Peterson BJ, Heck KL. The potential for suspension feeding bivalves to increase seagrass productivity. Journal of Experimental Marine Biology and Ecology, 1999, 240(1): 37–52
Cermeño P, Marañón E, Rodríguez J,. Large-sized phytoplankton sustain higher carbon-specific photosynthesis than smaller cells in a coastal eutrophic ecosystem. Marine Ecology Progress Series, 2005, 297(297): 51
Chen C. Studies on environmental conditions and carrying capacity of Pacific oyster farming sites in Rushan. Master′s Thesis of Ocean University of China, 2012 [陈辰. 乳山海域长牡蛎养殖环境与养殖容量研究. 中国海洋大学硕士研究生学位论文, 2012]
Chen WZ, Cao HB, Du H,. Research on carrying capacity ofin the Shen'ao Bay. Ecological Science, 2012, 31(5): 558–562 [陈伟洲, 曹会彬, 杜虹, 等. 深澳湾太平洋牡蛎养殖容量研究. 生态科学, 2012, 31(5): 558–562]
Chen YLL. Comparisons of primary productivity and phytoplankton size structure in the marginal regions of southern East China Sea. Continental Shelf Research, 2000, 20(4): 437–458
Dame RF, Spurrier JD, Wolaver TG. Carbon, nitrogen and phosphorus processing by an oyster reef. Marine Ecology Progress Series, 1989, 54(3): 249–256
Dong SL, Wang F, Wang J,. Effects of bay scallop on plankton and water quality of mariculture pond. Acta Oceanologica Sinica, 1999, 21(6): 138–144 [董双林, 王芳, 王俊, 等. 海湾扇贝对海水池塘浮游生物和水质的影响. 海洋学报, 1999, 21(6): 138–144]
Fang JG, Kuang SH, Sun HL,. Study on the carrying capacity of Sanggou Bay for the culture of scallop. Marine Fisheries Research, 1996a, 17(2): 18–31 [方建光, 匡世焕, 孙慧玲, 等. 桑沟湾栉孔扇贝养殖容量的研究. 海洋水产研究, 1996a, 17(2): 18–31]
Fang JG, Sun HL, Kuang SH,. Assessing the carrying capacity of Sanggou Bay for culture of kelp. Marine Fisheries Research, 1996b, 17(2): 7–17 [方建光, 孙慧玲, 匡世焕, 等. 桑沟湾海带养殖容量的研究. 海洋水产研究, 1996b, 17(2): 18–31]
Ferreira JG, Duarte P, Ball B. Trophic capacity of Carlingford Lough for oyster culture – Analysis by ecological modelling. Aquatic Ecology, 1997, 31(4): 361–378
Frau D, Molina FR, Mayora G. Feeding selectivity of the invasive mussel(Dunker, 1857) on a natural phytoplankton assemblage: What really matters? Limnology, 2016, 17(1): 47–57
Gall SL, Hassen MB, Gall PL. Ingestion of a bacterivorous ciliate by the oyster: Protozoa as a trophic link between picoplankton and benthic suspension-feeders. Marine Ecology Progress Series, 1997, 152(1–3): 301–306
Ge CZ, Fang JG, Song XF,. Response of phytoplankton to multispecies mariculture: A case study on the carrying capacity of shellfish in the Sanggou Bay in China. Acta Oceanologica Sinica, 2008, 27(1): 102–112
Glover HE, Campbell L, Prézelin BB. Contribution ofspp. to size-fractioned primary productivity in three water masses in the northwest Atlantic Ocean. Marine Biology, 1986, 91(2): 193–203
Hao LH, Sun PX, Hao JM,. The spatial and temporal distribution of chlorophyll-and its influencing factors in Sanggou Bay. Ecology and Environmental Sciences, 2012, 21(2): 338–345 [郝林华, 孙丕喜, 郝建民, 等. 桑沟湾海域叶绿素的时空分布特征及其影响因素研究. 生态环境学报, 2012, 21(2): 338–345]
Hao YJ, Tang DL. Changes in phytoplankton community structure in response to water temperature increases in Daya Bay, China. Ecology and Environmental Sciences, 2010, 19(8): 1794–1800 [郝彦菊, 唐丹玲. 大亚湾浮游植物群落结构变化及其对水温上升的响应. 生态环境学报, 2010, 19(8): 1794–1800]
Huang BQ, Hong HS, Lin XJ,. Ecological study on picophytoplankton in the Taiwan Strait—I. Spatial and temporal distribution and its controlling mechanism. Acta Oceanologica Sinica, 2003, 25(4): 72–82 [黄邦钦, 洪华生, 林学举, 等. 台湾海峡微微型浮游植物的生态研究—Ⅰ. 时空分布及其调控机制. 海洋学报, 2003, 25(4): 72–82]
Huang BQ, Liu Y, Chen JX,. Temporal and spatial distribution of size fractionized phytoplankton biomass in East China Sea and Huanghai Sea. Acta Oceanologica Sinica, 2006, 28(2): 156–164 [黄邦钦, 刘媛, 陈纪新, 等. 东海、黄海浮游植物生物量的粒级结构及时空分布. 海洋学报, 2006, 28(2): 156–164]
Jackson GA, Winant CD. Effect of a kelp forest on coastal currents. Continental Shelf Research, 1983, 2(1): 75–80
Kreeger DA, Rie N. Ingestion and assimilation of carbon from cellulolytic bacteria and heterotrophic flagellates by the musselsand(Bivalvia, Mollusca). Aquatic Microbial Ecology, 1996, 11(3): 205–214
Liao YB, Chen QZ, Zeng JN,. Thermal effect on the marine phytoplankton in Xiangshan Bay, China. Acta Ecologica Sinica, 2008, 28(9): 4203–4212 [廖一波, 陈全震, 曾江宁, 等. 海洋浮游植物的热效应. 生态学报, 2008, 28(9): 4203–4212]
Li CL, Zhang YS, Sun S,. Species composition, density and seasonal variation of phytoplankton in Sanggou Bay, China. Progress in Fishery Sciences, 2010, 31(4): 1–8 [李超伦, 张永山, 孙松, 等. 桑沟湾浮游植物种类组成、数量分布及其季节变化. 渔业科学进展, 2010, 31(4): 1–8]
Li WKW, Rao DVS, Harrison WG,. Autotrophic picoplankton in the tropical ocean. Science, 1983, 219(4582): 292–295
Lu JC. Ecological studies on the nanoflagellates in Sanggou Bay. Doctoral Dissertation of Xiamen University, 2017 [陆家昌. 桑沟湾微型鞭毛虫的生态学研究. 厦门大学博士研究生学位论文, 2017]
Nakamura Y, Kerciku F. Effects of filter-feeding bivalves on the distribution of water quality and nutrient cycling in a eutrophic coastal lagoon. Journal of Marine Systems, 2000, 26(2): 209–221
Platt T, Rao DVS, Irwin B. Photosynthesis of picoplankton in the oligotrophic ocean. Nature, 1983, 301(5902): 702–704
Prins TC, Escaravage V, Smaal AC,. Nutrient cycling and phytoplankton dynamics in relation to mussel grazing in a mesocosm experiment. Ophelia, 1995, 41(1): 289–315
Qin PB, Lu JW. Effect of filter-feeding bivalves on nutrient cycle of mariculture system: A view. Marine Sciences, 2001, 25(5): 27–29 [秦培兵, 卢继武. 滤食性贝类对浅海养殖系统中营养盐循环的影响. 海洋科学, 2001, 25(5): 27–29]
Qiu YW, Wang ZD, Zhu LS. Variation trend of nutrient and chlorophyll contents and their effects on ecological environment in Daya Bay. Journal of Oceanography in Taiwan Strait, 2005, 24(2): 131–139 [丘耀文, 王肇鼎, 朱良生. 大亚湾海域营养盐与叶绿素含量的变化趋势及其对生态环境的影响. 台湾海峡, 2005, 24(2): 131–139]
Riisgård HU. Efficiency of particle retention and filtration-rate in 6 species of Northeast American bivalves. Marine Ecology Progress, 1988, 45(3): 217–223
Shi J, Wei H, Zhao L,. Study on ecosystem model of multi-species culture in Sanggou Bay: ⅡSimulation of ecosystem and the circulation of nutrients. Progress in Fishery Sciences, 2010a, 31(4): 36–42 [史洁, 魏皓, 赵亮, 等. 桑沟湾多元养殖生态模型研究: Ⅱ生态环境模拟与生源要素循环. 渔业科学进展, 2010a, 31(4): 36–42]
Shi J, Wei H, Zhao L,. Study on ecosystem model of multi-species culture in Sanggou Bay: Ⅲ Numerical study on the kelp culture carrying capacity. Progress in Fishery Sciences, 2010b, 31(4): 43–52 [史洁, 魏皓, 赵亮, 等. 桑沟湾多元养殖生态模型研究: Ⅲ海带养殖容量的数值研究. 渔业科学进展, 2010b, 31(4): 43–52]
Smaal AC, Verbagen JHG, Coosen J,. Interaction between seston quantity and quality and benthic suspension feeders in the Oosterschelde, the Netherlands. Ophelia, 1986, 26(1): 385–399
Song YL, Cui Y, Sun Y,. Study on nutrient state and influencing factors in Sanggou Bay. Marine Fisheries Research, 1996, 17(2): 41–51 [宋云利, 崔毅, 孙耀, 等. 桑沟湾养殖海域营养状况及其影响因素分析. 海洋水产研究, 1996, 17(2): 41–51]
Souchu P, Vaquer A, Collos Y,. Influence of shellfish farming activities on the biogeochemical composition of the water column in Thau lagoon. Marine Ecology Progress Series, 2001, 218(1): 141–152
Sun PX, Zhang ZH, Hao LH,. Analysis of nutrient distributions and potential eutrophication in seawater of the Sanggou Bay. Advances in Marine Science, 2007, 25(4): 436–445 [孙丕喜, 张朝晖, 郝林华, 等. 桑沟湾海水中营养盐分布及潜在性富营养化分析. 海洋科学进展, 2007, 25(4): 436–445]
Wang J, Jang ZH, Dong SL. Role of filter-feeding bivalves in proliferation of phytoplankton community. Chinese Journal of Applied Ecology, 2001, 12(5): 765–768 [王俊, 姜祖辉, 董双林. 滤食性贝类对浮游植物群落增殖作用的研究. 应用生态学报, 2001, 12(5): 765–768]
Wu WG, Zhang JH, Wang W,. Distribution of chlorophyll-concentration and its control factors in spring in Sanggou Bay. Acta Ecologica Sinica, 2016, 36(15): 4855–4863 [吴文广, 张继红, 王巍, 等. 桑沟湾春季叶绿素浓度分布及其影响因素. 生态学报, 2016, 36(15): 4855–4863]
Wu WG, Zhang JH, Wang W,. Variation of Chl-concentration and its control factors pre-and-post-the- harvest of kelp in Sanggou Bay. Journal of Fisheries of China, 2015, 39(8): 1178–1186 [吴文广, 张继红, 王巍, 等. 桑沟湾水域叶绿素在海带收获前后的变化及其影响因素. 水产学报, 2015, 39(8): 1178–1186]
Xu DH, Chen BJ, Jiang T,. Temporal and spatial variation characteristics of water nutrients and eutrophication evaluation in aquaculture water areas of Sanggou Bay. Progress in Fishery Sciences, 2017, 38(3): 1–11 [徐东会, 陈碧鹃, 江涛, 等. 桑沟湾养殖海域营养盐时空分布特征及富营养化评价. 渔业科学进展, 2017, 38(3): 1–11]
Xu WQ, Liu SM. Phytoplankton responses to phosphorus in Sanggou Bay in spring and autumn. Advances in Marine Sciences, 2016(2): 26–37 [徐文琦, 刘素美. 春季和秋季桑沟湾浮游植物对磷的响应. 海洋科学前沿, 2016(2): 26–37]
Yan LL. Ecological study on optimization of freshwater pearl mussel () culture. Master′s Thesis of Shanghai Ocean University, 2009 [鄢灵兰. 三角帆蚌优化养殖的生态学研究. 上海海洋大学硕士研究生学位论文, 2009]
Yukihira H, Klumpp DW, Lucas JS. Feeding adaptations of the pearl oystersandto variations in natural particulates. Marine Ecology Progress, 1999, 182(3): 161–173
Zeng J. The study on the hydrodynamic environment in Sanggou Bay–The method combining support vector machine with hydrodynamic model. Doctoral Dissertation of Ocean University of China, 2013 [曾静. 桑沟湾水动力环境变化研究–支持向量机与水动力模式相结合方法探讨. 中国海洋大学博士研究生学位论文, 2013]
Zhang JH. Effect of filter feeding shellfish mariculture on the ecosystem and the evaluation of ecology carrying capacity. Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2008 [张继红. 滤食性贝类养殖活动对海域生态系统的影响及生态容量评估. 中国科学院海洋研究所博士研究生学位论文, 2008]
Zhang L, Li ZJ, Chen FY,. Impact of oyster aquaculture on phytoplankton population structure in Dapengao Cove. Oceanologia et Limnologia Sinica, 2015a, 46(3): 549–555 [张玲, 李政菊, 陈飞羽, 等. 大鹏澳牡蛎养殖对浮游植物种群结构的影响研究. 海洋与湖沼, 2015a, 46(3): 549–555]
Zhang L. Study on the temporal and spatial dynamics of phytoplankton in oyster farm areas and adjacent waters of Dapengao Cove. Master′s Thesis of Jinan University, 2015b [张玲. 大鹏澳牡蛎养殖区及邻近海域浮游植物时空动态研究. 暨南大学硕士研究生学位论文, 2015b]
Distribution of Size-Fractionated Phytoplankton and Its Relationship with Environmental Variables in Sanggou Bay
LI Fengxue1,2, JIANG Zengjie2,3①, GAO Yaping2, DU Meirong2, WANG Xiaoqin2, LI Wenhao1,2, HOU Xing1,2, DONG Shipeng1,2, WANG Junwei4, ZHANG Yitao4
(1. College of Fishers and Life Sciences, Shanghai Ocean University, Shanghai 201306; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences,Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agricultureand Rural Affairs, Qingdao 266071; 3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071; 4. Rongcheng Chudao Aquaculture Corporation, Rongcheng 264312)
Surveys have been conducted to investigate the spatial and temporal distribution of size-fractionated phytoplankton and other environmental variables in Sanggou Bay in four seasons for the period covering April 2017 until January 2018. Results showed that chlorophyllconcentration in the surface and bottom layers ranged from 0.74 to 3.27 µg/L and from 0.81 to 3.66 µg/L, respectively, with average values of (1.90±1.28) and (2.01±1.29) µg/L, respectively. There were significant differences in chlorophyllconcentration (<0.01) and spatial distribution between seasons. In spring, microphytoplankton was the most abundant, accounting for 54.05% and 58.08% of the total phytoplankton in the surface and bottom layers, respectively. In summer, picophytoplankton was the most abundant, accounting for 24.46% and 20.70% of total cholorophyllin the surface and bottom layers,respectively. In autumn, picophytoplankton accounted for 35.88% and 40.77% of total chlorophyllin the surface and bottom layers, respectively. The contribution of picophytoplankton was low in winter and spring but increased significantly in summer and autumn. Redundancy analysis (RDA) results show that temperature is the main environmental factor affecting the size structure of phytoplankton. Dissolved oxygen had a significant effect on the percentage of picophytoplankton to total phytoplankton. The percentage of nanophytoplankton correlated with NO2-and NH4+. There was a significant positive correlation between temperature and the percentage of microphytoplankton. This study provides basic knowledge for understanding the size structure of phytoplankton and estimating the carrying capacity of filter-feeding shellfish in the aquaculture ecosystem in Sanggou Bay.
Chlorophyll-; Size fraction; Redundancy analysis; Sanggou Bay
S931
A
2095-9869(2020)01-0031-10
10.19663/j.issn2095-9869.20181015004
* 国家自然科学基金面上项目(41676147)和国家贝类产业技术体系养殖容量评估与管理岗位(CARS-49)共同资助[This work was supported by National Natural Science Foundation of China (General Program) (41676147), and Modern Agro-Industry Technology Research System (CARS-49)]. 李凤雪,E-mail: 825590220@qq.com
蒋增杰,研究员,E-mail: jiangzj@ysfri.ac.cn
2018-10-15,
2018-11-09
http://www.yykxjz.cn/
李凤雪, 蒋增杰, 高亚平, 杜美荣, 王晓芹, 李文豪, 侯兴, 董世鹏, 王军威, 张义涛. 桑沟湾浮游植物粒径结构及其与环境因子的关系. 渔业科学进展, 2020, 41(1): 31–40
Li FX, Jiang ZJ, Gao YP, Du MR, Wang XQ, Li WH, Hou X, Dong SP, Wang JW, Zhang YT. Distribution of size-fractionated phytoplankton and its relationship with environmental variables in Sanggou Bay. Progress in Fishery Sciences, 2020, 41(1): 31–40
JIANG Zengjie, E-mail: jiangzj@ysfri.ac.cn
(编辑 陈辉)

