分子印迹聚合物在抗生素残留测定中的应用
王莉燕, 王加男, 李金花, 陈令新
(1. 中国科学院烟台海岸带研究所, 中国科学院海岸带环境过程与生态修复重点实验室, 山东 烟台 264003; 2. 烟台大学土木工程学院, 山东 烟台 264005; 3. 烟台工程职业技术学院, 山东 烟台 264006; 4. 中国科学院大学, 北京 100049)
抗生素(antibiotics)残留问题是当今国内外重要的研究热点。自从1929年青霉素问世以来,抗生素成为改善人类和动物健康的福音,其主要包括磺胺类(sulfonamides, SAs)、氟喹诺酮类(fluoroquinolones, FQs)、β-内酰胺类(β-lactams)、氨基糖苷类(aminoglycosides, AGs)、四环素类(tetracyclines, TCs)、大环内酯类(macrolides, MACs)和氯霉素类(chloramphenicols, CPs)等,广泛应用于疾病治疗、畜牧业及水产养殖业。然而,抗生素的滥用会导致其在动物体内和环境中残留并累积,不仅能诱导耐药性细菌的生长,而且会通过食物链蓄积毒性,对生态环境造成一定危害,最终危害人体健康[1,2]。抗生素滥用导致的细菌耐药性已成为威胁人类健康的焦点问题,2015年第六十八届世界卫生大会批准《抗微生物药物耐药性全球行动计划》,旨在应对抗微生物药物耐药性问题,包括抗生素耐药性这一最紧迫的耐药趋势[3]。
抗生素的残留量通常为痕量或超痕量水平(多以 μg/L或ng/L来计),更低的检出限、更多组分的同时检测和更短的检测时间是抗生素检测的突破方向。食物和环境样品基质复杂,且残留的抗生素含量低、种类多,需要采取前处理技术最大限度地降低乃至去除基质的干扰并浓缩富集目标物,从而提高方法的检测灵敏度。目前,最常用于分析抗生素的前处理方法是固相萃取法(SPE)[4],但市售的萃取填料选择性低,在分析浓度极低的液体样品时,富集倍数有限,很容易将共存的干扰物一起萃取出来;而且萃取操作过程复杂、费时费力,填料消耗较多,在处理复杂样品时容易发生柱堵塞现象。为了降低乃至去除基质干扰,实现抗生素的简便、快速和灵敏分析,发展选择性高且能实现简便富集、快速分离的固相萃取吸附材料和技术成为研究的焦点,其中,采用分子印迹技术制得的分子印迹聚合物(molecularly imprinted polymers, MIPs)拥有与目标分子高度匹配的特异性识别位点,在样品前处理领域备受青睐[5]。本课题组[6,7]对分子印迹的内涵、制备方法及热点应用进行了综合性评述,并总结了MIPs固相萃取研究进展。李攻科课题组[8]综述了分子印迹微萃取技术的研究进展;欧阳刚峰课题组[9]总结了磁性MIPs在样品制备中的应用。Bitas和Samanidou[4]对MIPs萃取结合色谱分析用于牛奶中抗生素测定进行了总结;Mohsenzadeh等[10]综述了MIPs用于牛奶中抗生素测定的研究进展。因此,本文对MIPs在抗生素残留检测中的样品前处理应用进行了总结,提出MIPs制备面临的挑战,重点介绍了抗生素MIPs的固相萃取应用及其制备新策略(见图1)。
1 分子印迹聚合物
1.1 分子印迹技术
分子印迹技术是在模拟自然界中酶-底物及抗原-抗体之间相互作用的基础上发展起来的一种技术,可制备对特定目标分子具有特异选择性的分子印迹聚合物,常被形象地描绘为制造识别“分子钥匙”的“人工锁”技术[6,7]。分子印迹过程通常分为3部分[11]: (1)模板分子与功能单体通过一定的方式(如非共价结合(氢键、静电作用力、疏水作用力)、共价结合、配位作用等)进行预组装,形成主客体配合物;(2)加入交联剂,通过一定的引发方式引发(如引发剂引发、热引发、光引发等)进行聚合,生成高度交联的高分子聚合物;(3)用适当的手段(如索氏抽提等)洗脱去除模板分子,得到对模板分子具有构效预定性、特异识别性的MIPs。
目前用于MIPs制备的方法主要有自由基聚合和溶胶-凝胶法。自由基聚合主要包括传统的本体聚合、溶液聚合、悬浮聚合和乳液聚合等,已被用于无定形[12]、球形[13-16]、树枝状[17]、整体柱[18]、膜[19]等不同形貌MIPs的制备。其中,本体聚合易于操作控制,但得到的聚合物颗粒大小不一,形状不规则,降低了其在色谱应用中的柱效率,造成峰拖尾现象严重;沉淀聚合、悬浮聚合、乳液聚合是制备球形颗粒MIPs的有效方法;基于烷氧基硅烷(TEOS、TMOS等)水解的溶胶-凝胶聚合,条件温和,能够在水相识别,并克服了自由基聚合多在有机相中合成的缺点,已经发展成为分子印迹一个重要的研究方向[6]。
1.2 MIPs制备中的挑战
MIPs在聚合方法、聚合物形貌、应用领域不断拓展,然而,一些亟待解决的问题[6,20,21]限制了MIPs的应用,主要包括以下几点:
(1)MIPs结合容量低。MIPs制备过程中使用大量交联剂,使得单位质量印迹聚合物中的识别位点数量有限,且大部分识别位点处于交联聚合物内部,介质扩散阻力大,目标识别分子难以接近这些内部空穴,造成无效识别位点。采用表面印迹技术可有效解决这一问题。
(2)模板分子洗脱不彻底造成模板泄漏干扰。传统聚合方法得到的聚合物微球内部的印迹分子包埋过深,不易洗脱,位点无法利用;在萃取过程中,MIPs中未洗脱的模板分子可能出现泄漏,干扰真实样品的检测结果。采用虚拟模板策略可有效克服模板泄漏造成的干扰。
(3)MIPs水相识别能力差。目前水环境下的分子识别问题仍是一个较大挑战,原因在于:首先,常用的制备方法主要为非共价法,其中单体和模板分子之间的作用力主要为氢键,而水能破坏单体和模板之间的氢键作用力,使得MIPs在水相中识别能力差;其次,MIPs属于有机高聚物,与水的极性相差较大,难以在水相中均匀分散,限制了其在水体环境中的应用。常采用的解决方案是通过不受水干扰的作用力进行印迹,如金属螯合作用力、疏水作用力;对MIPs表面进行亲水性改性,如引入亲水性功能单体、接枝亲水性的聚合物刷。
(4)有效用于印迹的功能单体和交联剂种类较少。对于一些结构复杂、特殊的模板分子难以进行特异性结合和聚合反应,极大限制了分子印迹技术的发展。需要发展新型的具有多功能的单体(如离子液体[22]等)和相应稳定有效的交联剂。此外,一些特异性好的功能单体、交联剂和引发剂成本比较昂贵,需要研究探索一些便宜常见且实用的反应原料。
(5)MIPs合成方式有限。现阶段MIPs材料合成方式还局限于溶胶-凝胶聚合、自由基聚合、单/多种子溶胀聚合等经典方式,但是对于有效识别位点的可控、定向合成方式有待探索。尝试利用点击化学,通过铜催化叠氮化物-炔烃环加成反应,在聚合物表面引入功能链以实现精确定位结合模板分子的基团,该方法制备的MIPs甚至能区分细微的结构变化[23]。尝试利用硼亲和可控定向表面印迹[24],通过调节印迹时间来精确控制调整印迹层厚度,同时简化印迹步骤。尝试利用双模板对接定向印迹[25],通过模板-模板对接而实现在介孔材料内部的空间定向印迹,提高印迹效率。上述方法成功实现了有效识别位点的可控、定向合成,与此同时,在定量合成一定数量的识别位点等方面还需进一步探索。
(6)对MIPs从绿色合成到绿色应用方面亟须加强。应该从对环境无污染和生态友好方面来合理设计和制备MIPs并进行绿色应用。在MIPs的设计合成中,利用计算机辅助设计,筛选和优化MIPs的制备条件,减少废弃物的产生,降低实验成本,节约时间,提高成功率。寻找环保的试剂来制备MIPs,如使用生物源的功能单体/交联剂,使用离子液体作为功能单体,使用水作为绿色致孔溶剂和模板去除溶剂等。尝试采用简单、快速的聚合方法制备MIPs,如一锅表面印迹法、一步沉淀聚合法、溶胶-凝胶法、可控/活性自由基聚合等。将MIPs应用于小型/微型化、操作简单、易分离的样品前处理技术中,如分散固相萃取(DSPE)、固相微萃取(SPME)、磁固相萃取(MSPE)等,减少MIPs和有机试剂的使用量,节省前处理时间。
2 MIPs在抗生素吸附萃取中的应用
MIPs具有构效预设性、特异选择性、稳定性、制备成本低、可重复使用等特点,作为一种高效的吸附萃取材料,已被广泛用于复杂样品中痕量抗生素的高选择性浓缩富集,并发展了基于这些MIPs材料的固相萃取[18,22,26-53]、分散固相萃取[19,54-57]、磁固相萃取[58-73]、基质固相分散萃取(MSPD)[74,75]、固相微萃取[76-80]、搅拌棒吸附萃取(SBSE)[81-84]等固相萃取方法,结合色谱等分离检测技术,实现了复杂样品中多种抗生素污染物的快速、同时、选择性富集和灵敏检测。MIPs在抗生素吸附萃取中的应用见表1。
2.1 MIPs在固相萃取中的应用
固相萃取是一种基于液-固相色谱理论的前处理技术,利用固相吸附剂将液体样品中的目标物进行选择性吸附萃取,然后再用洗脱液洗脱或加热解吸附,达到分离和富集目标化合物的目的。SPE主要过程包括活化、上样、淋洗、洗脱,在很多国家或机构的标准方法中将固相萃取作为标准样品前处理技术,SPE也是用于复杂基质样品中抗生素富集浓缩的常规前处理方法。研究者们采用原子转移自由基聚合、溶胶-凝胶聚合、本体聚合、自由基聚合、表面印迹、纳米印迹技术制备了多种性能优异的球形、核壳、中空等结构的MIPs以及整体柱,用于选择性固相萃取食品[18,26-45]、土壤[22,46]、环境水样[47-50]、药剂[51,52]、农作物[53]样品中的抗生素。Shao等[29]以左氧氟沙星为模板,制备了MIPs整体柱,结合HPLC-MS,检测婴儿配方粉中6种氟喹诺酮类抗生素,得到回收率为82.91%~102.00%,检出限和定量限分别为0.19~1.24 μg/kg和0.63~4.13 μg/kg。Lian等[47,49]先后制备了以环丙沙星为模板的MIPs和以氯霉素为模板的MIPs,研磨后用作SPE吸附剂,分别选择性富集萃取海水中的环丙沙星和氯霉素。Zhu等[22,46]采用离子液体作为功能单体制备MIPs,用于土壤中磺胺类抗生素的萃取分离。Song等[34]通过计算模拟筛选出两种合适的虚拟模板分子,制备出能够同时识别8种氟喹诺酮和8种磺胺的MIPs,同时制备并优化SPE柱,结合超高效液相色谱检测鸡肉和猪肉中16种抗生素,得到回收率为92%~99%,检出限为1.0~3.4 ng/g。其他研究者也报道了基于MIPs的可选择性富集萃取食品、环境等样品中抗生素的SPE方法(见表1)。
2.2 MIPs在分散固相萃取中的应用
分散固相萃取是在传统SPE的基础上发展而来的新型样品前处理技术,与SPE的原理基本相同,是利用固体吸附剂对液体试样中各组分的吸附力差异而实现待测组分和干扰组分分离的技术。DSPE无需淋洗,萃取时间更短,吸附剂能充分分散到样品溶液中从而有效增大接触面积,净化后的样品经过振荡离心后,上清液可直接或经过简单处理后进入下一分析步骤中,是一种快速、简单、高效、试剂消耗少的前处理技术。Chen等[54]采用非共价分子印迹方法,制备了氧化石墨烯官能化的头孢羟氨苄MIPs,用于分散固相萃取,结合超高效液相色谱-二极管阵列检测(UPLC-DAD),得到检出限为0.01 μg/mL。Ji等[55]以螺旋霉素为模板分子,以介孔分子筛MCM-41为支撑材料,制备中空多孔MIPs,用于DSPE蜂蜜中7种大环内酯类抗生素,结合HPLC-MS/MS测定,得到回收率为88.0%~117%,检出限为3~17 ng/kg。Rozaini等[19]以磺胺甲恶唑为模板分子制备MIPs混合基质膜,用于萃取富集3种磺胺类抗生素化合物,结合HPLC-DAD,得到回收率为80%~96%,检出限为0.06~0.17 μg/L,定量限为0.20~0.56 μg/L。也有研究者通过在聚偏氟乙烯(PVDF)等膜上固载氯莫西林MIPs[56]或替考拉宁MIPs[57]制备MIPs膜,用于选择性富集分离抗生素。

2.3 MIPs在磁固相萃取中的应用
磁固相萃取是基于磁性微球材料的新型样品前处理技术,在磁固相萃取过程中,不需要装填萃取柱,而是将磁性吸附剂添加到样品的溶液或悬浮液中,使吸附剂能充分分散到样品溶液中,目标分析物被吸附到分散的磁性吸附剂表面,通过施加外部磁场,使目标分析物与样品基质分离开来。MSPE仅通过施加一个外部磁场即可实现相分离,可以在短时间内分离大体积样品中的痕量物质,目标分析物与吸附基质的接触面积大大增加,磁性吸附剂经适当的溶剂解吸后可以循环使用,且在处理复杂的环境样品时不会存在传统固相萃取中常遇到的柱堵塞问题。本课题组先后采用可逆加成-断裂链转移聚合、溶胶-凝胶聚合技术,制备Fe3O4为核的磁响应[58]、磁/温双响应[59]、磁/光双响应[60]的MIPs,并用于海水、土壤、食物等样品的前处理。目前,以Fe3O4纳米球为核制备磁性MIPs用于MSPE的报道最为常见[61-73],如Peng等[61]通过在羧基官能化的Fe3O4@多面体低聚硅倍半氧烷(POSS)表面构建四环素MIPs用作MSPE吸附剂,从牛奶中富集四环素类抗生素,结合HPLC-UV,得到回收率为86.2%~105.7%,检出限为2.23~26.84 ng/mL。孙佳佳等[66]以Fe3O4纳米球为核,以螺旋霉素为模板,制备MIPs磁性纳米吸附剂用于富集4种大环内酯类抗生素,结合HPLC-UV,得到回收率为80.78%~123.02%,检出限为0.53~2.75 μg/L,定量限为1.78~9.16 μg/L。
2.4 MIPs在基质固相分散萃取中的应用
基质固相分散萃取是将固相吸附材料直接添加到样品基质中,机械混匀后得到半干状态的混合物,并将得到的混合物作为填料装柱,然后用少量试剂清洗柱子去除杂质,最后用少量洗脱剂将目标物洗脱下来。该技术集样品破碎、提取、净化于一体,可从同一样品中选择性洗脱单一化合物或几类化合物,既避免了样品损失,消除了基质干扰,又减少了试剂的使用量,操作简便快捷,适于自动化分析。Wang等[74]将吡哌酸、磺胺苯甲酰胺、四环素作为混合模板,制备同时识别8种氟喹诺酮、8种磺胺和4种四环素的MIPs,并开发了基于该MIPs的MSPD前处理方法,结合超高效液相色谱法检测猪肉中该20种抗生素,得到回收率为74.5%~102.7%,检出限为0.5~3.0 ng/g。Wang等[75]使用金属有机骨架作为载体材料,四环素作为模板分子,3-氨基苯硼酸作为功能单体和交联剂,制备能够选择性识别奶粉中四环素的MIPs,并将该MIPs用于MSPD,结合UPLC-MS/MS,得到回收率为84.7%~93.9%,检出限为0.217~0.318 ng/g。
2.5 MIPs在固相微萃取中的应用
固相微萃取是通过涂覆固定相的萃取纤维来吸附、富集样品中的目标物,是可同时进行样品采集、萃取、富集浓缩、进样的微型化前处理技术。SPME的萃取过程主要包括吸附和解吸两步。首先,将SPME萃取头插入样品瓶,释放出萃取纤维于待测液中吸附目标物;当目标物在样品溶液和纤维涂覆的涂层中达到分配平衡后,将萃取纤维收回至SPME装置,取出待用。在色谱检测进样时,可通过热脱附或溶剂脱附,将吸附组分从萃取纤维中解吸下来而后检测。李攻科课题组[76,77]制备了一系列固载MIPs涂层的SPME纤维,用于四环素、雌激素等的选择性萃取。Barahona等[78]以恩诺沙星为模板,在聚丙烯中空纤维(HF)的孔中构建MIPs,并将该MIPs-HF膜用于SPME,以富集地表水、地下水和尿液中的诺氟沙星、环丙沙星、达氟沙星、恩诺沙星,结合HPLC-MS/MS,得到检出限为0.1~10 μg/L。Mirzajani等[79]以环丙沙星为模板,在不锈钢丝上制备MIPs,并将其用于SPME血浆、血清和药物样品中的环丙沙星、氧氟沙星、诺氟沙星和左氧氟沙星,结合HPLC-UV,得到检出限为0.023~0.033 μg/L。Liu等[80]以罗红霉素为模板分子,在木尖表面修饰MIPs涂层,发展了一种SPME,并将其用于富集饮用水、蜂蜜和牛奶样品中的5种大环内酯类抗生素,结合电喷雾电离-质谱(ESI-MS)分析,检出限分别为0.003~0.05、1.1~5.1和1.9~15.8 ng/g,回收率为73.4%~98.1%,标准偏差不高于8.6%。
2.6 MIPs在搅拌棒吸附萃取中的应用
搅拌棒吸附萃取是一种新型的固相微萃取样品前处理技术,是在内封磁芯的玻璃管上涂覆萃取吸附涂层,目标物在样品基质和搅拌棒表面涂覆的涂层之间达到分配平衡后,利用热脱附或溶剂脱附技术解吸后进样分析。相对于SPME, SBSE的固定相面积大,萃取容量高,在自身搅拌的同时进行萃取富集。目前,聚二甲基硅烷(PDMS)被广泛用于商品化SBSE涂层,其种类单一,选择性不高,MIPs的引入拓宽了其应用范围。李攻科课题组[81,82]制备了一系列MIPs涂层的萃取搅拌棒,并将其成功应用于选择性萃取富集复杂基质样品中的磺胺类抗生素、农药等。Yang等[83]以二氟沙星和氧氟沙星为模板分子,制备了能够识别9种氟喹诺酮抗生素的双模板MIPs涂覆的搅拌棒,结合HPLC测定肉中9种抗生素,该搅拌棒具有高浓缩因子(33~47倍)、高捕获能力(4 640~4 950 ng)和高回收率(>90%),检出限为0.1~0.3 ng/g。Tang等[84]在玻璃棒表面原位聚合制备了氨基脲MIPs涂层,而后将该搅拌棒用于SBSE鱼肉中的氨基脲,结合HPLC-UV,得到检出限为0.59 ng/mL。
3 抗生素MIPs萃取材料的制备新策略
MIPs作为固相萃取吸附剂,在消除基质干扰、选择性富集检测痕量抗生素方面发挥了重要作用。为进一步提高萃取效率,制备吸附量更大、选择性更高、亲水性更好、便于分离的MIPs,就需要引入新的印迹制备策略,如多模板、多功能单体、虚拟模板、刺激(磁、温度等)响应、亲水性等策略,并探索多种印迹策略的合理有效、协同组合方式。
3.1 多模板印迹策略
多模板印迹策略以多种分子同时为模板制备多模板MIPs,使其含有多种模板分子的识别位点,由于MIPs的结合位点和识别能力扩大,可以实现多种物质的同时识别、富集和分离,大大节省了时间和提高MIPs的利用效率,在复杂样品多残留、高通量分析中应用潜力巨大[12]。

图 2 (a)多模板、(b)虚拟模板、(c)磁响应和(d)温度响应MIPs的制备过程示意图Fig. 2 Schematic illustration for preparation of (a) multi-template[88], (b) dummy template, (c) magnetic-responsive and (d) thermo-responsive MIPs MAA: methacrylic acid; EGDMA: ethylene glycol dimethacrylate; AIBN: 2,2-azo-bis-isobutyronitrile.
本课题组采用多模板印迹策略,先后制备出以6种酚类化合物为模板的MIPs[85]、16种PAHs为模板的MIPs[86]和3种维他命B为模板的MIPs[87],并分别应用于海水、工业废水、饮料等实际样品前处理中。Lu等[88]以诺氟沙星和恩诺沙星为模板分子,通过沉淀聚合制备双模板MIPs(dt-MIPs),如图2a所示,将其用于DSPE湖水、河水和海水中的诺氟沙星和恩诺沙星,结合HPLC-UV,得到诺氟沙星的检出限和定量限分别为0.22 μg/L和0.67 μg/L,恩诺沙星的检出限和定量限分别为0.36 μg/L和0.98 μg/L,回收率为80.9%~101.0%。王建平课题组采用多模板印迹策略制备出能够识别9种氟喹诺酮抗生素的dt-MIPs[83],8种氟喹诺酮与8种磺酰胺MIPs的dt-MIPs[34],以及8种氟喹诺酮、8种磺胺和4种四环素的三模板MIPs[74],将以上3种MIPs分别作为固相吸附剂,对猪肉和鸡肉中的多类抗生素进行同时分离富集。Xie等[89]以红霉素、四环素和氯霉素为模板制备了三模板MIPs用作SPE填料,结合HPLC,同时高选择测定了牛奶中的该3种抗生素残留。Kechagia等[90]以6种磺胺类抗生素的混合物为模板,采用一锅法合成多模板MIPs,将其作为SPE吸附剂并结合HPLC-DAD实现了对牛奶中该6种抗生素的同时高效识别、萃取和检测。Ma等[91]以环丙沙星和左氧氟沙星混合为模板,1-乙烯基-3-乙基咪唑溴化物为功能单体,氧化石墨烯为核心材料,制备了分子印迹SPE整体柱,结合HPLC测定了人尿液中的环丙沙星和左氧氟沙星。
3.2 多功能单体印迹策略
多功能单体印迹策略是利用两个或两个以上功能单体与模板分子不同识别位点作用,充分发挥多种功能单体的协同优势,增加MIPs的识别位点数量,增强MIPs的选择性和富集能力,实现多种抗生素的同时识别与富集,此策略适用于高分离度要求的样品的分析。本课题组利用明胶、壳聚糖、8-羟基喹啉3种功能单体中丰富的官能团形成多作用位点来结合目标离子,制得铜离子印迹聚合物[92];使用甲基丙烯酸和4-乙烯基吡啶为功能单体,制得铅离子印迹聚合物,具有良好印迹性能[93]。Li等[94]以甲基丙烯酸和丙烯酰胺为双功能单体,制备氯霉素MIPs用于富集萃取猪肉和蜂蜜中的氯霉素。Xu等[95]以牛血清和多巴胺为双功能单体,制备了四环素MIPs,用于从牛奶样品中直接选择性地分离四环素。此外,传统聚合功能单体与温敏性单体结合,可以制备温度响应型MIPs。
3.3 虚拟模板印迹策略
虚拟模板印迹策略是以与目标分子结构、大小、形状等类似的分子为模板分子制备MIPs,一方面可减少模板的泄漏对检测结果的干扰,另一方面可根据一类目标分子的共有结构选择合适的虚拟模板对一些具有共同结构的物质进行选择性富集、分离和测定。此策略适用于溶解度过低、价格昂贵、有毒有害、易燃易爆等不适宜直接作模板的物质的检测,图2b显示的是采用虚拟模板印迹策略制备MIPs的基本过程。本课题组[96]以三硝基苯酚为虚拟模板,采用溶胶-凝胶聚合制备MIPs,并将其用于土壤样品中三硝基甲苯炸药的高灵敏检测。付珍珍等[97]以盐酸强力霉素为虚拟模板合成四环素类MIPs,并将其作为填料制备SPE柱,结合HPLC检测牛奶中的四环素、土霉素和金霉素。Song等[98,99]分别以泰拉霉素、泰乐菌素为虚拟模板合成MIPs,用于分离富集猪肉或环境水样中的多种大环内酯类抗生素。Meng等[100]使用绿色溶剂的低共熔溶剂(DES)作为致孔剂,以加替沙星为虚拟模板制备MIPs,结合UPLC测定人血浆中的左氧氟沙星,检出限和定量限分别为0.012 μg/mL和0.04 μg/mL。
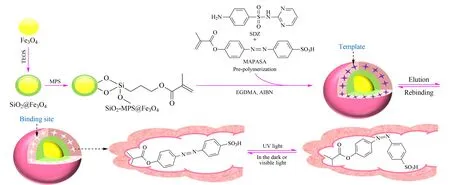
图 3 光/磁双响应MIPs的制备过程示意图[105]Fig. 3 Schematic illustration for the preparation of photo-responsive magnetic MIPs[105] TEOS: tetraethoxysilane; MPS: 3-methacryloxypropyltrimethoxysilane; MAPASA: 4-[(4-methacryloyloxy) phenylazo] benzenesulfonic acid.
3.4 刺激响应策略
刺激响应策略是通过构建对外界刺激有规律性响应的MIPs,以实现对目标分子特异控释的智能化控制方法。这种策略的优势在于打破原有响应模式,以外界刺激作为MIPs的智能识别条件,主要包括磁响应、温度响应、光响应及pH响应。磁响应和温度响应是抗生素MIPs的最常见响应方式。
磁响应MIPs的制备,通常是在磁性材料(如Fe3O4纳米球)表面制备MIPs层,该MIPs具有较大的比表面积,可有效解决传统方法制备的MIPs结合容量低、模板分子难以洗脱等问题;具有磁性的MIPs可在外界磁场作用下进行定向移动,磁响应MIPs通常与MSPE相结合,实现复杂基质中目标物的快速萃取、分离。其中,Fe3O4纳米球是最常用的磁性载体(内核),利用其制备Fe3O4@MIPs微球(见图2c),用作MSPE吸附材料,从食品、环境等样品中快速和选择性地富集抗生素[61-73]。利用其他磁性材料为载体制备磁性MIPs也屡见报道[101-103],如Hu等[101]以氧氟沙星为模板分子,在磁性羧化纤维素纳米晶体(M-CCN)表面构建MIPs层,并将该M-CCN@MIPs应用于河水中7种氟喹诺酮类抗生素的萃取。
温度响应MIPs的制备通常是在聚合体系中引入温度敏感型功能单体(如N-异丙基丙烯酰胺)。温度响应MIPs既带有疏水基团又带有亲水基团,在低温时,聚合物链上的亲水部分与水分子之间形成的氢键作用占主导地位,提高了该聚合物在水中的溶解性能;当温度高于低临界溶解温度时,氢键被破坏,疏水作用增大,高分子链聚集,凝胶网络收缩,溶胀率急剧下降,从而达到通过温度升降来实现目标分子的可逆识别与萃取的目的,并能够调节聚合物的水溶性,基本制备过程见图2d。Huang等[104]在硅球表面通过温度敏感单体N-异丙基丙烯酰胺制备磺胺二甲嘧啶MIPs。
光响应MIPs的制备,是在MIPs中引入光敏基团,利用光照变化引起光敏基团结构、极性等变化,从而引起整个MIPs形态的变化,以达到控释模板分子的目的,避免了大量洗脱剂的使用,实现了简单快速的MIPs循环使用。Chen等[105]以磺胺嘧啶为模板分子,亲水性的4-[(4-甲基丙烯酰氧基)苯偶氮]苯磺酸(MAPASA)为功能单体,以Fe3O4为核,制备了光/磁双响应印迹微球,用作MSPE吸附剂,实现光控下对环境水样中4种磺胺类抗生素的选择性萃取(见图3),方法简单、快速、经济、环保。
3.5 亲水性印迹策略
亲水性印迹策略是通过不受水干扰的作用(如金属螯合作用力、π-π偶极作用、疏水作用等),引入带有亲水性基团的功能单体或MIPs表面接枝亲水刷等方式制备MIPs,大大提高了MIPs在水相中的识别能力。Zhu等[106]通过以含有亲水基团的1-烯丙基-3-乙烯基咪唑氯化物离子液体和2-羟乙基甲基丙烯酸酯(HEMA)为功能单体,在水中合成了具有良好水相容性的环丙沙星MIPs,将其用于湖水、河水、土壤、猪肉样品的固相萃取。Zhao等[107]利用可逆加成断裂链转移与回流沉淀聚合接枝亲水性刷,制备了水相容性磺胺嘧啶MIPs,用于固相萃取,结合HPLC-MS/MS测定了动物源性食品和水样中6种磺胺类抗生素。
4 结论与展望
本文简要介绍了MIPs的制备方法与挑战,重点综述了抗生素MIPs的固相萃取应用及印迹新策略。通过总结这些研究,发现其主要的创新性集中于抗生素MIPs的合成方法和印迹策略的选择,以及样品前处理技术的模式选择和条件优化。印迹新策略的发展,尤其是多种印迹策略的组合使用,可有效解决传统MIPs结合容量低、模板泄漏干扰检测、水相识别困难等问题,从而制备出性能更为优异、易分离、智能控释的MIPs作为固相吸附剂,可为复杂样品的前处理提供良好的技术支撑,可为消除基质干扰、高选择性富集痕量抗生素奠定坚实基础。同时,也应该指出,多模板MIPs虽然适于多残留、高通量分析,但是如何巧妙组合多种不同的模板分子以获得对多种目标物最优的选择性,仍然是难点和发展方向。如何巧妙设计合成专一性功能单体,如何组合多种功能单体以提高MIPs选择性,如何选择合适的虚拟模板,如何巧妙组合各种印迹策略并获得最佳的协同效应,都是MIPs合成的发展方向。此外,为了响应绿色可持续发展的号召,需要进一步发展高效、智能、绿色环保的MIPs,并对目前的样品前处理技术进行改良,实现微型化、快速、准确和高选择性地萃取复杂基质中的目标分析物。而且,MIPs在SPE中的应用较为普遍,而在MSPD、SPME和SBSE中的应用研究还不十分深入,这就对丰富和扩大MIPs在样品前处理的应用提出了新的挑战。

