低频强声驱散样机对静音室内实验动物的损伤效应观察
段朝霞,李冠桦,张东冬,翁昌梅,陈魁君,张洁元,张良潮,陈志强,谢秀娟,王建民
低频强声又称高强度低频噪音,一般是指频率在20~1000 Hz,声压级>140 dB的声源。声源对人体的危害及影响主要是取决于声源的频率、强度及作用的距离。长期以来,有关声音对生物体影响的大部分研究都局限于低强度的环境声,其声压级一般在90 dB(A)以下。随着现代社会中强声出现的次数日益增多,以及强声危害日益受到重视,有关强声特性及其应用的研究成了当下的研究热点。研究表明,当人体暴露到强声中,可能会出现的物理危害有以下几种情况:暴露到声压级为90~120 dB(A)的低频声(5~200 Hz)1 min就会产生极度的烦躁和心烦意乱感;110~130 dB(A)的次声将引起肠道疼痛和严重恶心;当声压级达到140~150 dB(A)时就会产生巨大的身体创伤和组织损伤;>170 dB(A)的声音会产生瞬时冲击波型的创伤[1-5]。
近年来,声学装备以其独特的性能受到越来越多国家的重视。怎样合理有效地使用声学装备,是研究和开发声学装备的关键。由于声学装备具有非致命性、可控性强、无二次污染等一系列优点,使其成为在不对人体造成物理损伤的前提下驱散人群、控制人群的一种有效手段。怎样在不造成人群物理损伤内行的前提下达到最优的人群控制效果,就是低频强声驱散样机研制者们的主要目的。为了解中科院理化技术研究所自制低频强声驱散样机(75~85 Hz)在不同声强(108~141.5 dB)情况下的安全性和有效性,本研究拟通过不同强度的低频强声对不同实验动物(山羊、巴马小香猪和大鼠)损伤效应特点研究,明确低频强声驱散样机的安全性和有效性,为低频强声驱散器的定型与使用安全,也为制定该类伤员的诊断、救治、防护措施提供依据。
1 实验材料与方法
1.1实验场地一般情况 实验场地位于中国人民解放军陆军特色医学中心(原陆军军医大学第三附属医院野战外科研究所)静音室,实验场地温度20℃,地面干燥。
1.2实验动物布放及致伤 实验共用重庆当地山羊6只,体重32~36 kg,雌雄各半;巴马小香猪4只,体重25~30 kg,雌雄各半;陆军特色医学动物中心SD大鼠40只,雌雄各半,体重200~250 g。实验分两阶段,共8次实验。第一阶段:低声强段(108 dB和130 dB的声强,2018年3月完成,共做3次实验,用大鼠20只,山羊2只);第二阶段:高声强段(138 dB和141.5 dB的声强,2019年4月完成,共做5次实验,用大鼠20只,山羊4只,巴马小香猪4只)。第一阶段第一次和第二次实验仅用大鼠,每次10只(其中5只做诱发电位重复使用);第三次实验用10只SD大鼠和1只山羊同时致伤(由于第三次实验10 min后仪器损坏,剩余的5只大鼠和1只山羊未做致伤对照)。第二阶段第一、二、三次实验用山羊和巴马小香猪各1只,SD大鼠10只(包括5只做诱发电位的大鼠),第四次实验仅用1只山羊,第五次实验仅用1只巴马小香猪。实验动物分别放在不同笼内,以最近距离,不同声强(108、130、138、141.5 dB)持续时间30 min。
1.3声强检测 实验过程中的声强检测由中科院理化技术研究所采用专用的声强检测仪检测,声强检测非实时检测,驱散器声强稳定后测试声强,然后记录致伤时间。
1.4心电图检测 为检查驱散样机的安全性和有效性以及实验前后对实验动物的心脏损伤情况,实验大动物(山羊和巴马小香猪)在致伤前,在上下肢体部皮肤去毛,将实时心电图导联电极片置于皮肤表面,并将电极用透明胶粘牢,露出导联线,采用清心L8便携式心电监护仪,实时监测实验动物伤前正常及伤后心电图变化。SD大鼠用生理检测仪器:MFE便携式脑电记录仪,福田720型6导心电图机,听觉脑干诱发电位仪。
1.5大体观察与病理解剖 实验中所有大动物(山羊和巴马小香猪)分别在致伤后3 h解剖观察;大鼠在实验后1周解剖。检查组织损伤程度和范围;疑有损伤处取材固定,镜下观察显微结构变化。大体解剖程序为:体表、四肢软组织、骨骼;脊柱;听器(鼓膜穿孔面积、听小骨是否完整);眼(角膜、前房、虹膜、玻璃体、视网膜);颅脑出血部位、面积,软脑膜充血程度;胸壁、肋骨完整性,胸腔积血、积液量;咽喉、气管、肺脏出血或烟尘异物黏附面积、部位;心外膜、内膜出血面积;腹腔实质脏器(肝、脾、肾)有无破裂,包膜下出血范围与量;腹腔空腔脏器(胃、小肠、结肠)黏膜出血、穿孔大小、范围。低频强声驱散样机对耳鼓膜的损伤效应观察:锯开颅骨,打开内耳听泡,观察耳鼓膜破裂、出血及听骨链完整情况。
1.6生化指标检测 SD大鼠于致伤后不同时间解剖时从心脏取血。血生化:血清肌酸激酶(CK)、乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、肌酐(CREA)、尿素(BUN)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)采用日本SP-4430型干式生化分析仪检测;血清神经元特异性烯醇酶(NSE)、肌钙蛋白(cTn-T)、血管生成因子1(AGGF1)、醋酸纤维(CA)、皮质醇(Corisol)和中枢神经特异性蛋白(S-100β)用酶联免疫吸附实验检测。其中AST、ALT主要反映肝脏损伤严重度;CREA、BUN主要反映肾脏损伤严重度;NSE、S100β主要反映脑损伤严重度;GLU、CK、LDH、cTn-T、AGGF1、CA、Corisol主要反映应激反应及广泛性肌肉组织损伤严重度。第一阶段的生化检测部分由重庆巴尔思生物科技公司完成,第二阶段的生化检测部分由中国人民解放军陆军特色医学中心检验科完成。
2 结果
2.1实验动物损伤情况 本实验通过在静音室内用中科院理化技术研究所自制低频强声驱散样机(75~85 Hz)在不同声强(108、130、138、141.5 dB)情况下作用于不同实验动物(大鼠、巴马小香猪、山羊),以观察中科院理化所自制低频强声驱散样机使用的有效性和安全性。声强≤130 dB的实验共做了3次,第1次出口处的声强为120 dB,铁笼处的声强为108 dB,持续30 min;第2次铁笼处的声强为130 dB,持续30 min;第3次铁笼处的声强为130 dB,持续10 min(仪器坏掉)。实验结果显示:实验大鼠和山羊在初次听到声音时,并未表现出惊慌、乱窜、停止吃食等受到惊吓的表现,但20 min后,笼内的大鼠都挤在一起;心脑、听阈检测也未发现异常;大体解剖后,大鼠和山羊心、肺、肝、肾、大脑、鼓膜均未发现异常;大鼠行为学检查及病理解剖均未发现异常。
声强138 dB和141.5 dB的实验共做了5次,分别将1只山羊、1只巴马小香猪和9只SD大鼠放在不同笼内,强声驱散器以最近距离作用于实验动物,驱散器出口处的声强第1次为138 dB,其余4次均为141.5 dB。实验结果显示:实验大鼠、巴马小香猪和山羊在初次听到声音时,并未表现出惊慌、乱窜、停止吃食等受到惊吓的表现,但20 min后,笼内的大鼠都挤在一起;心脑、听阈检测也未发现异常;大体解剖后发现:138 dB和141.5 dB的声强作用于实验动物后,有3只巴马小香猪的心或肺出现点状出血的轻度损伤;2只山羊肝或肺出现了点状出血的轻度损伤,其余动物肺、肝、肾、胃肠、鼓膜、脑均正常;第一次实验的羊解剖后心、肺、肝、肾、胃肠、鼓膜、脑均正常,巴马小香猪解剖后发现左心室二尖瓣上有一个0.1 cm×0.1 cm的点状出血。第二次实验的巴马小香猪解剖后左肺下叶上缘有一个0.1 cm×0.1 cm的点状出血,其余心、肝、肾、胃肠、鼓膜、脑均正常;第二次实验的羊解剖后发现左肝下叶有十几个散在的点状出血点,大小为0.1 cm×0.1 cm,左侧鼓膜充血;其余动物心、肺、肾、胃肠、脑均正常。第三次实验的巴马小香猪解剖后发现心、肺、肝、肾、胃肠、鼓膜、脑均正常;第三次实验的羊解剖后发现心、肺、肝、肾、胃肠、鼓膜、脑均正常。第四次实验的巴马小香猪解剖后发现左肺中叶有一个0.1 cm×0.1 cm的点状出血,左肺上叶背侧有一个0.3 cm×0.1 cm的肺大泡,左肺下叶背侧有一个0.1 cm×0.1 cm的点状出血,其余动物心、肝、肾、胃肠、鼓膜、脑均正常。第五次实验的羊解剖后发现左肺上叶背侧有一个0.3 cm×0.2 cm的肺大泡,右肺下叶腹侧有4个0.1 cm×0.1 cm的点状出血,其余动物心、肝、肾、胃肠、鼓膜、脑均正常。
2.2实验动物损伤的生理功能变化 大鼠用生理检测仪器:MFE便携式脑电记录仪,福田720型6导心电图机,听力诱发电位仪。动物心电图检查均为窦性心律,正常心电图,致伤后实验动物仅有心率不同程度加快或变化不大,未出现明显ST段抬高改变,表明不同强度的低频强声对静音室内实验动物未引起明显的心脏损伤。听力诱发电位结果显示,暴露30 min后,108、130、138、141.5 dB的声强均不引起SD大鼠听力阈改变。
2.3实验动物生化指标检测 各指标损伤后不同时间比较差异均无统计学意义(P>0.05)。见表1。
2.4实验动物行为学指标检测 SD大鼠在不同强度的强声致伤后在Morris水迷宫内寻找平台逃避潜伏期、空间探索实验时在第Ⅲ象限游动时间和穿越原平台位置次数与致伤前比较差异无统计学意义(P>0.05)。见表2、3。
3 讨论
声波装备是新概念致伤装置中发明较晚、发展比较稳健、杀伤机制比较清楚的一类非致命性装备,但目前尚无安全有效便携的非致命声波装备。按照产生声波频率的不同,一般将声波武器分为次声波装备、强噪声装备和超声波装备。次声波装备是通过发射<20 Hz的次声波,与人体生理系统发生共振,使目标神经错乱、全身不适,从而失去战斗力;强噪音装备可发射高达150 dB的强大脉冲声波,使目标听觉器官暂时致聋,产生头晕目眩、恶心,失去自我控制能力和定向能力,从而逃离作用区域;超声波装备是利用高能超声波发生器发出频率>20 000 Hz声波,产生强大的空气压力,引起视觉模糊、恶心等生理反应,从而造成人员战斗力减弱或完全丧失。目前,研究最多、最明确的是次声装备,但近年来噪音装备也逐渐受人关注,尤其是利用低频强噪音(强声)制备的低频强声定向驱散样机。
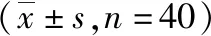
表1 定向强声驱散样机实验大鼠伤后不同时间生化指标检测结果
注:cTn-T为肌钙蛋白,AGGF1为血管生成因子1,CA为醋酸纤维,Corisol为皮质醇,NSE为血清神经元特异性烯醇化酶,S-100β为中枢神经特异性蛋白,ALT为丙氨酸转氨酶,AST为天冬氨酸转氨酶,CREA为肌酐,CK-MB为肌酸激酶同工酶,LDH为乳酸脱氢酶,BUN为尿素,CK为肌酸激酶
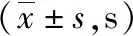
表2 大鼠致伤前后水迷宫定位航行实验逃避潜伏期结果
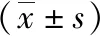
表3 大鼠致伤前后水迷宫空间探索实验结果
强声一般是指频率在20~1000 Hz,声压级>140 dB的声源。声源对人体的危害及影响主要是取决于声源的频率、强度及作用的距离。人体各器官的固有频率为3~17 Hz,头部的固有频率为8~12 Hz,腹部内脏的固有频率为4~6 Hz,次声波非致命武器就是选择人体敏感的声波频率4~8 Hz作用目标;对于脉冲噪音,人耳对不同频率的声音感受的强度不同,根据等响曲线,对2~5 kHz频率的声音最敏感,所以声波定向驱散器一般选择人耳最为敏感的频段作为攻击声,远距离声音定向驱散装置的发射频率为2100~3100 Hz,可以达到很好的驱散效果。
声音对机体的影响分为四个等级。一般声强<120 dB,对机体的影响是可恢复的;120~140 dB,经一定时间的声波冲击后,内耳就有可能遭受永久性损伤;140~150 dB,遭受刺激的人可能形成严重脑损伤;>150 dB时,听觉器官会发生鼓膜破裂出血、迷路出血、螺旋器从基底膜急性剥离,一次刺激就有可能使双耳完全失去听力。
据目前的文献报道,强声对机体的多个器官系统都有不同程度的影响或损害,但研究主要集中在耳、呼吸系统(肺)、消化系统(主要是肝、脾)及神经系统(脑);对机体的损伤效应又分为急性期效应和长期反复接触引起的损伤效应。目前的研究发现强声对人和动物造成的损伤主要是描述性的、暂时性的功能损伤,大体解剖很少发现有异常,病理染色发现部分脏器出现细胞水平的改变(50 Hz,142 dB可造成巴马香猪的听力阈值较暴露前明显升高;扫描电镜下可见内、外毛细胞静纤毛融合、散乱及缺失等改变[6];103或300 Hz 150 dB作用10 min,可造成大鼠不同程度的血管扩张、充血、淤血及组织水肿等改变[7];用100 Hz 140 dB低频强声,1 h/d,连续作用20 d,HE染色发现即刻的低频强声暴露对海马回细胞形态、分布和凋亡无影响,而较长时间(10~20 d)的低频强声暴露可导致海马回细胞数目减少,排列疏松、紊乱[8];陈超等[9]研究发现80~100 Hz的低频强声在160 dB时,可导致巴马小香猪在致伤过程中或致伤后2 h内死亡。
中科院自制驱散样机的频率为75~85 Hz,大鼠的心率>200/min,山羊的心率约100/min,更接近人的心率。因此,本研究采用大鼠、巴马小香猪和山羊做实验,以了解中科院理化技术研究所自制的低频强声驱散样机的不同声强对不同实验动物的损伤特点、致伤的靶器官及损伤阈值。研究结果表明,不同强度的低频强声作用于放于静音室内的实验动物30 min后,较高声强(138 dB和141.5 dB)作用后可引起部分脏器(心、肺、肝)的点状出血(轻微损伤),但未发现听阈、功能及行为学异常;<130 dB声强均未发现听阈、解剖、功能及行为学异常。提示该种低频强声驱散样机在不同声强(108~141.5 dB)情况下仅会引起实验动物主要脏器的点状出血。
本研究通过对中科院理化技术研究所自制的低频强声驱散样机的不同声强对不同实验动物(大鼠、巴马小香猪和山羊)的损伤效应评估,了解了该低频强声驱散样机对生物的损伤特点、致伤的靶器官,可得出以下结论:①声强在141.5 dB时可引起部分大动物(山羊和巴马小香猪)的轻微损伤,后续实验需要进一步确认损伤效果和损伤阈值。②该驱散样机的低频强声主要引起大动物的心、肝、肺等重要脏器损伤,对听觉器官损伤不明显。③该种低频强声驱散样机在不同声强(108~141.5 dB)情况下仅会引起实验动物主要脏器的点状出血,根据临床分析,脏器的点状出血可在1周左右吸收,不会引起脏器的不可逆性损伤,具有安全性;基于临床分析,主要脏器的点状出血可能会引起人员的不适,而使得该驱散样机具有潜在的驱散能力(有效性)。

