袁曙光研究团队揭示赛普霉素脱羧酶 CypD 的底物结合钳运动模式
中国科学院深圳先进技术研究院计算机辅助药物设计中心袁曙光研究团队主导的研究在 CypD 的分子识别过程取得进展。相应成果为“Liu L, Chan S, Mo TL, et al.Movements of the substrate-binding clamp of Cypemycin decarboxylase CypD [J].Journal of Chemical Information and Modeling, 2019, 59: 2924-2929(霉素脱羧酶 CypD 的底物结合钳的运动)”。
亲环蛋白 CypD 具有氨基脯氨酸顺反异构酶活性,能催化 Xaa-Pro 之间肽键的顺反异构反应(Xaa 表示任一氨基酸)。当与天然配体 CSA 结合时,CypD 的顺反异构酶活性将被抑制,且与ANT 的结合也会受阻,这影响 MPTP 的开放。以 CypD 为药物靶标设计筛选出的 CypD 抑制剂可用于受损时细胞凋亡及坏死的抑制、外周器官缺血/再灌注损伤的抑制等。由于 CypD 的活性口袋宽敞扁平,即使和大分子多肽配体 CSA 的结合也不能使其构象出现明显变化,故筛选相应小分子化合物抑制剂存在一定挑战。
该研究通过计算和生化分析相结合的方法对 CypD 的分子识别过程进行研究。结果显示,CypD 的底物结合钳经历剧烈的波动,介导底物进入催化口袋并从中释放。广泛的分子动力学模拟和傅里叶变换红外分析表明,底物的结合诱导了酶的实质性结构变化,将底物结合钳从无规环转变为包含两个β片和一个β转角的更有序结构(此结构更稳定)。其中,Arg159鸟嘌呤和底物的 Cys 羧酸盐之间的盐桥在介导底物结合中起重要作用,而疏水相互作用在此过程中也很重要。
该研究可为了解 CypD 和其他黄素依赖性半胱氨酸脱羧酶提供重要的机理见解,并可有助于含 AviCys 的 RiPPs 的未来生物合成和生物工程研究。
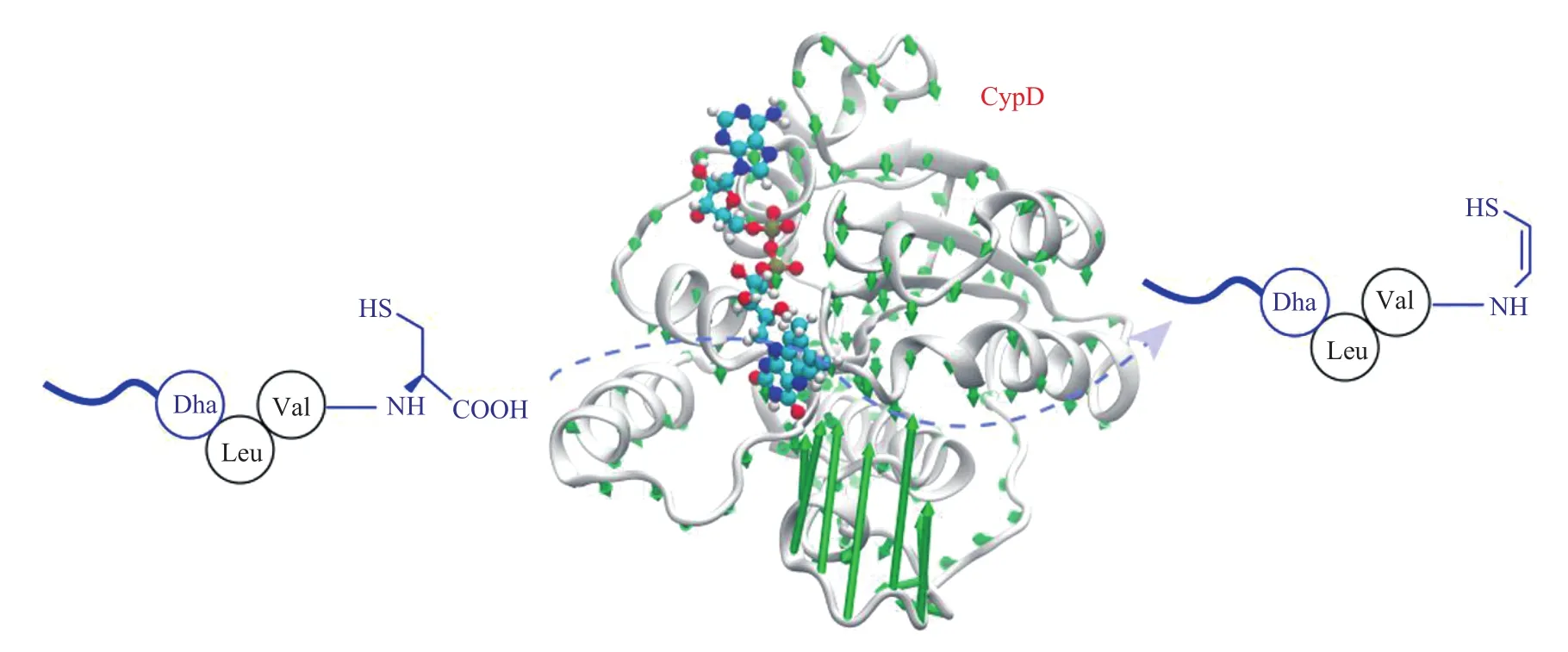
底物诱导的 CypD 二级结构变化

