子宫血管周上皮样细胞肿瘤七例误诊临床分析
戈 瑶,贾 妍,杨淑莉,崔满华
子宫血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor, PEComa)是一种少见的间叶来源肿瘤,子宫PEComa的生物学性质目前未明,有文献报道其存在恶性病变的风险,目前治疗方案仍以手术为主,辅助治疗方案效果尚待观察。本文回顾性分析我院2011年1月—2017年12月收治的7例子宫PEComa误诊患者临床资料,并结合相关文献,讨论子宫PEComa的临床表现、病理及免疫表型特点、诊断与鉴别诊断和治疗预后情况,旨在提高临床医师对本病的诊治水平。
1 临床资料
1.1一般资料 7例子宫PEComa患者,年龄20~66岁,中位年龄49岁,生育期1例,围绝经期4例,绝经期2例。入院原因多为下腹部不适、阴道异常出血、“子宫肿物”生长速度过快、腹部可触及包块、经量过多。除2例绝经期女性有高血压基础疾病外,余未见特殊基础疾病。
1.2临床表现 7例均无特异性临床表现,表现为下腹部不适4例、绝经后阴道出血2例,“子宫肿物”生长速度过快、腹部包块、经量过多各1例。术中可见肿瘤质地均较柔软、细腻,无包膜,2例伴有出血及坏死等改变,并可出现腹痛、腹部包块、盆腔积液、阴道出血等症状;5例肿瘤与周围组织界限清楚,但2例呈浸润性生长。7例术前均行妇科超声检查,且怀疑为子宫内膜病变及盆腔肿物者行肿瘤标志物癌抗原125及癌抗原19-9等检测均未见明显异常。临床表现及医技检查结果见表1。
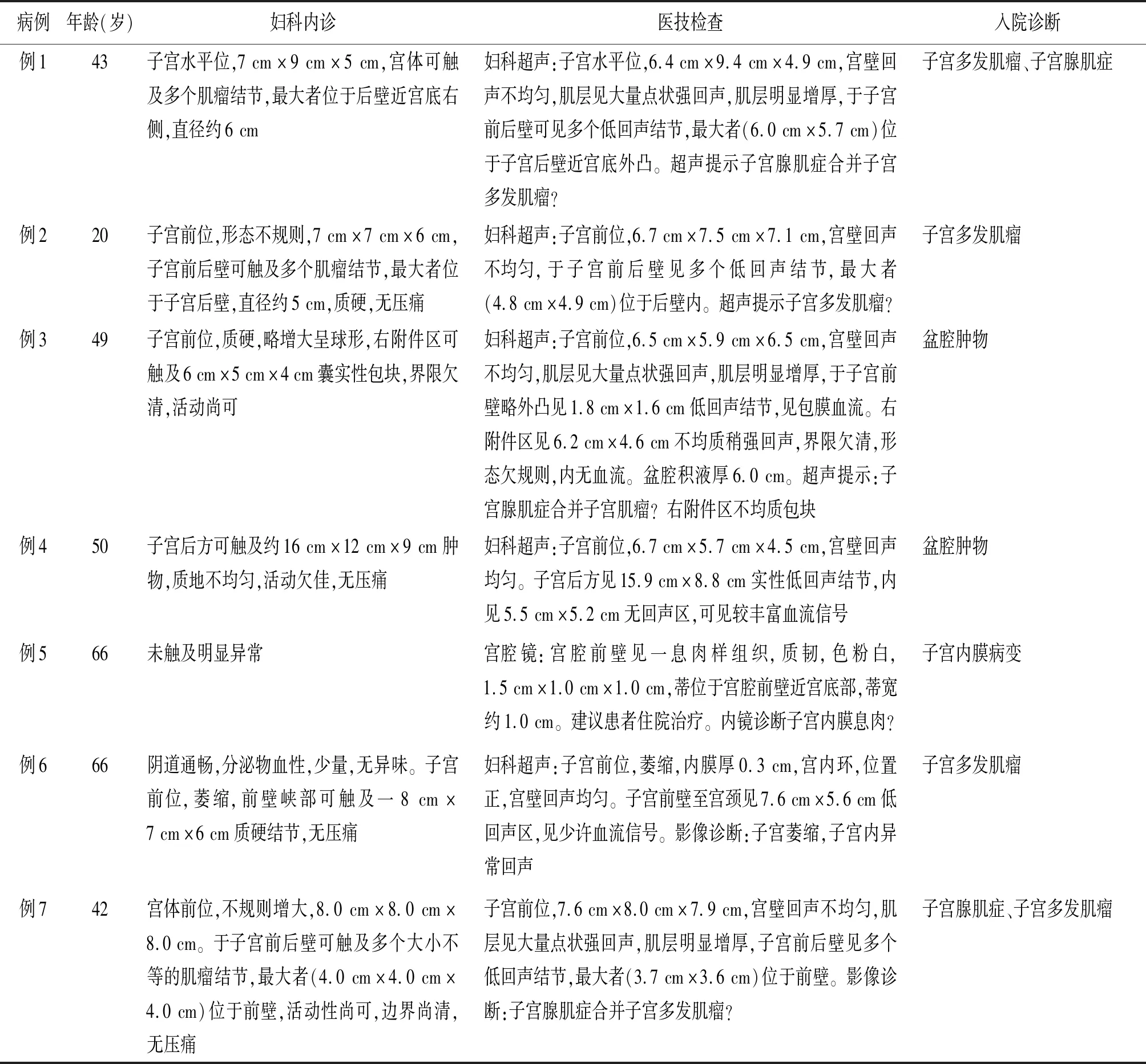
表1 子宫血管周上皮样细胞肿瘤7例临床特征
1.3误诊情况 7例术前均未诊断为子宫PEComa,诊断为子宫腺肌症合并子宫肌瘤2例、盆腔肿物及子宫肌瘤各2例、子宫内膜病变1例。2011~2013年每年分别误诊1例、1例、2例,误诊率0.30%、0.10%、0.09%;2015~2017年每年分别误诊1例,误诊率0.05%、0.11%、0.20%。
1.4确诊、治疗及预后 7例均行手术治疗,术中病理提示为恶性PEComa 3例,良性PEComa及潜在恶性PEComa各2例。2例良性子宫PEComa,予子宫全切除术及子宫病变切除术各1例;2例潜在恶性子宫PEComa,予子宫全切除术及子宫病变切除术各1例;3例恶性患者分别行全子宫+双侧附件切除+盆腔淋巴结清扫术、全子宫+双侧附件切除术、全子宫+双侧输卵管切除术。7例经术后病理及免疫组织化学染色(免疫组化)证实诊断,除1例因个人原因未行免疫组化外,余6例HMB45均阳性,其中2例局灶阳性;4例SMA、Desmin及H-Caldesmon阳性。7例免疫组化结果见表2,典型病理图片见图1。7例术后仅3例(恶性2例、潜在恶性1例)随访成功,此3例术前及术后均未行辅助治疗,随访17~76个月均未发生肿瘤复发及转移。

表2 子宫血管周上皮样细胞肿瘤7例免疫组织化学染色结果
2 讨论
2.1发展与认识 对于PEComa的认识,起初来源于肾和肝血管平滑肌脂肪瘤、肺透明细胞“糖”瘤及淋巴管平滑肌瘤病。PEComa最初是由Zamboni等[1]于1996年提出,定义为一个包括所有具有血管周上皮样细胞的病变集团。2001年世界卫生组织将PEComa定义为由血管周上皮样细胞组成的间叶性肿瘤,且在免疫表型和组织学上有鲜明的特点[2]。目前,PEComa肿瘤家族包括肝和肾血管平滑肌脂肪瘤、淋巴管肌瘤病、肺透明细胞“糖”瘤、肝镰状韧带/圆韧带透明细胞肌黑色素细胞瘤[3]以及发生于腹盆腔、消化道、泌尿生殖道、周围软组织和皮肤等部位的非特殊类型的PEComa。子宫是非特殊类型PEComa的最好发部位,大部分发生于子宫体部,少部分见于子宫颈部,但恶性者尤为少见[4]。
图1 子宫血管周上皮样细胞肿瘤患者典型病理图片(HE染色)
a.100倍镜下可见大量肿瘤细胞呈片状及巢状分布,细胞质丰富透亮,胞浆呈微嗜酸性,核小,呈圆形或椭圆形,可见小核仁;b.100倍镜下可见肿瘤细胞呈弥漫浸润分布,胞浆丰富,可见明显的网络状薄壁血管,间质为丰富的血窦;c.400倍镜下可见瘤细胞多围绕血管呈片状、巢状分布,部分区域可呈放射状分布,上皮样细胞多紧邻血管周围分布,类似平滑肌细胞的梭形细胞则离血管较远;d.200倍镜下可见视野内大面积出血及凝固性坏死分布
2.2临床及病理学特征 PEComa对于女性生殖系统而言,好发于子宫,常位于子宫体浆膜下及肌壁间,也有少数患者发生于宫颈及子宫黏膜下[5]。文献报道该病常单发,少数多发,直径多在4~30 cm。PEComa较易发生出血及破裂等情况,一旦破裂可导致腹腔内出血,出血量较多、出血速度较快时,甚至可出现失血性休克等症状。子宫PEComa患者年龄范围较广,但多为中年女性。本病常见症状为阴道出血、子宫占位、腹部包块、腹痛等[6-7],患者多因上述症状就诊,部分患者为手术及体检时偶然发现。患者入院后多初步诊断为子宫肌瘤,手术后病理结果常需免疫组化辅助才可确认为PEComa。我院收治的7例子宫PEComa中,4例初步诊断为子宫多发肌瘤,且其中2例合并子宫腺肌症;另有2例初步诊断为盆腔肿物,手术过程中发现肿物位于子宫体浆膜下,且直径均>5 cm,伴有出血或破溃等情况;1例初步诊断为子宫内膜病变,术中发现病变位于子宫黏膜下。本文7例发现时多为围绝经期,1例为生育期,部分为绝经期,与文献报道相符。
子宫PEComa并无典型的临床表现,诊断主要依赖病理免疫学检查。PEComa的病理大体特征为:肿瘤切面可呈灰白色、灰褐色、灰粉色、灰黄色或多色相间,边界多清楚,少数边界模糊,多无包膜,质地柔软且常较细腻;当肿瘤较大时常伴有出血、破溃、坏死、囊性变等;瘤体多数与周围组织界限清楚,但部分可见浸润性生长。镜下特征:瘤细胞常由巢状或片状上皮细胞构成,偶见血管壁含透明颗粒嗜酸性胞质的梭形细胞[8];细胞质丰富透亮,胞浆呈微嗜酸性,核小,呈圆形或椭圆形,可见小核仁,部分患者可见多核巨细胞和蜘蛛细胞;瘤细胞多围绕血管呈片状、巢状分布,部分区域可呈放射状分布,上皮样细胞多紧邻血管周围分布,类似平滑肌细胞的梭形细胞则离血管较远[9]。PEComa免疫学表现为特征性联合表达肌源性和黑色素生成标记,其中肌源性标记主要为SMA、Calponin、Desmin等,黑色素生成标记为HMB45、MelanA、MITF等;而其中黑色素生成标记阳性对于PEComa的诊断意义非凡。值得注意的是,HMB45在几乎所有的PEComa细胞中均阳性表达,但部分患者仅在单个细胞胞质中表达,由此就造成了部分患者漏诊。文献报道仅80%的病案显示HMB45与SMA均为阳性表达,因此若SMA表达阴性时并不能排除PEComa的诊断[10]。肌源性标记与黑色素生成标记表达情况并不完全一致,约80%的病例可出现双重表达[11]。本院收治的7例中除1例因个人原因未行免疫组化外,余6例HMB45均阳性表达,其中2例表现为局灶阳性;4例表现为SMA、Desmin及H-Caldesmon阳性,且存在平行关系。
2.3良恶性诊断标准 影像学检查对于妇科肿瘤的初步诊断通常有着至关重要的提示作用,然而对于子宫PEComa而言,影像学检查一般只能起到初步筛查作用,诊断意义不大。且子宫PEComa的临床表现不具备特征性,故常与子宫肌瘤、盆腔肿物、子宫内膜息肉等混淆。且大部分患者可依据术后病理检查确诊,术前诊断难度极高。相对而言,对于“肌瘤”短时间内迅速增长,绝经后阴道不规律出血,子宫浆膜下巨大肿物患者应引起警惕。同时,考虑到部分子宫PEComa具有恶性行为,易出现肺部、肝脏、骨远处转移[12]或并发淋巴结转移等情况,导致患者预后差、复发率高、远期生存率低等。因此,尽早诊断子宫PEComa,同时明确其是否具备恶性潜能,对于临床工作者及患者均极为重要。
然而,由于PEComa生物学行为的不确定性、发病率较低及缺乏大规模数据研究等因素,目前尚无统一的PEComa生物学诊断标准。当前较为公认的PEComa良恶性诊断标准为:良性:直径<5 cm,无浸润,核级不高,细胞不密集,核分裂象<1/50高倍视野,无坏死,无脉管侵犯。潜在恶性:仅有核多形性,或仅直径>5 cm。恶性PEComa符合以下2项以上条件:①直径>5 cm;②有浸润;③有高级别的核;④细胞密集;⑤核分裂象>1/50高倍视野;⑥有坏死;⑦有脉管侵犯[13]。近期,Schoolmeester等[14]应用统计学数据提出了新的诊断参考意见,即排除恶性PEComa应少于以下4个特征:①肿瘤直径≥5 cm;②呈浸润性生长;③存在凝固性坏死;④核异型性明显,核分裂象≥1/50高倍视野。同时Ki67对于判断PEComa的转移情况可能有参考意义,一般来说,Ki67阳性率>5%就有可能出现肿瘤转移[15]。对于子宫PEComa而言,病理检查结合免疫组化是其诊断金标准。
2.4鉴别诊断 由于子宫PEComa临床表现无特异性,因此病理检查结合免疫组化是鉴别PEComa与其他肿瘤的重要手段。一般情况下,子宫PEComa需与以下几种肿瘤鉴别:①上皮样平滑肌瘤:上皮样平滑肌瘤以上皮样细胞为主,约1/4为透明细胞,细胞呈圆形、梭形或多边形,胞浆呈嗜酸性;而PEComa细胞胞浆多透明或呈嗜酸性。更具有鉴别意义的是上皮样平滑肌瘤无网络状薄壁血管,HMB45常阴性表现,而SMA全部阳性表达。但文献报道个别上皮样平滑肌瘤HMB45可阳性表达,且肿瘤细胞数量较少[16]。②子宫内膜间质肉瘤:子宫内膜间质肉瘤HMB45几乎均阴性表达,但CD10呈弥散性强阳性表达,而PEComa CD10仅部分表达。值得注意的是,绝大多数子宫内膜间质肉瘤雌、孕激素受体均为阳性,而PEComa仅部分表达。③透明细胞肉瘤:透明细胞肉瘤细胞胞质透明或呈嗜酸性,呈巢状或束状排列,部分可见多核细胞,部分区域可见粗大的胶原纤维束,但其缺乏特殊的血管周上皮样细胞排列,HMB45、S-100均阳性表达,而PEComa中S-100几乎均阴性表达。④转移性恶性黑色素瘤:恶性黑色素瘤S-100几乎均为阳性表达,而SMA阴性表达;而PEComa中SMA一般为阳性表达,S-100阴性或极少阳性表达。
2.5误诊原因分析 本文7例误诊疾病为子宫肌瘤、子宫腺肌症、盆腔肿物、子宫内膜病变。误诊原因首先在于子宫PEComa并无诊断性临床特征,患者主要因肿瘤发生部位特殊、生长速度过快、肿瘤破溃等原因出现腹部可触及包块、月经量异常、剧烈腹痛、阴道不规律出血、下腹部不适等症状;其次,该病目前发病率极低,缺乏大规模数据统计,接诊医师对于超声、MRI、CT、肿瘤标志物等辅助检查项目缺乏准确的认识,无法为其术前诊断提供参考依据;第三,目前子宫PEComa的发病原因及机制尚未有统一定论,对于发病高危因素缺乏准确认知,无法准确判断高危人群;第四,子宫PEComa的诊断主要依据病理免疫组化结果,同时需经验丰富的病理科医师进行诊断,而根据该病特点,极少有医师会在术前行诊断性穿刺,故术前及术中确诊的可能性较低。
2.6治疗及预后 手术一般是子宫PEComa首选的治疗方案,手术方式包括单纯肿瘤病灶切除术、全子宫切除术、全子宫+双侧附件切除术等。值得注意的是,由于诊断的困难性,一般术中病理结果不能准确诊断PEComa,多数为怀疑诊断,因此一般多由手术医师依据临床经验并综合考虑患者年龄、生育要求、瘤体大小、瘤体与周围组织关系以及肿瘤是否存在破溃、坏死、出血等情况判断手术范围。由于妇科PEComa目前尚缺乏治疗指南,手术完整切除、术后定期随访仍是目前本病主要的治疗手段。就目前来看,保留生育功能手术仅在考虑肿瘤良性、瘤体较小的情况下适用[17]。因PEComa为间叶组织来源肿瘤,故部分学者提出可选用化疗药物行辅助治疗,但至今大多数学者认为PEComa对放化疗不敏感,且有效治疗方案不明确[18]。近年来,有学者报道用雷帕霉索靶蛋白(mTOR)抑制剂驮瑞塞尔[19]与mTOR抑制剂西罗莫斯[20]治疗PEComa取得了较好的效果,提示mTOR抑制剂在PEComa靶向治疗中有积极意义,但由于本病发病率低,术前和术中诊断困难等原因,其具体治疗效果仍有待进一步观察。
一般若PEComa病理结果提示为恶性或潜在恶性,则部分患者手术后可能需行辅助治疗,但目前资料显示,手术联合辅助放化疗患者复发率高于单纯手术切除患者,考虑原因为单纯切除者多为良性或低度恶性患者,而辅助治疗者多为恶性患者[21],虽然该结论有待进一步观察,但是这样的结论提示术后辅助治疗对于恶性PEComa的治疗有效性仍未能明确。本文7例术后仅3例(恶性2例、潜在恶性1例)随访成功,此3例术前及术后均未行辅助治疗,随访17~76个月均未发生肿瘤复发及转移。鉴于随访时间相对较短,不能排除上述患者日后复发及转移的可能性,故仍有待于进一步随访观察。
由上述相关论述可考虑,恶性及潜在恶性子宫PEComa患者行手术治疗后,若手术范围足够,是否可先行观察,不给予辅助治疗,定期复查,待发现复发及转移情况后再给予相应治疗,以免对患者造成过度伤害;另一方面由于辅助治疗效果的不确定性,术前及术后的辅助治疗在一定程度上可能会对患者造成较大的伤害。与此同时,由于目前对于恶性子宫PEComa的复发及转移时间无明确报道,因此长期随访观察、定期检查对于恶性或潜在恶性子宫PEComa患者至关重要。
综上,子宫PEComa是一种非常罕见的女性生殖系统肿瘤,临床表现无特异性、术前诊断困难,病理联合免疫组化为其诊断金标准。目前该病尚无完善的治疗体系,多行手术治疗,且手术范围多根据术者的临床经验进行选择。对于手术治疗后患者是否进行相关的辅助治疗目前争议较大,无明确临床证据表明术前及术后辅助治疗有明显的临床效果。目前本病尚无复发及转移的大致时间,因此长期随访是及时发现其复发、转移并及时治疗的关键。

